GSTP1和RasGRP1在乳腺癌中的表达及对MCF-7细胞增殖迁移能力的影响
2021-03-26戴素华朱正秋
戴素华,朱正秋
(1.徐州医科大学,江苏 徐州221002;2. 徐州医科大学附属医院,江苏 徐州221002)
乳腺癌是全球女性发病率位于第1 位、死亡率位于第2 位的恶性肿瘤[1]。世界卫生组织(WHO)发布的数据显示,全球每年新增乳腺癌病例115 万,占全部女性肿瘤的23%;死亡病例41 万,占全部女性肿瘤的14%[2]。目前乳腺癌的早期筛查诊断和预后判断已取得了显著成绩[3-4],但仍有7%的乳腺癌患者在诊断时已发生转移,5年生存率仅为10%~30%[5-6]。因此,发现并深入研究更多、有效的乳腺癌的早期诊断及靶向调控的分子靶标是改善患者生存质量及提高生存率的关键。谷胱甘肽S 转移酶P1(glutathione S transferase P1, GSTP1)与Ras 信号蛋白在大量的恶性肿瘤,如大肠癌及非小细胞癌中异常表达,且是药物抗癌的重要靶点[7-8],文献显示[9], GSTP1 和Ras 鸟苷酸释放蛋白1(Ras guanylnueleotide releasing proteins 1, RasGRP1)与三阴性乳腺癌患者的总体生存率及无瘤生存率有关,RasGRP1 是重要的Ras 信号蛋白之一,GSTP1 与RasGRP1 有可能作为潜在的三阴性乳腺癌预后的生物标志物或治疗靶点。本研究拟探讨GSTP1 和RasGRP1 在乳腺癌的表达及细胞功能。
1 资料与方法
1.1 一般资料
选取2018年1月—2019年6月徐州医科大学附属医院收治并接受手术治疗且病理确诊为乳腺癌的80 例初诊患者,术中取患者的乳腺癌组织和对应的癌旁组织。患者均为女性,年龄39~68 岁,中位年龄52 岁;肿瘤直径≤2 cm 16 例,>2~5 cm 38 例,>5 cm 26 例;淋巴结转移27 例;TNM 分 期:Ⅰ期41 例,Ⅱ期24 例,Ⅲ期15 例。纳入标准:均经术后病理诊断;术前未接受过放化疗及内分泌治疗;所有患者均有完整的临床病理资料;患者和/或家属了解手术及治疗的全过程及风险,均签署知情同意书。排除标准:除乳腺癌,患者还存在其他恶性肿瘤疾病;合并严重的肝、肾、心和脑功能障碍者;哺乳期或妊娠女性。
1.2 细胞、试剂和仪器
雌激素受体阳性人乳腺癌MCF-7 细胞株(中国科学院上海细胞生物学研究所)。GSTP1 和RasGRP1 抗体(鼠来源,南京碧云天生物科技有限公司),兔抗甘油醛-3-磷酸脱氢酶(GAPDH)和辣根过氧化物酶(HRP)标记羊抗鼠二抗(美国Abcam 公司),免疫组织化学试剂(南京泰康生物科技有限公司),四甲基偶氮唑盐(MTT)、Annexin V-FITC/碘化丙啶(Annexin V-FITC/PI)凋亡试剂盒、青霉素-链霉素混合溶液(美国Sigma 公司)。微量紫外可见光分光光度计、恒温培养箱、改良Eagle 培养基(DMEM)、胎牛血清(FBS)、Opti-MEM培养基、Lipofectamine®3000 转染试剂、质粒提取试剂盒、凝胶电泳仪、垂直电泳槽及凝胶成像系统(美国Bio-Rad 公司),OLIPICS 电子显微镜(上海精密仪器有限公司)。
1.3 GSTP1转染及分组
按Lipofectamine®3000 转染试剂说明书将空质粒(阴性对照)、GSTP1-siRNA 转染MCF-7 细胞,转染48 h,收集细胞,利用G418 抗性筛选稳定转染细胞,得到稳定转染细胞系,分别为阴性对照1组和GSTP1-siRNA 组,将同期正常生长的MCF-7 细胞作为对照1 组。
1.4 RasGRP1转染及分组
按Lipofectamine®3000 转染试剂说明书将空质粒(阴性对照)、RasGRP1-siRNA 转染MCF-7 细胞,转染48 h,收集细胞,利用G418 抗性筛选稳定转染细胞,得到稳定转染细胞系,分为阴性对照2 组和RasGRP1-siRNA 组,将同期正常生长的MCF-7细胞作为对照2 组。
1.5 指标检测
1.5.1 免疫组织化学检测GSTP1 和RasGRP1 阳性表达将乳腺癌组织和癌旁组织石蜡标本切片,厚度为3 mm/片,3% H2O2室温孵育5 min,采用去离子水冲洗,10%牛奶蛋白封闭,室温孵育5 min,加入GSTP1 和RasGRP1 抗体,37℃孵育1.5 h,滴加HRP 标记的二抗,37℃孵育30 min,PBS 冲洗,加入NBT/BCIP 显色、复染、脱水、封片,电子显微镜下观察并拍照。GSTP1 和RasGRP1 阳性结果判断标准:均在细胞质和细胞膜表达,呈黄色至棕黄色颗粒。
1.5.2 计算MCF-7细胞抑制率调整MCF-7 细胞密度为4×103个/ml,对照1 组、阴性对照1 组和GSTP1-siRNA 组分别取200 μl 于96 孔板,加20 μl 5 mg/ml 的四氮唑蓝盐(MTT)继续培养12 h、24 h和48 h,加200 μl 二甲基亚砜充分溶解,在酶标仪570 nm 波长处检测光密度(OD)值。MCF-7 细胞的抑制率=[(对照1 组OD 值-阴性对照1 组OD 值/GSTP1-siRNA 组OD 值)]/对照1 组OD 值×100%。实验重复6 次,取平均值。按上述操作再进行对照2 组、阴性对照2 组和RasGRP1-siRNA 组的MCF-7细胞抑制率的计算。
1.5.3 Transwell 法检测细胞迁移调整MCF-7 细胞密度为8×103个/ml,各组取1.0 ml 于6 孔板,取MCF-7 细胞消化液置于Transwell 小室上室,下室加入改良DMEM 培养基(含有10%胎牛血清),培养并收集透膜细胞,甲醛固定,HE 染色,计数透膜细胞数。实验重复6 次。
1.5.4 Western blotting 检测GSTP1和RasGRP1蛋白相对表达量提取蛋白,100℃温浴10 min,SDSPAGE凝胶电泳,将电泳产物转膜至PVDF,用含5%脱脂奶粉的TBST封闭2 h,分别经小鼠抗人GSTP1和RasGRP1 抗体系统处理后,采用蛋白荧光检测法判定蛋白相对表达量,Image J软件分析灰度值,β-actin为内参。实验重复6次。
1.6 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析或重复测量设计的方差分析,两两比较用SNK-q检验;计数资料以率(%)表示,比较采用χ2检验;P<0.05 为差异有统计学意义。
2 结果
2.1 乳腺癌组织和癌旁组织中GSTP1和RasGRP1的阳性表达情况
乳腺癌组织和癌旁组织中GSTP1 阳性分别为64例和34 例,RasGRP1 阳性分别16 例和53 例;与癌旁组织比较,乳腺癌组织的GSTP1 阳性表达升高(P<0.05),RasGRP1 阳性表达降低(P<0.05)。见表1和图1。
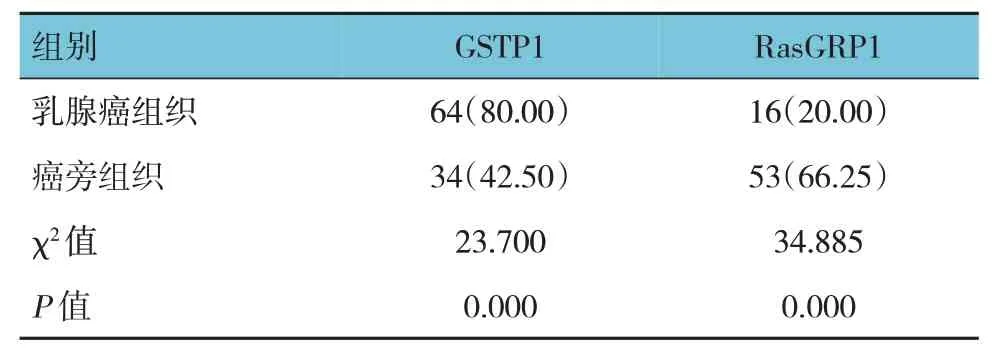
表1 乳腺癌组织与癌旁组织的GSTP1和RasGRP1阳性表达比较 [n=80,例(%)]

图1 乳腺癌组织与癌旁组织的GSTP1和RasGRP1阳性表达 (免疫组织化学×100)
2.2 不同临床病理特征乳腺癌患者的GSTP1 和RasGRP1阳性率比较
不同年龄、不同肿瘤直径的乳腺癌患者GSTP1和RasGRP1 阳性率比较,差异无统计学意义(P>0.05);有无淋巴结转移的乳腺癌患者GSTP1 和RasGRP1 阳性率比较,差异有统计学意义(P<0.05),有淋巴结转移的乳腺癌患者GSTP1 阳性率升高,RasGRP1 阳性率降低;不同TNM 分期的乳腺癌患者GSTP1 和RasGRP1 阳性率比较,差异有统计学意义(P<0.05),TNM 分期越高,GSTP1 阳性率越高,RasGRP1 阳性率越低。见表2。

表2 不同临床病理特征乳腺癌患者GSTP1和RasGRP1阳性率的比较 例(%)
2.3 各组MCF-7细胞抑制率的比较
对照1组、阴性对照1组和GSTP1-siRNA组12 h、24 h 和48 h 的MCF-7 细胞抑制率比较,采用重复测量设计的方差分析,结果:①不同时间点的MCF-7细胞抑制率无差异(F=0.628,P=0.540);②3 组的MCF-7 细胞抑制率有差异(F=88.301,P=0.000),GSTP1-siRNA 组较对照1 组和阴性对照1 组高;③3 组MCF-7 细胞抑制率的变化趋势无差异(F=0.621,P=0.651)(见表3)。对照2 组、阴性对照2组和RasGRP1-siRNA 组12 h、24 h 和48 h 的MCF-7细胞抑制率比较,采用重复测量设计的方差分析,结果:①不同时间点的MCF-7 细胞抑制率有差异(F=5.088,P=0.013);②3 组的MCF-7 细胞抑制率有差异(F=87.073,P=0.000),RasGRP1-siRNA 组较对照2 组和阴性对照2 组低;③3 组MCF-7 细胞抑制率的变化趋势有差异(F=4.999,P=0.003)。见表4。
表3 对照1组、阴性对照1组、GSTP1-siRNA组不同时间的MCF-7细胞抑制率比较 (±s)

表3 对照1组、阴性对照1组、GSTP1-siRNA组不同时间的MCF-7细胞抑制率比较 (±s)
组别12 h 24 h 48 h对照1组阴性对照1组GSTP1-siRNA组0.0±0.0 0.1±0.1 12.6±4.6 0.0±0.0 0.1±0.1 10.6±5.4 0.0±0.0 0.1±0.2 9.8±3.4
表4 对照2组、阴性对照2组、RasGRP1-siRNA组不同时间的MCF-7细胞抑制率比较 (±s)

表4 对照2组、阴性对照2组、RasGRP1-siRNA组不同时间的MCF-7细胞抑制率比较 (±s)
组别12 h 24 h 48 h对照2组阴性对照2组RasGRP1-siRNA组0.0±0.0 0.1±0.2-3.6±1.2 0.0±0.0 0.1±0.1-2.9±1.2 0.0±0.0 0.1±0.1-1.6±0.9
2.4 各组MCF-7细胞透膜细胞数比较
对照1 组、阴性对照1 组、GSTP1-siRNA 组的MCF-7 细胞透膜细胞数比较,差异有统计学意义(P<0.05);进一步两两比较,对照1 组与阴性对照1 组MCF-7 细胞透膜细胞数比较,差异无统计学意义(P>0.05),GSTP1-siRNA组MCF-7细胞透膜细胞数较对照1组、阴性对照1组减少(P<0.05)(见表5)。对照2组、阴性对照2组、RasGRP1-siRNA组的MCF-7细胞透膜细胞数比较,差异有统计学意义(P<0.05);进一步两两比较,对照2 组与阴性对照2 组MCF-7细胞透膜细胞数比较,差异无统计学意义(P>0.05),RasGRP1-siRNA 组MCF-7 细胞透膜细胞数较对照2组、阴性对照2组增加(P<0.05)。见表6。
表5 对照1组、阴性对照1组、GSTP1-siRNA组的MCF-7细胞透膜细胞数比较 (±s)

表5 对照1组、阴性对照1组、GSTP1-siRNA组的MCF-7细胞透膜细胞数比较 (±s)
注:†与对照1组和阴性对照1组比较,P<0.05。
组别透膜细胞数/个对照1组阴性对照1组GSTP1-siRNA组F 值P 值75.9±12.4 73.6±11.6 34.5±10.0†25.093 0.000
表6 对照2组、阴性对照2组、RasGRP1-siRNA组的MCF-7细胞透膜细胞数比较 (±s)

表6 对照2组、阴性对照2组、RasGRP1-siRNA组的MCF-7细胞透膜细胞数比较 (±s)
注:†与对照2组和阴性对照2组比较,P<0.05。
组别透膜细胞数/个对照2组阴性对照2组RasGRP1-siRNA组F 值P 值76.3±10.6 74.6±11.7 103.6±23.6†5.914 0.013
2.5 各组细胞GSTP1和RasGRP1蛋白表达
对照1 组、阴性对照1 组、GSTP1-siRNA 组GSTP1 蛋白相对表达量为(0.7±0.2)、(0.6±0.2)和(0.2±0.1),3 组比较,差异有统计学意义(F=14.000,P=0.000);进一步两两比较,对照1 组与阴性对照1 组比较,差异无统计学意义(P>0.05),GSTP1-siRNA组GSTP1蛋白相对表达量较对照1组和阴性对照1 组降低(P<0.05)。对照2组、阴性对照2组和RasGRP1-siRNA 组RasGRP1 蛋白相对表达量分别为(1.5±0.5)、(1.6±0.6)和(0.4±0.1),3 组比较,差异有统计学意义(F=12.871,P=0.001);进一步两两比较,对照2 组与阴性对照2 组比较,差异无统计学意义(P>0.05),RasGRP1-siRNA 组RasGRP1 蛋白相对表达量较对照2 组和阴性对照2 组降低(P<0.05)。见图2、3。

图2 各组GSTP1蛋白表达

图3 各组RasGRP1蛋白表达
3 讨论
作为GSTπ 亚家族成员之一,第GSTP15 外显子第81 位点的A→G 碱基被替代,GSTP1 酶的第105 位氨基酸由异亮氨酸变为缬氨酸,GSTP1 酶活性与底物特异性发生改变,稳定性与催化活性也显著降低。报道显示,GSTP1rs1695 基因多态性与前列腺癌、结直肠癌、食管癌、肺癌、膀胱癌及胃癌等多种恶性肿瘤的易感性有关[10-12],可能与GSTP1 参与致癌物的代谢有关。GSTP1 通过参与细胞的新陈代谢、解毒及清除损害基因的外源性化合物,抑制或缓解DNA 损伤和癌变。诱导大多数耐药的肿瘤细胞GSTP1 过表达或导入外源性GSTP1基因后,肿瘤细胞内抗肿瘤药物水平显著降低,而降低GSTP1 表达或采用反义寡核苷酸技术阻断GSTP1 后,肿瘤细胞内抗肿瘤药物水平又显著增加,同时能增强肿瘤细胞的化疗敏感性[13]。GSTP1 可能是耐药标志物之一,检测肿瘤组织的GSTP1 表达可用于预测化疗的耐药性[13-15]。GSTP1 蛋白氨基末端的变异与乳腺癌的易感性有关,研究也显示GSTP1 与三阴性乳腺癌的不良预后有关[9]。本研究结果发现,80 例乳腺癌组织、癌旁组织的GSTP1 阳性分别为64 例(80.00%)和34 例(42.50%),与癌旁组织比较,乳腺癌组织的GSTP1阳性表达率升高,有淋巴结转移患者GSTP1 阳性表达率升高,且TNM 分期越高,GSTP1 阳性表达率越高;GSTP1-siRNA 组MCF-7 细胞透膜细胞数较对照1 组、阴性对照1 组减少。本研究结果证实GSTP1 可为研究乳腺癌发生、发展机制提供重要线索,为乳腺癌治疗提供靶点。
RasGRP1 主要表达在T 细胞中,在B 细胞、神经细胞、肥大细胞和一些肾脏组织中呈低表达。除了在免疫细胞中表达,RasGRP1 在表皮角质形成细胞中也有表达,其作用是在佛波醇酯的刺激下介导Ras 的活化,过度表达RasGRP1 能通过Ras 活化使表皮在再生时对肿瘤刺激物更敏感。RasGRP1 在T 细胞、B 细胞的分化与内稳态中起重要作用,研究表明RasGRP1 在正常结直肠组织的表达高于结直肠腺癌组织,且高表达的RasGRP1 与结直肠腺癌更好的预后有关[16-17]。本研究结果发现,与癌旁组织比较,乳腺癌组织的RasGRP1 阳性表达率降低,有淋巴结转移患者的RasGRP1 阳性表达率降低,且TNM 分期越高,RasGRP1 阳性表达率越低;RasGRP1-siRNA组MCF-7细胞透膜细胞数较对照2组、阴性对照2组增加。由此可见RasGRP1 表达对乳腺癌是保护因素。
报道显示[7],大肠癌患者癌组织的GSTP1 与Ras相关蛋白表达异常,给予黄芪联用莪术治疗后发现,黄芪联用莪术可调节GSTP1 与Ras 相关蛋白而达到抑制肿瘤细胞增殖分化、促进肿瘤细胞凋亡、抗肿瘤新生血管生成及增强机体免疫的效果,由此可见GSTP1 和RasGRP1 之间存在某种紧密的关联。本研究结果发现,与癌旁组织比较,乳腺癌组织GSTP1 和RasGRP1 均呈异常表达。文献报道[18]GSTP 1 表达升高可影响下游基因转录活性,上调GSTP1表达可逆转乳腺癌对他莫昔芬和氟维司群的耐药性,增加乳腺癌对表阿霉素和紫杉醇的敏感性。WANG 等[16]使用Cox 回归对乳腺癌内在亚型调整模型的总生存期和无病生存期量化危害比的研究显示,RasGRP1 高表达与更好的总生存期相关[H^R 0.89,95%CI:(0.82,0.97)],RasGRP1 与更好的无病生存期相关[H^R 0.87,95%CI:(0.81,0.95)],GSPT1表达与较短的无病生存期相关[H^R 1.33,95%CI:(1.14,1.55)],提示GSPT1 与RasGRP1 可以作为乳腺癌的潜在预后生物标志物和/或治疗靶标。RasGRP1低表达及GSTP1 高表达可直接影响淋巴母细胞性淋巴瘤对药物的敏感性和耐受性[19],可见GSTP1 和RasGRP1 之间关系密切,但两者之间的关联仍需深入探讨。
综上所述,GSTP1 和RasGRP1 在乳腺癌均呈异常表达,可影响MCF-7 细胞增殖迁移能力。
