普鲁士蓝纳米颗粒在肿瘤治疗中的应用进展
2021-03-26王小巍张红艳王东凯
刘 锐,王小巍 ,张红艳,王东凯*
(1. 沈阳药科大学 药学院,辽宁 沈阳 110016;2. 沈阳药科大学 中药学院,辽宁 沈阳 110016)
近几年,全球范围内肿瘤的发病率逐年上升,癌症已经成为严重威胁人类健康的疾病之一。因此,抗肿瘤药物的研制刻不容缓。目前,以分子靶向药物,单克隆抗体为代表的一系列创新药物的临床应用极大地提高了肿瘤的治疗效果[1]。但由于肿瘤组织的特殊构造以及传统抗肿瘤药物靶向性差的特点,加大了抗肿瘤药物研发的难点。研究发现,纳米医学为解决这一问题提供了新的思路。纳米粒具有粒径小和表面功能稳定的优势,为靶向肿瘤微环境提供了可能[2],同时这种方法也弥补了传统化疗药物的局限性,为药物能够靶向肿瘤细胞提供了一个理想的平台[3]。
普鲁士蓝(Prussian blue, PB,图 1)是混价过渡金属六氰基铁酸盐(Fe3+4[Fe2+(CN)6]3·nH2O)的原型,是一种深蓝色颜料[4]。在普鲁士蓝的组成结构中,二价铁和三价铁离子之间以氰基相连,具有均一的晶格构造[5]。这种晶格构造使 PB 具有光物理、电化学和电致变色等优异的特殊性能。同时 PB 具有合成过程简单、所需原料价格低廉等优势;更重要的是 PB 具有高生物相容性,是FDA 批准的临床上用于治疗放射性中毒的药物[6]。
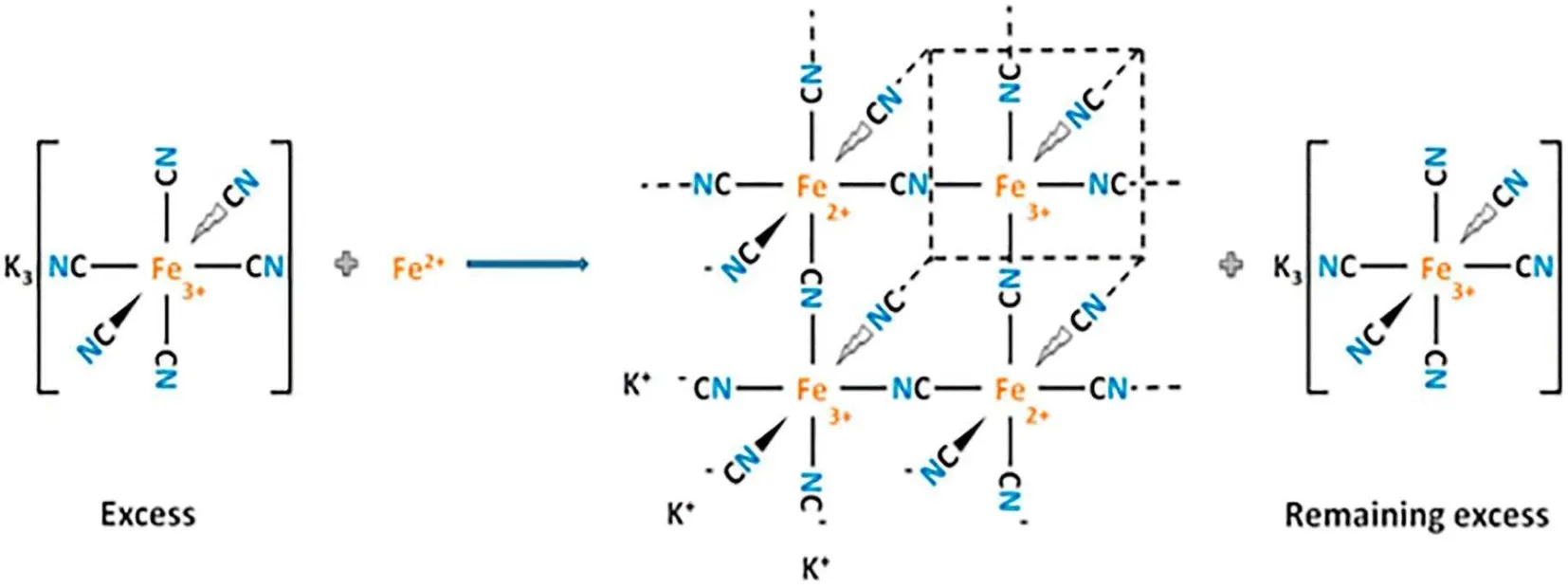
Fig. 1 Iron hexacyanoferrate reacts with Fe2+ to form soluble PB compound [10]图 1 六氰亚铁与Fe2+反应生成可溶性PB 化合物[10]
据研究显示,PB 纳米微粒具有靶向作用,可以通过实体瘤内高通透性和滞留效应(enhanced permeability and retention effect, EPR)被动靶向到肿瘤部位[7];而且,PB 结构中的 Fe3+和 Fe2+之间的电荷转移,使 PB 在 NIR 区域显示出强烈的近红外吸收[8],因此在递送药物的同时还可以进行成像。此外,PB 纳米微粒的化学稳定性相对较高,具有较高的生物安全性。上述相关研究为 PB 作为纳米载体在肿瘤治疗中的应用奠定了坚实的生物医学基础[9]。
1 普鲁士蓝作为纳米载体在肿瘤治疗中的应用
1.1 光热治疗
近红外光热治疗是借助特殊纳米材料在 NIR 区域有吸收的特性,将吸收的近红外光能转化为热能从而杀死癌细胞的治疗手段。由于近红外光对人体的损害小,同时通过调节外部激光照射时的位置以及功率大小,可以准确定位并作用于肿瘤[11]。理想的光热材料应该具有光热转化效率高,可在肿瘤部位积累等特点。目前常用的光热材料有:金纳米材料、碳纳米材料、有机光吸收剂等。PB 由于其特殊的晶格结构使其具有近红外区的光吸收特性[12],已经成为新型激光引导试剂,被广泛研究于肿瘤消融的应用中。
Xue 等[13]通过薄膜水合法将油酸修饰后的疏水性 PB 负载到聚乙二醇形成的纳米“胶囊”中,制备了一种聚乙二醇修饰的磁性普鲁士蓝核壳结构的纳米粒子(Fe3O4@PB/PEG/DOX)用于靶向光热消融。这种纳米粒子在 808 nm 激光照射下温度可以升到 48 ℃,该温度被证明是肿瘤的消融温度[14],实验中采用周期性激光照射的方法考察了纳米粒子的光热稳定性,结果发现连续4 个照射周期内,峰值温度无明显变化,这些都可以说明 PB 作为光热剂具有良好的光热转化效率和光热稳定性。
Cheng 等[15]通过静电吸附作用将合成的立方体 PB 表面包覆聚乙二醇(Prussian blue polyethylene glycol, PB-PEG NCs),该纳米粒在各种生理溶液中都具有很高稳定性。利用 PB 近红外吸收的特性,进行体内肿瘤治疗。将 PB-PEG NCs 注射进肿瘤模型小鼠,然后用近红外激光照射肿瘤,与注射生理盐水组的小鼠相比,注射纳米粒小鼠的肿瘤大小明显降低。并且,在测试的剂量下,PB-PEG NCs 在两个月内对小鼠没有明显的毒性。这也再一次证明 PB 纳米材料具有较高的生物相容性,可以作为光热转换剂用于肿瘤光热治疗。
1.2 基因治疗
基因治疗是通过引入外源性核酸永久或暂时取代缺陷基因的一种新兴技术[16]。肿瘤的基因治疗是指将目的基因导入受体体内有关的靶细胞内,使其发挥特定的功能,从而执行或介导对肿瘤的杀伤和抑制作用[17]。而基因治疗药物存在被体内的核酸酶降解和靶向性差的问题,纳米载体为此提供了解决方案。
Liu 等[18]设计了一种多功能 PB 纳米热敏平台,首先将 PB 表面包覆一层聚乙酰亚胺,使其表面呈正电荷,然后通过静电作用将显负电荷的具有治疗作用的质粒 DNA(HSP70-P53-GFP)负载到 PB 上。研究结果表明,负载质粒的 PB NCs 具有良好的形态特征,并且在弱近红外激光照射下,产生的热效应能够诱导 HSP70 启动子调控真核表达质粒中目的基因 p53 的表达效率,从而杀灭肿瘤细胞,实现了基因治疗与光热治疗的协同作用。
Wang 等[19]使用 PB 作为纳米载体,将一种 DNA 药物导入癌细胞,这种 DNA 药物是一种核苷酸(decoyoligodeoxyuncleotide, dODN),可抑制信号转导和转录激活因子 3(signal transducer and acyivator of transcripyion, STAT3)。结果表明 dODN 分子成功的进入到肿瘤细胞,并且可以在细胞内的胞质区和核区均匀分布。同时研究发现随着 dODN 与 PBNPs 的结合量以及 DNAPBNPs 药物的内化剂量的增加,对肿瘤细胞的杀伤能力增强。
1.3 化学治疗
化学治疗是指利用化学药物杀死肿瘤细胞从而达到肿瘤治疗的方式,是目前肿瘤治疗最有效的手段之一[20]。多项研究表明纳米载体利用纳米材料特有的生物学效应—EPR 效应,有助于化学药物到达肿瘤部位。这种效应能够将纳米载体被动靶向运输到肿瘤组织,有利于负载在纳米载体上的药物发挥抗肿瘤作用。
Jing 等[21]将 10-羟基喜树碱负载到透明质酸接枝聚乙二醇修饰的普鲁士蓝中空纳米颗粒中。通过对肿瘤小鼠体质量变化、组织学损伤和血液生化指标的研究,结果表明该纳米制剂具有良好的生物相容性。体外和体内实验均证明,负载 10-羟基喜树碱的透明质酸修饰普鲁士蓝纳米粒可以将肿瘤药物靶向性地运输到肿瘤细胞中,并且表现出光热化学联合治疗的优势,与单独使用任何一种治疗方式相比,具有更好的疗效。
Chen 等[22]通过疏水作用将药物阿霉素(doxorubicin, DOX)包埋在聚乙二醇基化的 PB 纳米粒子中,形成聚乙二醇化的 PB-DOX 纳米粒子。研究表明该纳米粒具有高包封率和载药量,并且聚乙二醇有良好的生物相容性和低细胞毒性,可以将更多的阿霉素运输到肿瘤组织中,达到化学药物靶向治疗肿瘤的效果。
2 普鲁士蓝作为造影剂在肿瘤诊断中的应用
2.1 磁共振成像
磁共振成像(magnetic resonance imaging, MRI)是根据生物磁性核(氢核)在磁场中表现的特性进行成像的新技术[23]。因 MRI 具有良好的软组织分辨率、多方位成像、多参数功能成像等优点,逐渐成为肿瘤诊断的重要影像学检查方法[24]。而在临床癌症检查中为了提高病变部位与正常组织的成像对比度,常会使用到造影剂改变驰豫时间。普鲁士蓝中存在 Fe2+和 Fe3+混合价态的六氰合铁酸盐,每个结构单元中存在 5 个未配对电子。这种特殊的结构,可以缩短 MRI 的横向或纵向弛豫时间,从而提高成像的对比度,故 PB 可作为造影剂应用于磁共振成像中[17]。
Fu 等[25]研制出了一种超顺磁性 Fe3O4纳米核周围生长 3~6 nm 普鲁士蓝(PB)纳米壳的核-壳纳米粒用于磁共振成像。体内外实验均证明,空白纳米粒可增强 T2 加权磁共振成像的对比度。而具有 Pb 纳米壳结构的纳米粒有着更强的磁共振呈像的作用。Cheng 等[15]开发出基于普鲁士蓝结构的纳米立方体,不仅具有光热治疗的效果,而且可用于体内T1 加权磁共振成像。综上可知 PB 为肿瘤成像引导的癌症治疗创造了巨大前景。
2.2 光声成像
光声成像(photoacoustic imaging, PAI)是近年来迅速发展起来的一种依赖于生物组织光吸收的无创、低成本的成像技术,可以弥补现有成像模式的缺陷,并提供目前无法获得的诊断信息[26]。光声成像的原理如下,当激光照射生物组织时,组织吸收能量,同时受热膨胀产生压力变化,进而激发声波,产生光声信号,最终成像[27]。由于 PB 在近红外区域有着强吸收,因此可以作为光声成像的造影剂。
Cheng 等[28]以成像和治疗效果一体化为目标,构建了一种同时具有 PAI 和光热治疗(photothermal therapy, PTT)良好性能的载药系统。该系统将 PB 装载于 pH 响应性水凝胶中,这种水凝胶只有在酸性条件下降解。伴随着水凝胶的降解,PB 在肿瘤部位聚集,在近红外灯的照射下,聚集的 PB 有着良好的 PAI 性能,从而发挥成像的功能。
3 结论
普鲁士蓝作为 FDA 批准的治疗铊和铯等重金属中毒的口服药物,由于其良好的生物相容性和可靠的临床安全性,如今已经被开发成为一种新型纳米载体,广泛用于光热治疗、化学治疗、基因治疗、肿瘤磁共振和光声成像。相信随着研究的不断深入,早日实现普鲁士蓝的临床应用。
