跨血脑屏障纳米递药系统的研究进展
2021-03-26桑丽红王东凯
桑丽红,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
血脑屏障(blood brain barrier, BBB)是介于血液和脑组织之间的动态屏障,由脑部毛细血管内皮细胞及其细胞间紧密连接的基底膜、周皮细胞和星形胶质细胞围成的神经胶质膜构成。作为维护中枢神经系统内环境稳定的物理和功能屏障,对进入的分子具有极其严苛的选择性和限制,阻挡了 98% 的小分子物质和几乎所有大分子从血液进入脑组织[1]。近年来,中枢神经系统(central nervous system, CNS)疾病的发病率不断升高,这类疾病具有病程长、治疗进展缓慢等缺点。为了使CNS 疾病得到充分治疗,可以采用脑部给药方式,如直接脑部注射给药、被动靶向给药及主动靶向给药等。基于 BBB 中受体和转运体的发现,使主动靶向成为现代脑靶向递药系统研究的热点。主动靶向包括受体介导、转运体介导及吸附介导三种方式。
1 血脑屏障的生理学基础
BBB 是一种脂质膜,其毛细血管内皮细胞紧密连接处的“有效”孔径仅为 1.4~1.8 nm。鉴于该膜的亲脂特性和形态结构,外周血管中的脂溶性小分子物质可以直接通过与脂质膜融合进入脑内,水溶性小分子药物也可以直接经膜表面的细胞间隙扩散入脑,而大分子物质如蛋白质、多肽和基因药物则无法借助被动扩散穿过 BBB 进入脑内,只能依靠其他转运方式如特异载体通道、吸附介导或特异受体介导的吞饮等途径进入脑内(脑毛细血管内皮细胞间紧密结合的神经胶质带负电荷,因此,带正电荷或电中性的药物比带负电荷的更容易透过 BBB)。BBB 不是一个被动性的保护屏障,它不仅能选择性地将脑组织新陈代谢所需的多种营养物质转运至脑内,还能将脑内有害或过剩的物质转运到脑外,以此来保持脑内环境的稳定。血脑屏障的结构图见图1[2]。
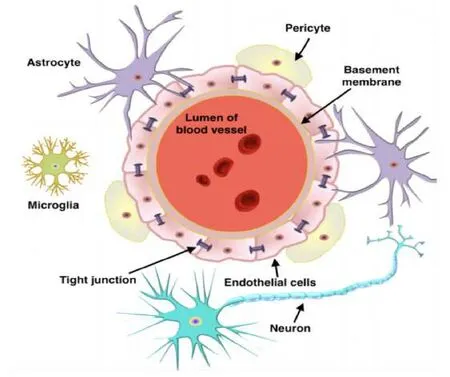
Fig. 1 Schematic diagram of the blood-brain barrier图 1 血脑屏障的结构图
连接这些内皮细胞的是星形胶质细胞及其各自的尾-足、周细胞、内皮细胞、神经元和基底膜,主要由结构蛋白构成[3],具体见表 1。
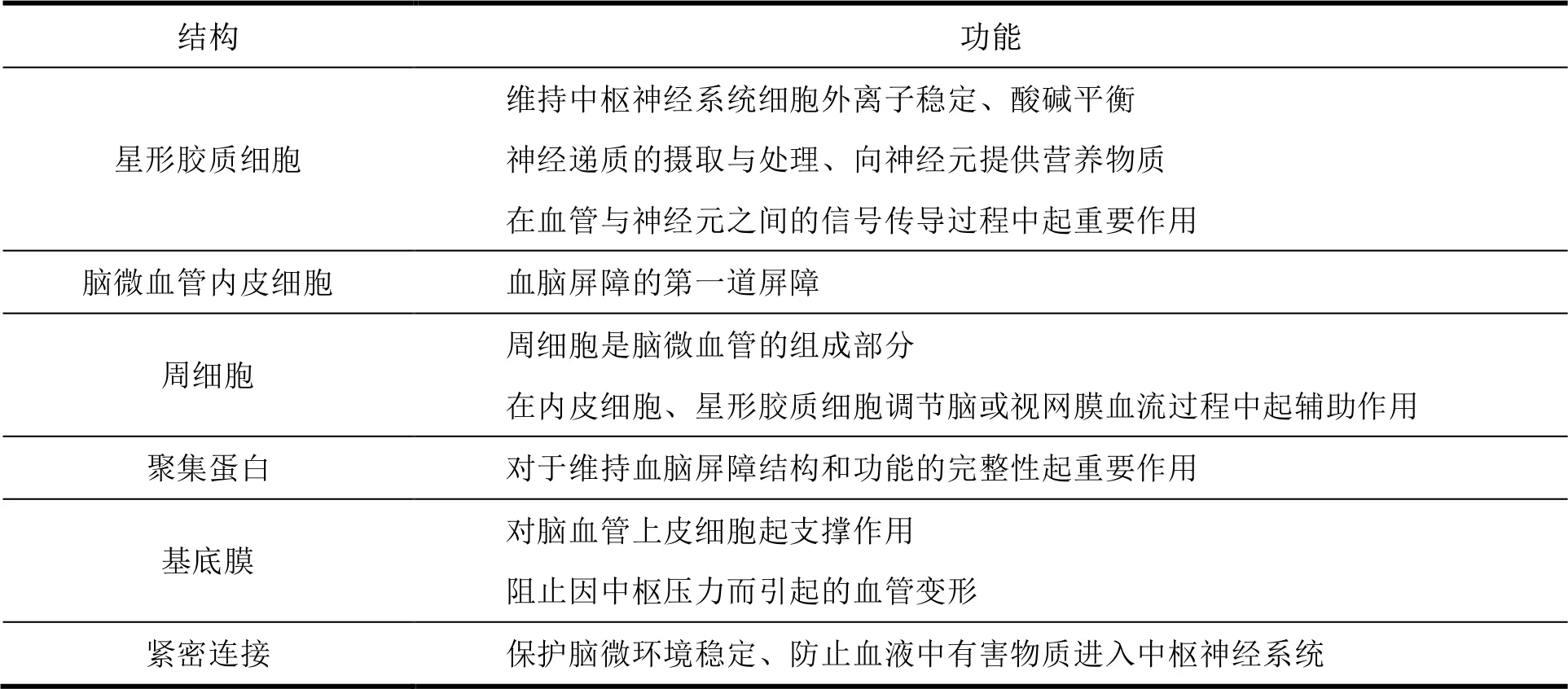
Table 1 Main structures and functions of blood-brain barrier表 1 血脑屏障的主要结构和功能
2 脑部递药的药物载体
2.1 脂质体
脂质体是一种由类似生物膜结构的双分子层构成的微小囊泡,可呈递疏水和亲水性药物,如小分子药物、肽、蛋白质和 RNA 等。其独特的磷脂双分子层结构,使其更容易穿透 BBB,并有助于药物分子进入大脑。由于安全性好、适用范围大,脂质体是研究最为广泛的载体。目前,已经对脂质体表面进行了大量的修饰,以提高其脑靶向能力。借助某些特定配体(葡萄糖、乳铁蛋白、转铁蛋白,特异性肽),脂质体能有效地穿过血脑屏障并将药物运送到特定部位[4]。刘薇芝等[5]采用薄膜分散超声法制备冰片-葛根素脂质体,结果表明,经冰片修饰的葛根素脂质体具有较好的脑靶向性。王吉平等[6]采用改良薄膜分散法制备栀子提取物类脂质体,研究其在大鼠体内的药物分布特点及靶向性时发现,栀子提取物类脂质体改变了栀子苷在大鼠体内的组织分布,可靶向作用于脑组织。
2.2 纳米粒
纳米粒是指粒径在 10~1 000 nm 的固体胶状物质,可由聚合物或者脂类制备,通常以静脉注射方式给药。无机材料包括金、铁、铈、钼、二氧化硅,有机材料包括海藻糖、PLGA(poly(lactic-co-glycolic acid))和 PLA(polylactic acid)等。纳米给药系统在比表面积、表面能以及表面原子等方面表现出了独特的效应,已成为解决药物分子量大、稳定性差、吸收性差、靶向或控释等问题的方法之一。纳米粒子被广泛用于治疗神经退行性疾病的原因是:(1)纳米粒子具有相对较高的载药量和较小的体积,并将活性成分以持续或恒定的速度输送至靶部位;(2)纳米粒子,特别是无机纳米粒子,表现出优异的成像性能;(3)部分纳米粒子材料本身具有一定的治愈功效,包括抗氧化、降低 ROS(reactive oxygen species)水平甚至抑制Aβ 聚集。它使纳米粒子成为神经退行性疾病治疗的重要载体[7]。
纳米粒子作为药物载体,为不能透过血脑屏障的 CNS 药物入脑提供了新途径,在 CNS 疾病治疗中起到了重要作用。紫杉醇(paclitaxel)虽能对一系列肿瘤产生药效,但因难溶于水,且其早期常用的药物载体聚氧乙烯蓖麻油及无水乙醇会引起超敏反应,因此在临床应用方面受到限制。利用 PLGA 纳米粒子包裹紫杉醇,不仅能达到很高的包封率,增加紫杉醇的水溶性,提高其理化稳定性,同时能减少紫杉醇固有毒性及副反应,且药物释放动力学能被很好的控制,在 29例不同的癌细胞株包括神经细胞的体外实验中,其引起的癌细胞死亡率是对照组的 13 倍[8];阿霉素(doxorubicin, DOX)载入表面经聚山梨酯 80 修饰的纳米粒子,将其注射到脑部胶质瘤的大鼠,能明显抑制癌细胞增殖,增加大鼠存活率,并且无神经毒性[9]。
2.3 纳米胶束
与纳米粒和脂质体相比,胶束在治疗神经退行性疾病方面的研究相对较少。纳米胶束具有粒径大小和形状可控,包封率和载药量高的优势。姜黄素作为治疗 AD 的模型药物,与吐温-80 联合制成姜黄素胶束。结果显示,姜黄素胶束能使小鼠血浆生物利用度提高约 45 倍,与姜黄素纳米粒子(9 倍)和姜黄素脂质体(5 倍)相比,是提高姜黄素生物利用度的最有效配方[10]。其他活性药物,例如治疗 AD(Alzheimer"s disease)的氟比洛芬[11]、治疗 PD(parkinson"s disease)的辅酶 Q10[12]制成纳米胶束均增加了脑穿透量、溶解度和生物利用度。Rashed 等[13]制备了一种具有放射性的尼莫地平载脂-普朗尼克(Pluronic)胶束,小鼠经鼻腔给药后用放射性标记法测得小鼠脑部药物浓度为对照组的 18 倍。结果显示,纳米胶束中药物的溶解度、吸收度均显著增加,表明该纳米胶束通过鼻腔给药后可将药物高效靶向地递送至脑组织。
2.4 树枝状聚合物
树枝状聚合物是一种具有单分散性、球状外形和表面众多官能团的高分子,其空腔可包覆药物分子,末端基团经修饰后可连接脑靶向功能分子,因此其在脑靶向给药系统中具有很大的应用价值。PAMAM(polyamidoamine)是树枝状聚合物中最为广泛应用的材料[14]。当材料表面连接亲水或疏水的聚合物嵌段时,可延长体内循环时间。许多有机分子水溶性差、生物利用度低,因而向脑内输送具有挑战性。以氟哌啶醇为例,其水溶性差,Katare 等[15]分别采用鼻腔给药和腹腔注射给药研究以 PAMAM 为载体的氟哌啶醇入脑后的靶向性。结果表明,与腹腔注射氟哌啶醇比较,氟哌啶醇鼻腔给药后在脑内的浓度更高。
2.5 微乳或纳米乳
微乳(microemulsion, ME),又称纳米乳(nanoemulsion, NE),是由水相、油相、表面活性剂和助表面活性剂以适当比例自发形成的一种纳米级递药系统。油相成分如中长链甘油三酯和植物油脂能增加药物与脑部毛细血管内皮细胞的亲和性,表面活性剂和助表面活性剂能抑制或降低BBB 的 P-糖蛋白(P-gp)对药物的外排。丙戊酸(valproic acid, VA)是治疗癫痫的水溶性前体药物,Tan 等[16]制备了丙戊酸微乳,腹腔注射丙戊酸微乳后,脑部的 AUC 为溶液组的 4.38 倍。具体详见表2。
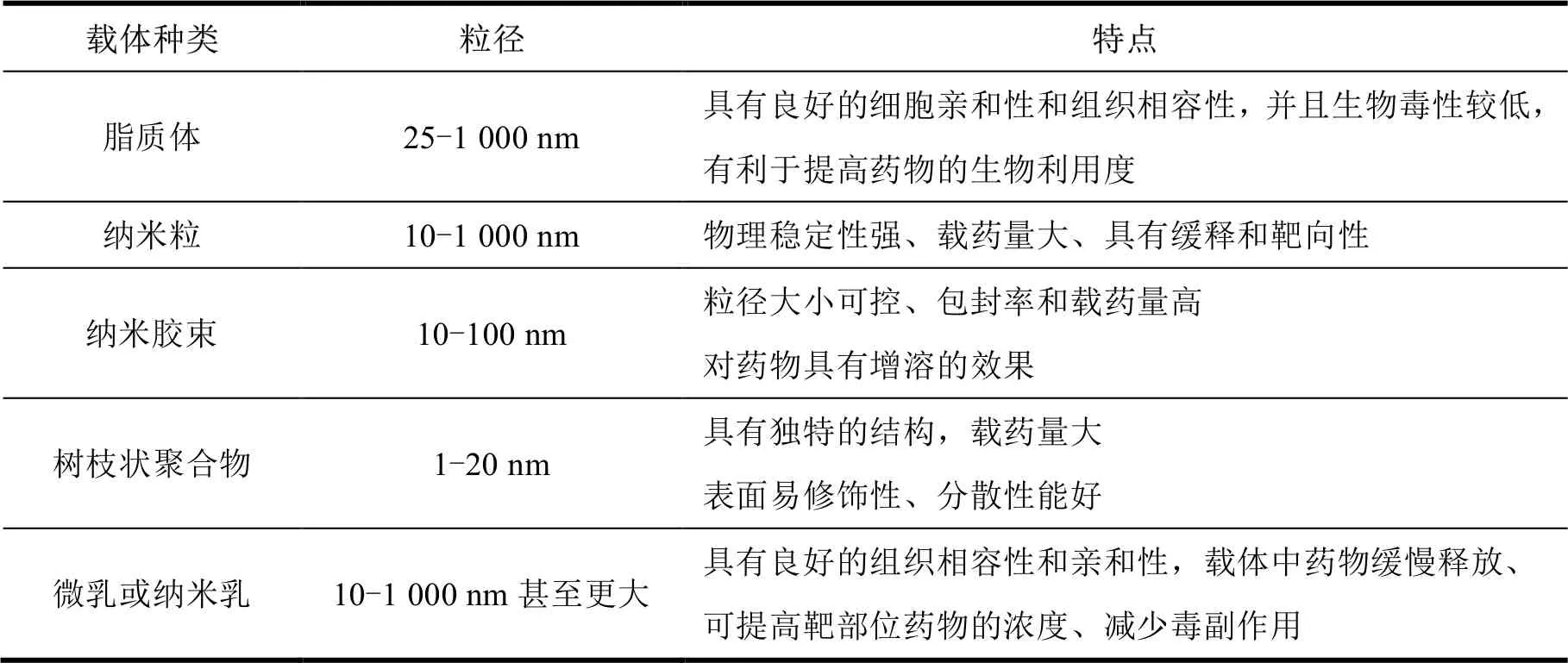
Table 2 A list of brain-targeted nanoparticles for drug delivery systems表 2 脑部靶向纳米载药系统的载体一览表
3 药物载体跨血脑屏障的机制
尽管 BBB 严格控制着脑组织和血液的物质交换,但在生理条件下也具有保证脑内营养物质平衡的能力。在积极摄取脑细胞所需营养物质的同时,排泄代谢产物。这种生理条件下的物质交换过程,为脑部递药系统的设计提供了依据。目前认为,BBB 的生理结构使其具有特殊的转运机制,主要包括跨细胞膜通道转运和细胞旁路通道转运。
3.1 跨细胞膜通道转运
跨细胞膜通道转运主要有以下几种方式:⑴载体蛋白参与的脑内摄取。已知的载体蛋白主要包括 GLUT1(glucose transporter 1)、L 型氨基酸转运体、有机离子转运体等。⑵受体参与的脑内摄取。这种方式主要依赖于脑毛细血管内皮上表达的受体对配体的特异性识别、结合并介导药物载体穿过细胞进入脑部的过程[17]。⑶吸附作用介导的脑内摄取。吸附介导的脑靶向递药系统的设计原理是载体表面的正电荷与 BBB 膜上的负电荷之间产生的静电作用[18]。相关研究[19]表明,吸附介导的跨细胞转运呈时间和药物浓度依赖性,跨细胞转运过程中需要能量参与,整个过程速度较慢,可以持续数分钟;吸附介导呈非特异性结合,亲和力低但结合容量大,不易产生饱和现象。
3.1.1 转运体参与的脑内摄取
(1)葡萄糖转运体
BBB 上有大量的转运体,其中葡萄糖转运体(GLUT1)是 BBB 中最高效的转运体,GLUT1存在于血液、脑、胎盘和成熟组织中,在血液-组织屏障中广泛存在,是吸收葡萄糖,跨血液-组织屏障的基本载体[20]。采用葡萄糖修饰的载药系统,通过与 GLUT1 的特异性结合,介导药物跨过 BBB,最终达到增加脑内药物浓度的目的。Zhao 等[21]将文拉法辛和葡萄糖连接形成前药,增加了前药在脑内的分布,同时增加了药物在血浆中的稳定性。张诚翔等[22]以2-氨基-2 脱氧-β-D-葡萄糖为靶向分子,结合抗癌药表柔比星,制备出多功能靶向性表柔比星脂质体,增加了脑毛细血管内皮细胞对多功能性多柔比星脂质体的摄取,也提高了脑胶质细胞内药物的含量。
(2)氨基酸转运体
脑内合成蛋白质需要的必需氨基酸必须依靠外周血液转运到大脑进行供给,大部分的必需氨基酸通过血脑屏障需要特异性的氨基酸转运体所介导。药物载体也可通过氨基酸转运体的介导跨过血脑屏障,进入脑内发挥治疗作用。根据转运蛋白在转运药物载体时,是否需要 Na+的协同作用,分为 Na+依赖性和 Na+非依赖性转运系统。Na+依赖性转运系统利用质膜上 Na+电化学梯度所储存的化学能进行物质转运,而 L 系统作为 Na+非依赖性转运系统存在于血脑屏障内皮细胞的基底膜上。对于相对分子质量较大的底物而言,L 系统的转运具有广泛的特异性。因此,这一转运系统作为中枢神经系统药物的转运载体具有重要意义。有研究表明,人体在餐服高蛋白的饮食之后,左旋多巴的作用显著降低,脑内左旋多巴分布减少是由于高蛋白进食引起血浆中的氨基酸浓度大量升高,使 L 氨基酸转运系统饱和所致[23]。另外,抗癫痫药加巴喷丁也是通过 L 氨基酸转运体转运进入脑组织[24]。
(3)有机离子转运体
OCT(organic cation transporter)家族是一种具有多特异性特点的转运体。目前研究发现 OCTs主要有 OCT1、OCT2、OCT3 型,其中,OCT3 也被称为神经单胺转运蛋白,在脑组织中广泛表达。OCT3 可介导单胺类神经递质如多巴胺、去甲肾上腺素、5-羟色胺的转运。此外,肌酸、磷酸肌酸对于哺乳动物的大脑能量平衡起着关键作用,而肌酸、磷酸肌酸的积累可能会引起大脑异常放电和抽搐现象的发生。在 BBB 中表达的 OCT3 作为肌酸从血液入脑的主要转运蛋白,可调节中枢神经系统中肌酸的浓度[25]。OAT(organic anion transporters)家族是一组超过 10-跨膜蛋白构成的 SLC22(solute carrier 22)亚家族,具有广泛的底物特异性,在有机阴离子的转运中起关键作用。
BBB 上的转运体对于中枢神经系统所需的营养物质转运及阻止有害物质入脑发挥重要作用,且在药物转运方面具有关键作用。
3.1.2 受体参与的脑内摄取
BBB 表面上有能够特异性识别的内源性受体。常见的受体包括 TfR(transferrin receptor)、LRP(low density lipoprotein receptor-related protein)、nAChR(N-acetylcholine receptor)、唾液酸受体、清道夫受体 BI、白喉素受体、缓激肽受体B2 等[18]。
(1)转铁蛋白受体
转铁蛋白(transferrin, Tf)是一种能与 TfR 特异性结合的跨膜糖蛋白,在正常细胞中含量较少,但在 BBB 细胞中含量较多,TfR 的过度表达已被众多研究人员用于改善药物的 BBB 运输[26]。BCNU(carmustine)是最常用的脑胶质瘤化疗药物,可以通过 BBB 到达脑内发挥治疗作用,但静脉给药时出现严重的副作用。因此,研究者用转铁蛋白修饰 PLGA 载体,采用超声乳化法制备了新型的 Tf-BCNU-PLGA 纳米粒系统[27]。与无转铁蛋白修饰的载药纳米粒相比,转铁蛋白修饰的纳米粒对鼠 C6 胶质瘤细胞的抑制效果更强。Cao 等[28]在 Dox 脂质体表面修饰转铁蛋白和叶酸,实验结果表面小鼠的存活率强、且毒性低。
(2) 低密度脂蛋白受体相关蛋白
LRP-1 是一种细胞表面广泛表达的跨膜蛋白。虽然在脑微血管内皮细胞上的含量不及 TfR,但其介导的跨膜效率是 TfR 的70 倍。LRP-1 的配体有多种,如载脂蛋白 E、基质金属蛋白酶及丝氨酸蛋白酶等。Angiopep 是来源于 Kunitz 域家族的衍生肽,是 LRP-1 的配体且跨膜转运能力强。Yainoy 等[29]通过原核表达系统表达了 Angiopep-2 与过氧化氢酶融合蛋白 CAT-AP2 结合,CAT-AP2 保持了过氧化氢酶活性并能高效的被脑微血管内皮细胞摄取。将 Angiopep-2 融合表达到单链 Fab 抗体的 C 端后,也发现单链 Fab 抗体体外渗透性得到极大提高,小鼠脑内跨血脑屏障转运效率及脑内分布量得到极大提升。说明 Angiopep-2 能显著提高大分子的跨血脑屏障能力。(3)N-乙酰胆碱受体
乙酰胆碱受体是一种整合膜蛋白。N 型 AChR 是离子通道型受体,在中枢神经系统和周围神经系统高度表达。研究者发现以多肽逆序合成法制备的DCDX (一种来源于短神经毒素Candoxin的 D 型多肽,可以与 nAChR 结合发生胞转作用)可以有效地抑制溶酶体对 CDX 的降解,提高在血液中的稳定性。体内外实验表明,DCDX 具有较高的体外 BBB 转运速率,经DCDX 修饰的脂质体细胞摄取率更高。同时,对脑胶质瘤裸鼠注射后,荷瘤小鼠的生存期明显延长[30]。
除上述常见的受体以外,用于脑靶向的受体还包括唾液酸受体、清道夫受体 BI、白喉素受体、缓激肽 B2 受体等[31]。Yin 等[32]采用唾液酸修饰硒纳米粒,并包覆 BBB 通透性高的多肽-B6 肽段,构建了纳米递药系统。研究显示,由于唾液酸受体与唾液酸的特异性结合,使得该纳米递药系统具有较高的脑部转运效率。清道夫受体 BI 能够与高密度脂蛋白特异性结合,在中枢神经系统也有表达,故以高密度脂蛋白为功能基可通过该受体介导入脑。Kreuter 等[33]以 NHS-PEG-Mal(a bifunctional PEG)为连接臂,将 apoA-1(serum apolipoprotein)共价修饰在载洛哌丁胺的血清白蛋白纳米粒表面上,结果表明该纳米粒对小鼠的镇痛效果强于洛哌丁胺溶液。白喉素受体存在于 BBB、神经元和胶质细胞上,而且在病灶部位的脑毛细血管上高度表达[18]。CRM197 是白喉素受体的配体。将 CRM197 修饰于聚氰基丙烯酸正丁酯纳米粒表面,血脑屏障透过性增强[34]。缓激肽 B2 受体在正常脑组织内很少表达,但在胶质瘤组织内高度表达;血管活性物质缓激肽或其类似物 RMP-7 可以与缓激肽 B2 受体特异性结合,进而打开血肿瘤屏障,最终增强神经胶质瘤疾病的治疗效果[35]。
然而,受体介导也存在一定缺点,受体不但在 BBB 细胞中广泛存在,同时在其他外周器官的毛细血管上也高度表达。所以,在达到脑靶向的同时也会增加外周组织的药物累积。
3.1.3 吸附作用介导的脑内摄取
阳离子纳米递药系统与脑部微脉管带负电荷的细胞腔侧有较好的结合能力,可提高脑脊液内纳米粒的含量,并通过吸附介导的转胞吞作用实现药物的脑内递送[36]。Popov 等利用 Bola 型两亲分子 GLH-19 和 GLH-20 人工合成脂质自组装阳离子单层膜载体,用于递送镇痛肽类药物[37]。脂质表面的乙酰胆碱带正电荷,促进转胞吞作用,有利于透过生物屏障。体内试验表明该载体能穿过 BBB,将药物成功递送至脑部,可延长镇痛时间。Wang 等利用自组装阳离子纳米粒治疗脑炎,纳米粒能穿透 BBB,产生与两性霉素相似的效果,且不易对肝、肾功能产生不利影响[38]。因此,阳离子纳米递药系统对于脑部靶向给药具有重要意义。
细胞穿膜肽(CPPs)是具有穿透细胞膜功能的正电荷多肽片段,富含精氨酸、赖氨酸等碱性氨基酸残基。以细胞穿膜肽修饰的纳米递药系统主要通过吸附介导的内吞作用实现跨膜转运,提高脑部药物的递送能力。Yang 等[39]制备了 CPPs 与聚乙二醇共修饰的卡巴他汀脂质体,体外实验表明,该脂质体的 BBB 穿透能力强,显著提高了卡巴他汀在脑内的分布。
3.2 细胞旁路转运
细胞旁路转运大多是被动进行的,主要是通过细胞结构的动态变化控制旁路通道的开放和关闭从而实现药物载体向脑部的输送。因此,该种方式具有较高的传送效率和较低的选择性。目前,常采用一些策略扰乱 BBB 的稳态从而使药物入脑。
采用此种方法时尽可能将扰乱部位限制在 BBB 周围、时间尽可能缩短、扰乱的尺度尽可能控制在恰好能够使药物通过的孔径。临床上已有通过此方法介导药物入脑的例子,如动脉内注射髙渗溶液甘露醇,治疗胶质瘤、神经外胚层瘤等[40];缓激肽和其类似物用于干扰 BBB 而治疗胶质瘤等[41];也可通过磁场、超声、辐射等方式破坏 BBB 结构的完整性从而实现脑内药物的递送。例如,Qiu 等报道蛋白激酶 C 信号通路在电磁脉冲诱导 BBB 通透性变化方面起着重要作用[42]。当受到强度为 200 kV•m-1、频率为 1 Hz、脉冲 200 次的电磁脉冲辐照 0.5 h 后,大鼠大脑皮层BBB 通透性开始增加,辐照 3 h 后 BBB 通透性增加最明显。Nance 等利用核磁共振成像引导的聚焦超声技术成功研制出 1 种可生物降解的聚合物纳米粒——PLGA-PEG NPs 导入脑组织[43]。荧光成像明显观察到 PLGA-PEG NPs 富集于脑内皮细胞和脑组织间隙中,而未采用该技术的对照组纳米粒在脑组织中没有荧光信号。具体详见表 3。

Table 3 The mechanism of nanocarriers across blood-brain barrier表 3 纳米载体跨血脑屏障的机制
4 结论
克服 BBB 的纳米递药系统将药物顺利递送至中枢时,或许只有某种机制在起作用,但很大程度上是多种机制同时作用的结果。近年来,中枢神经系统疾病的发病率不断上升,特别是脑肿瘤死亡率更是居高不下,脑靶向递药研究是热点话题。虽然许多脑疾病的机制尚未完全阐明,但认为最主要的原因是 BBB 的结构受到破坏。随着纳米生物技术的飞速发展,纳米医学在神经疾病的研究中显示出巨大的潜力。虽然许多纳米材料已被 FDA 批准或进入临床试验,但基于纳米材料的脑部药物传递系统的临床使用仍然有限,主要原因:(1)跨血脑屏障的体内外模型仍有待进一步研究;(2)纳米材料的安全性和副作用仍有待研究;(3)纳米载体的性质,包括表面性质、粒径、负载剂和宿主材料对跨 BBB 的影响仍需进一步评估。
