介孔二氧化硅纳米粒作为药物载体研究进展
2021-03-26李艳梅张宇佳陈明曦王东凯赵云丽
李艳梅,张宇佳,陈明曦,王东凯,赵云丽
(沈阳药科大学 药学院,辽宁 沈阳 110016)
传统的药物载体在制备、应用以及储存过程中,容易受内部或外界等因素的影响结构发生变化,导致其载药稳定性变差和生物功能降低。而无机药物载体如二氧化硅不仅物理稳定性好,而且因其独特的孔道结构还易于表面化,因此更容易实现靶向治疗,从而降低不良反应发生的频率[1]。介孔材料不仅具有很高的比表面积,而且孔径大小可调,孔道结构有序,因此作为一种无机药物载体有助于完成大分子的吸附、分离,可以作为大分子药物有利载体。介孔二氧化硅纳米载体经过修饰能够以高效、可控的方式输送药物到达肿瘤部位,提高抗肿瘤效率,增强药物的生物利用度,从而避免了药物提前释放而造成的毒副作用[2],在生物医药领域具有不可或缺的作用。此外,有文献报道介孔二氧化硅纳米粒子(mesoporous silica nanoparticles, MSN)在水质净化、气体污染物治理、光催化降解有机物等方面有明显的效果[3],为绿色发展提供了可能。介孔材料的应用广泛,不仅在化学化工、生物医药领域有举足轻重的作用,在环境和能源领域也为绿色发展提供了新的思路。
1 介孔二氧化硅的种类及制备
1.1 介孔二氧化硅的种类
根据 IUPAC 的规定,多孔材料按照孔径大小可分为 3 类,分别为微孔(<2 nm)、介孔(2~50 nm)和大孔(>50 nm),常见的 MSN 的材料有 MCM、SBA、MSU 和 TDU 系列等[4]。不同类型的 MSN 介孔相态、孔道、孔径各不相同,其中比表面积大、孔径有序可调的 MCM 系列是分子筛历史上有纪念意义的里程碑,结构示意图见图 1。MCM-41 是第一个介孔材料合成的实例,MCM-48 和 MCM-50 则技术比较成熟,优点也较为突出。

Fig. 1 Structures of mesoporous MCMS:图 1 MCM 系列介孔材料示意图
1.2 介孔二氧化硅的制备
介孔二氧化硅的制备方法多种多样,核心都是溶胶-凝胶法。介孔二氧化硅和表面活性剂组成的介孔材料是通过在含有各种活性剂(通常为阳离子表面活性剂,例如十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide, CTAB)或阳离子表面活性剂)的溶液中水解和缩合四烷氧基硅烷(Si(OR)4,R=Me、Et 等)而制得的。三嵌段共聚物(如P123)作为介观结构的模板,通过适当改变条件,例如 pH 值和表面活性剂和硅的浓度,可以制备小于 100 nm 的纳米颗粒,通过煅烧或萃取除去这些表面活性剂(模板)可获得 MSN。通过改变粒径、孔径、形态和表面可以很容易地控制它们的功能和性质,见图 2[5]。
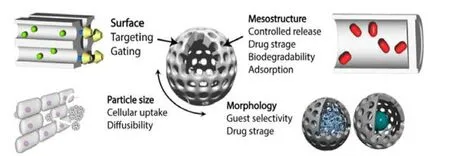
Fig. 2 Relationship between the features of MSNs and their properties图 2 MSN 的功能与其属性之间的关系
2 介孔二氧化硅在药物研究中的应用
2.1 控制药物释放
Vallet 将消炎药布洛芬载于介孔硅的孔道中,表现出介孔硅材料作为药物载体具有缓释药物的能力,这是最早使用介孔硅材料作为药物载体的历史[6]。介孔二氧化硅无论是对于小分子药物,还是对于不同分子量、不同疏水性质的大分子物质如核酸、蛋白质等都呈现较好的负载能力。使用介孔二氧化硅作为纳米药物载体不仅是因为其性质稳定,经过适当修饰可以达到靶向运输,更重要的是 MSN 不与生物体内的化学物质发生相互作用,具有较好的生物相容性,同时表面的硅羟基也可以很好的分散在水中。球形纳米粒子的体外和体内行为,生物分布和生物相容性与 MSN的结构和孔径间接相关[7]。
高艳等[8]通过用石墨烯量子点(graphene quantum dots, GQD)封盖介孔二氧化硅纳米粒子(MSN),开发了一种新型的光热和氧化还原响应药物传递载体。通过胱氨酸和氨基官能化的MSN 之间的酰胺化反应引入二硫键,罗丹明 B(Rhodamine B, RhB)作为一种红色荧光染料被装载到 MSN 的中孔中作为模型药物,而 GQD 则被封在 MSN 上,可以阻止 RhB 的释放。透射电镜(transmission electron microscope, TEM)、氮吸附和解吸分析、X 射线衍射(X-ray diffractomer, XRD)、热重分析(thermo gravimetric, TG)和傅里叶变换红外光谱(Fourier-transform infrared spectroscopy, FTIR)均证明,成功制备了由 GOD 封端的纳米复合材料 MSN,示意图见图 3。因其具有明显的二硫键对谷胱甘肽(glutathione, GSH)的氧化还原反应,因此负载的药物可以可控地释放。该药物递送系统可以被认为是药物递送和刺激响应释放的先驱者。
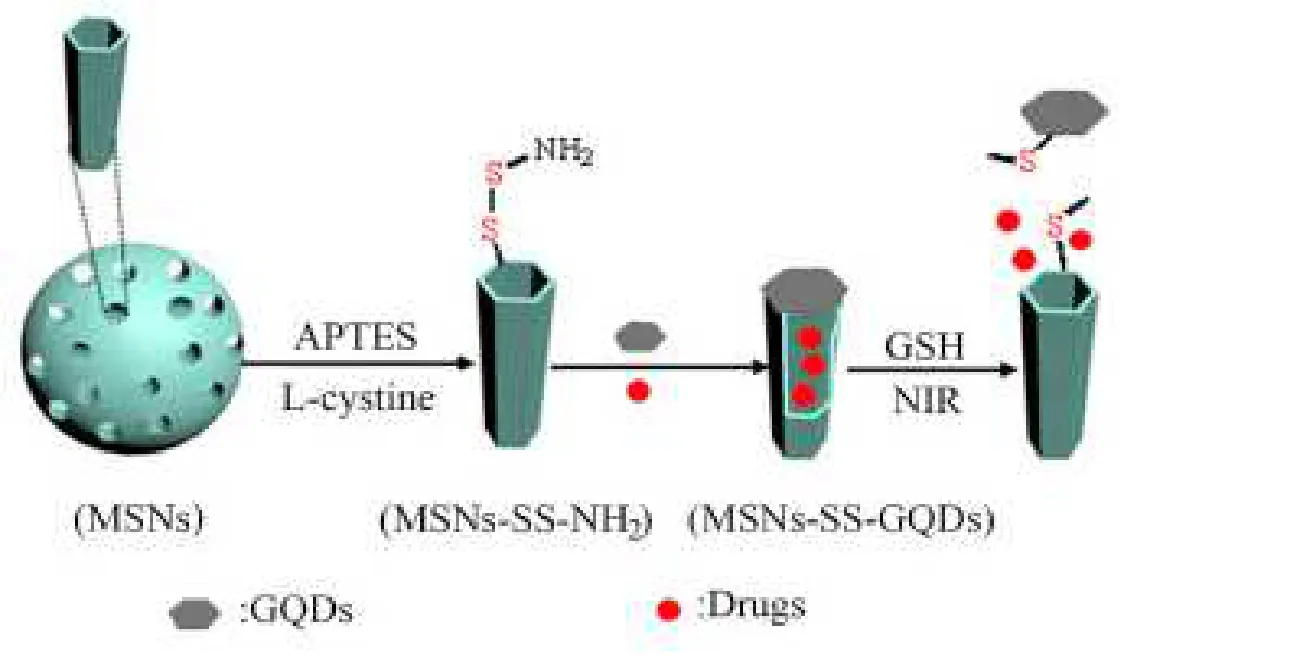
Fig. 3 Analytical diagram of nanocomposites terminated by GOD图 3 由GOD 封端的纳米复合材料的解析图
对于生物相容性较好的载体,能够使药物到达靶向细胞或组织之前无需提前释放药物分子,这种靶向药物传递系统能够将有效剂量的药物分子运送到目的地[9]。介孔二氧化硅对磷脂组织有很大的亲和力,因此会被用于增强药物传递系统的生物相容性,以此可以调控药物的有效释放。
2.2 改善难溶药物溶出度
介孔二氧化硅改善难溶性药物溶解度的原理主要是其表面积和孔隙较大,而难溶性药物通常以分子状态或无定形状态存在于孔道内部,MSN 可以使难溶性药物保持无定形状态,因此有利于提高生物利用度。MSN 在生物体内被降解为硅醇基,可以很容易除去,因此具有很高的安全性[10]。
在 pH4.5 下,与纯二氟尼柳的溶出速率相比,所有制备的中孔基质都能够改善药物的溶出动力学(威布尔释放模型用于描述二氟尼柳的溶出曲线)。二氟尼柳在 APTES 修饰的介孔分子筛上的吸附是一个自发过程,二氟尼柳吸附的机制与吸附剂和药物分子之间的静电吸引力有关,用氨基丙基接枝的 SBA-15 和 MCF 中孔二氧化硅是用于吸附和释放二氟尼柳的合适材料[11]。紫杉醇作为一种常用的化疗药物,水溶性很差,因此使用受限,但是有研究表明与游离紫杉醇相比,如果使用 MSN 作为药物载体,紫杉醇的溶解度将大幅提升[12]。MTT 实验表明,MSN 在试验条件下对 HepG2 细胞没有明显的细胞毒性,而 MSN 紫杉醇则显示出剂量依赖性细胞毒作用,细胞毒性随着 PTX 浓度的增加而增加。Tzankov 等[13]提出两种类型的介孔二氧化硅颗粒MCM-41 和 HMS 可以有效地负载有溶解性差的抗糖尿病药物格列美脲,以提高其溶解度。通过 TEM 研究来分析 MSM-41 和 HMS 的多孔结构(图4)。如图所示,MCM-41 具有完全多孔的结构(图4a),而 HMS 具有中空的核和多孔壳(图4b)。载有药物的HMS 纳米颗粒的中空核在内部呈暗色区域,这表明格列美脲对 HMS 的中空核有载荷(图4d)。体外实验也表明格列美脲负载的二氧化硅纳米粒子具有良好的安全性。
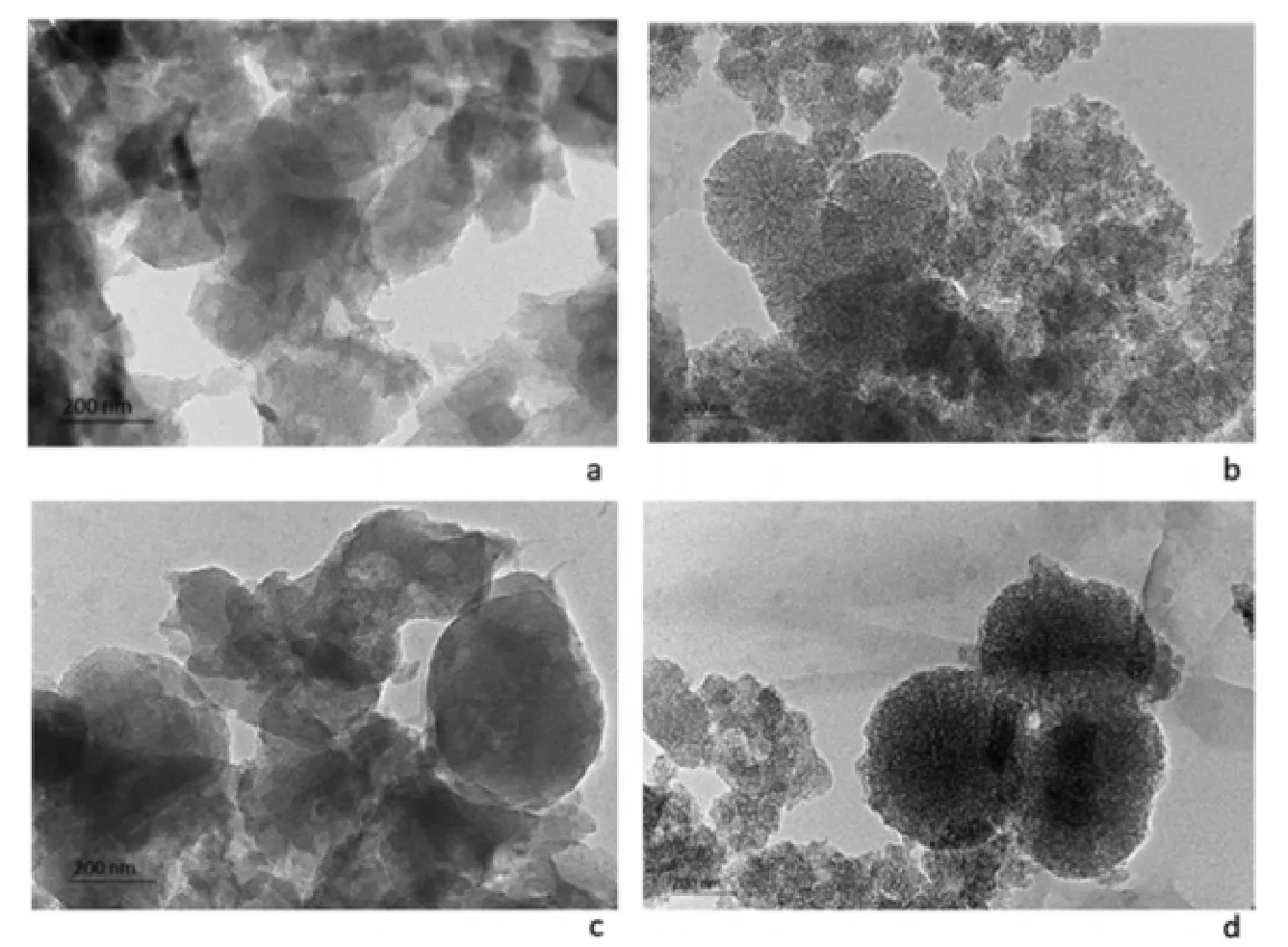
Fig. 4 Transmission electron micrographs of pure MCM-41 (a), pure HMS (b) and glimepiride loaded samples MCM-GLI (c) and HMS-GLI (d)图 4 纯 MCM-41(a),纯 HMS(b)和格列美脲负载的样品MCM-GLI(c)和HMS-GLI(d)透射电子显微照片
王可可等[14]提到 MSN 可显著提高 BCS Ⅱ 类药物卡维地洛在不同 pH 介质中的溶出速率(图5),MSN 口服给药系统为提高不同 pH 条件下难溶性药物的生物利用度提供了新的思路。加载到无机中孔载体上的药物无定形化为改善水溶性差的活性药物成分的溶出速率和生物利用度提供了可能[15]。这些结果都表明 MSN 是疏水性药物可利用的载体。
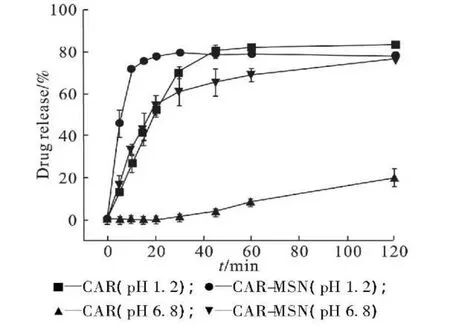
Fig. 5 In vitro drug release profile of CAR and CAR-MSN in pH1.2 PBS buffer and pH6.8 PBS buffer (n=3)图 5 CAR 原料药和 CAR-MSN 制剂在 pH1.2 或 pH6.8 的溶出介质中的溶出曲线(n=3)
难溶性药物与 MSN 之间的相互作用对释放速率有一定的影响,有研究表明载药量对于难溶性药物 MSN 给药系统的药物释放具有重要的调控作用,低载药量可以实现药物短时间内的完全释放,高载药量则相反,相比较而言,药物的氢键受体数量对于 MSN 给药系统的难溶性药物的释放行为影响不大[16]。
2.3 提供癌症治疗新思路
常规方法治疗癌症总是有很多缺陷,近年来,基于纳米技术的干预措施因能够改善和克服这些缺点而在癌症治疗中得到普及。在已被探索为药物载体的各种纳米颗粒中,中孔二氧化硅具有很多理想的特性,例如自身的结构特性以及良好的生物相容性,因此已被广泛应用于单一和多种治疗剂的特定部位递送以及成像和治疗学[17]。通过广泛研究不同类型的外部刺激以引起中孔二氧化硅释放药物,结果表明化学响应系统可提供更大的治疗效果,并且能够将与外部刺激相关的附带损害降至最低。
在过去几年中,刺激响应系统已经成为用于治疗剂的位点调节递送的优异递送系统。内在刺激响应载体利用肿瘤和正常组织中化学微环境的差异来获得细胞毒性特异性位点的释放,这种化学反应系统具有超过外在刺激响应系统的另一个优点是减少了对邻近正常组织的附带损害。袁宁宁等[18]设计的用壳聚糖修饰的 MSN 细胞亲和性较高,可以根据肿瘤微环境的变化释放药物,治疗效果显著增强。介孔二氧化硅的化学响应系统尽管已经探索了其在肿瘤部位实现化学反应性释放,但是对于体内长时间循环以及 MSN 的毒性考察仍然需要深入的研究。
3 介孔二氧化硅纳米粒子的安全性研究
3.1 遗传毒性研究
介孔二氧化硅纳米粒子在很多领域都应用广泛,但是关于长期使用或对特殊人群使用的安全性研究很少。对 99m Tc 放射性标记的磁芯中孔二氧化硅纳米粒子进行了诱变性,细胞毒性和胎盘评估,以确定动物模型中的毒性和胚胎潜在风险。99m Tc 放射性标记在 8 h 内显示出 98% 的高效率和稳定性。使用沙门氏菌肠血清型鼠伤寒标准菌株进行致突变性测定,使用 WST-1 进行细胞毒性测定,使用体内模型对大鼠进行胎盘评估测定,分析的结果证实,纳米粒子可以产生DNA 损伤、产生细胞毒性潜能,并且能越过移植屏障,在胚胎和胎儿中均发生生物蓄积[19]。
3.2 细胞毒性研究
使用 MTT 还原法评估了二氧化硅纳米粒子对心肌 H9c2(2-1)细胞的细胞毒性。将细胞暴露于浓度为 0.1 至 1.6 g•L-1的 21 和 48 nm 的二氧化硅纳米颗粒中 12、24、36 和 48 h。如图 6 所示,二氧化硅纳米粒子(21 和48 nm)的 CC50 分别约为 0.32 和 1.29 g•L-1,这意味着较小尺寸的二氧化硅纳米粒子具有较高的细胞毒性。此外,图7 中的结果表明,21 和 48 nm 的二氧化硅纳米颗粒均导致 H9c2(2-1)细胞活力显著下降,并且毒性作用呈剂量和时间依赖性。毒性反应可能是由氧化应激的产生触发的,p53 和 p21 蛋白可能参与了颗粒诱导的 G1 期阻滞,暴露于纳米粒子可能是心脏病发展的重大风险。纳米颗粒诱导细胞损伤的详细机理很复杂,需要进一步研究[20]。

Fig. 6 CC50 of H9c2(2-1) cells after 24 h exposure to 21 and 48 nm of silica nanoparticles(Silica (21 nm) is the cells exposed to 21 nm of silica; silica (48 nm) is the cells exposed to 48 nm of silica. Data are expressed as means ±S.D. from three independent experiments)图 6 H9c2(2-1)细胞暴露于 21 和 48 nm 的二氧化硅纳米颗粒 24 h 后的 CC50(二氧化硅(21 nm)为暴露于 21 nm 二氧化硅的细胞;二氧化硅(48 nm)为暴露于 48 nm 二氧化硅的细胞。数据表示为平均值±标准误差,来自 3 个独立的实验)
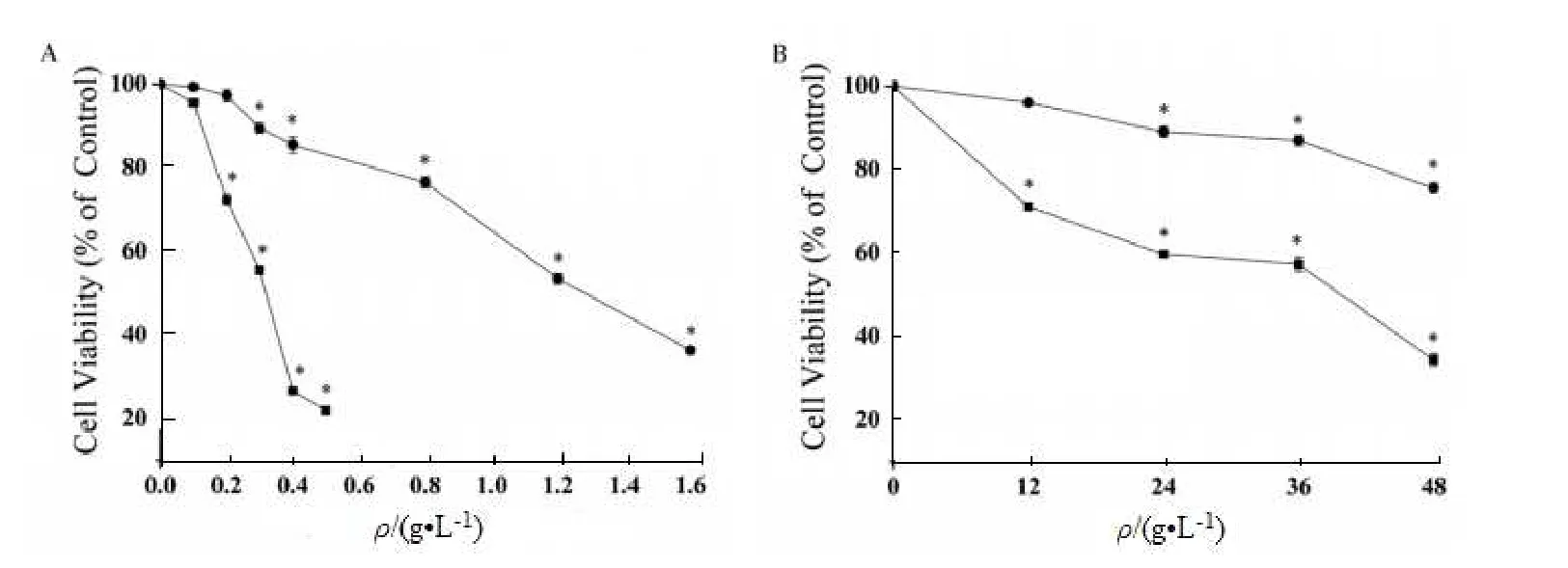
Fig. 7 Viabilities of H9c2(2-1) cells exposed to 21 and 48 nm of silica nanoparticles(Silica (21 nm) is the cells exposed to 21 nm of silica; silica (48 nm) is the cells exposed to 48 nm of silica. Data are expressed as means ± S.D.from three independent experiments. *P < 0.05 compared with control group)图 7 暴露于21 和48 nm 的二氧化硅纳米颗粒的H9c2(2-1)细胞的活力(二氧化硅(21 nm)为暴露于21 nm二氧化硅的细胞;二氧化硅(48 nm)为暴露于48 nm 二氧化硅的细胞,数据表示为平均值±标准差,来自3 个独立的实验,与对照组相比* P<0.05)
3.3 毒性相互作用研究
有研究表明释放到环境中的纳米颗粒可能与先前存在的污染相互作用,可能引起更高的毒性,因此有必要评估它们的联合毒性作用,研究结果表明,SiNPs 和 MeHg 共同暴露在心肌细胞和心脏中均会引起严重的心脏毒性,这将有助于弄清关于综合接触污染的潜在心血管毒性[21]。
尽管介孔二氧化硅纳米粒子毒性很小,但是为了长期安全使用,达到最大的临床疗效,仍然需要深入研究其安全性。
4 结论与展望
介孔材料的优点在前文已经叙述的很清楚了,本文作者主要综述的是 MSN 作为药物载体的研究进展。此外,其他新型介孔材料也有自己独特的优点,例如纤维介孔硅材料[22]除了具有与MSN 相似的优势特征外,还具有优异的物理性能,如机械稳定性,这些特点都要比其他药物载体具有明显的优势。介孔分子筛[23]也作为药物载体应用于缓控释制剂及靶向制剂,但是容易受载药方法及模型药物固有特性等因素的影响,因此其作为药物载体的研究还需进一步深入。介孔氧化铝可以提高材料的热稳定性和催化活性,从而使材料结构更加坚韧[24]。此外还有荧光介孔纳米二氧化硅粒子[25],可以显著提高抗紫外、耐老化的能力。
Daniel 等[26]描述了适用于中孔二氧化硅纳米粒子的通用表面官能化策略,该策略可能用作药物传递载体,它在纳米粒子的表面上使用了烷氧基胺系链。在肟醚形成的温和条件下,只需将化学修饰的介孔二氧化硅纳米粒子与醛或酮在水中孵育,即可轻松将多种羰基化合物连接至这些链。
介孔二氧化硅纳米颗粒(MSN)是使用最广泛的纳米材料之一,由于其高度稳定的 Si-O-Si结构而在体内的生物降解性较差。在这里,Si-O-Si 的结构稳定性通过掺杂锶离子来调节。十六烷基三甲基溴化铵介导的模板法合成了掺 Sr 的 MSN(Sr-MSNs),并对其形貌、结构、理化性质、体外降解性和细胞相容性进行了研究。结果表明,随着有序介孔结构的塌陷,Sr2+已成功掺入 MSN 中。Sr 掺杂以 Sr 含量依赖性方式显著改善了 MSN 的比表面积,体外降解性和细胞相容性。特别是过量的 Sr 掺杂会产生不纯的硅酸锶,在降解过程中会转化为无序的无定形二氧化硅,并阻碍 MSN 的生物降解行为。因此具有优异的表面性质,生物降解性和生物相容性的合成 Sr-MSNs 被认为是在许多临床应用中可控药物和离子释放的潜在载体[27]。
由于癌细胞对激素治疗的反应减少,三阴性乳腺癌极具侵略性,治疗选择有限。因此单分散的含锌介孔二氧化硅纳米颗粒(MSNPs-Zn)被生产为可调节的可生物降解的平台,用于将治疗性锌离子输送到细胞中。结果证明纳米粒子被细胞内在化,并确定了治疗剂量窗,其中 MSNPs-Zn对乳腺癌细胞有毒,但对健康上皮(MCF-10a)细胞或鼠巨噬细胞无毒。暴露于 MSNPs-Zn 24小时后,三阴性 MDA-MB-231 和 MCF-7(ER+)乳腺癌细胞的活力显著降低。具有更高转移潜力的更具侵略性的 MDA-MB-231 细胞比 MCF-7 细胞对 MSNPs-Zn 更为敏感。MSNPs-Zn在细胞内部经历了生物降解,变成了中空结构,如高分辨率透射电子显微镜成像。介孔二氧化硅纳米颗粒提供了可生物降解的载体,用于治疗离子在细胞内的释放[28]。
介孔纳米二氧化硅是一种比表面积大、孔隙大、孔径可调的无机生物载体材料,其表面可以进行各种化学修饰,因此具有良好的生物相容性和稳定性,MSN 作为药物载体可以很好地控制药物的释放,从而达到理想的治疗效果,除此之外还广泛应用于生物传递以及生物成像等。近年来基于各种功能化修饰的 MSN 药物传递系统应用前景广泛,但是是否能够解决临床实际问题还有待于进一步考察,此外例如细胞毒性、基因毒性、体内代谢路径等安全问题也需要深入研究,这对确保 MSN 质量评估至关重要。
