人永生化胰腺星形细胞系的构建及其功能的验证
2021-03-26韩世纪练国达陈少杰黄开红李佳佳
韩世纪 ,练国达 ,陈少杰 ,黄开红 *,李佳佳
胰腺癌恶性程度高,肿瘤间质纤维化是其重要病理特征,纤维化程度与不良预后相关[1]。胰腺癌结缔组织致密压迫血管造成组织内有效灌注少,组织本身血管分布较少、缺氧明显,极大地限制了组织局部的化疗药物浓度及药效发挥,给胰腺癌治疗带来极大挑战[2,3]。胰腺纤维化的形成是一个由复杂信号网络调控、以胰腺星形细胞(pancreatic stellate cells,PSCs)活化为中心、多种细胞因子参与、最终以成纤维细胞增生和细胞外基质(extracellular matrix,ECM)沉积为特征的复杂病理发展过程[4]。当胰腺损伤或发生病变(如慢性胰腺炎或胰腺癌等)时,PSCs 被激活为肌成纤维样细胞,增殖活跃、脂质成分减少、表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和结蛋白(desmin),以α-SMA 为较公认的PSCs 活化标志。在其活化过程中,伴随过量细胞外基质蛋白比如Ⅰ型和Ⅱ型胶原蛋白(collagen type Ⅰ、Ⅱ)、纤维结合蛋白(Fibronectin)表达,基质金属蛋白酶(Matrix metalloproteinase,MMPs)及其抑制剂的合成,这些基质成分也是导致胰腺癌耐药的重要原因之一[4,5]。
近年来,PSCs 相关研究越来越多,但大部分实验用细胞主要来源于小鼠或大鼠胰腺分离的PSCs,仅有部分实验使用组织块outgrowth 培养法获得原代培养的人 PSCs(human PSCs,hPSCs)[6-12]。由于胰腺组织来源有限,原代培养条件复杂且耗时,纯化得到的原代细胞持续分裂能力有限,多使用第3 代至第 8 代[12,13];并且由于同一标本所得 PSCs 难以持续分裂足够细胞用于后续功能实验;而不同组织标本来源PSCs 异质性较大,实验数据一致性和可靠性差。随着科学技术发展,永生化建细胞系技术逐渐成为构建预期表型细胞系的重要手段之一。所谓的“永生化”是指培养细胞在体外能稳定传代、生长,但又不发生恶性转化,即不具有癌细胞的特征。为了弥补目前PSCs 实验细胞来源不足的缺陷,国外有部分实验室报道采取慢病毒转染的方法建立了鼠 PSCs(mice PSC,mPSC)和hPSCs 永生化细胞系[14-16]。早期永生化建系时,单独使用猿猴病毒 40(Simian virus 40,SV40)转染获得的永生化细胞效率较低[17]。为克服细胞分裂过程中端粒缩短现象,在正常细胞中导入端粒酶反转录酶催化亚基基因(human telomerase reverse transcriptase,hTERT)是目前用于维持端粒结构完整和稳定的最有效途径,可防止细胞复制性衰老,使正常上皮细胞永生化[18-20];近年来联合SV40T 抗原基因和hTERT 基因己成功用于人乳腺成纤维细胞和内皮细胞,睑板腺上皮细胞等细胞永生化建系[21,22]。
本部分实验中,我们使用重组慢病毒将SV40LT基因和hTERT 基因导入原代hPSCs 中,通过抗性药物筛选及扩大培养,细胞免疫荧光、Western blot和qRT-PCR、染色体核型分析、生长曲线测定、裸鼠成瘤实验等研究其表型,建立一株人胰腺星形细胞永生化细胞系;并将该细胞系与胰腺癌细胞在体外进行共培养,证实其生物学功能。为胰腺星形细胞相关研究提供充足细胞来源,以保证后续科研工作的进一步开展。
1 材料与方法
1.1 采用outgrowth 方法培养原代PSCs
1例胰腺癌组织标本来自于2020年5月我院肝胆外科手术切除,病理诊断为高分化胰腺导管腺癌标本,利用outgrowth 法培养获得。具体步骤如下:标本由含有青霉素/链霉素的PBS 冲洗,剪成直径2~3 mm 组织块,种植于含有10%FBS(Gibco,CA,USA)及 2 mmol/L 谷氨酰胺的 DMEM/F-12(1∶1)(Gibco,CA,USA)培养基的六孔板中,每孔3~5 块组织,37℃、5% CO2条件下培养;24 h 换液,48 h 换板,后 2~3 天换液,5~7 天 hPSCs 生长出组织块并附壁于孔板。至细胞密度达到约80%~90%,胰酶消化后传代。
1.2 SV40LT 和hTERT 重组慢病毒转染及永生化细胞筛选
挑选生长状态良好的第3代hPSCs,以5×104/mL接种于96 孔板,使用DMEM/F-12 完全培养基稀释pdybrene 至终浓度50 μg/mL;更换培养基加入SV40LT 和hTERT 病毒液(上海吉凯基因科技有限公司)进行细胞感染,为im PSCs 组,阴性对照组为NC PSCs 组;12 h 观察细胞状态,更换为完全培养基;感染72 h 荧光显微镜观察细胞感染效果,确认感染条件和感染参数;后将成功感染的im PSCs转至培养瓶,37℃、5% CO2条件下,用含 2 μg/mL嘌呤霉素的无血清培养基连续筛选14 d;后用含1 μg/mL 嘌呤霉素完全培养基继续培养。
1.3 转染细胞SV40LT 和hTERT 的RNA 表达水平验证
利用 TRIzol Reagent(Invitrogen,Carlsbad,CA,USA)从稳转细胞(imPSCs)中提取RNA,然后使用PrimeScriptTMRT(TakaRa,大连,中国)试剂盒逆转录成 cDNA。使用 SYBR®PremixEx TaqTM II(Taka-Ra,大连,中国)的试剂盒,在 LightCycler®96SW 1.1 qRT-PCR 系统(Roche,Basel,Switzerland)上进行PCR 扩增反应,反应条件为:95 ℃2 min 预变性,然后按 95 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,共40 个循环,最后 72 ℃ 7 min 延伸。用 GAPDH 作为内参。结果通过2-△△CT法分析基因相对表达量。SV40LT 和hTERT 引物合成于广州睿博兴科生物公司。
1.4 转染细胞SV40LT 和hTERT 的蛋白表达水平验证
稳转细胞(imPSC),预冷 PBS 清洗 2 次,用含有蛋白酶抑制剂(PMSF)的RIPA 裂解缓冲液裂解细胞并测定蛋白浓度。取等量总蛋白于10%SDSPAGE 胶电泳。然后将凝胶转移至PVDF 膜中,恒流(250 mA)转膜150 min;取出PVDF 膜,置于5%脱脂奶粉中封闭2 h,加入一抗(SV40LT 和hTERT购买自美国Cell Signaling Technology 公司,1∶1000稀释),4 ℃过夜,TBST 洗膜;二抗37 ℃摇床孵育1 h,TBST 洗膜。ECL 化学发光试剂盒显影曝光。
1.5 免疫荧光验证SV40LT 和hTERT 稳转细胞系生物学表型情况
稳转细胞(imPSCs)消化种板,贴壁后弃上清,PBS 轻洗,4%多聚甲醛室温固定10 min,PBS 轻洗;0.2%Triton X-100/PBS 室温透化 10 min;PBS 轻洗,1% BSA/PBS 室温低速摇床封闭30 min;去除封闭液,孵育一抗(α-SMA、Collagen I、Fibronectin 抗体购买自美国Abcam 公司,1∶200 稀释),4 ℃过夜;弃去抗体,PBS 轻洗,孵育荧光二抗(美国Abcam公司),室温低速摇床孵育30 min;去除抗体,PBS轻洗,DAPI 工作液染核5 min,PBS 轻洗,加入PBS,至于荧光显微镜下观察、拍照。
1.6 核型分析验证SV40LT 和hTERT 稳转细胞系生物学表型情况
将imPSCs 细胞消化种板,贴壁后;将秋水仙素(终浓度0.2 μg/mL)加入培养液中,继续培养4 h;胰酶消化后收集细胞,1000 r/min 离心10 min,弃上清。加入0.5 mL 37 ℃预热的0.075 mol/L KCL混匀,缓慢补充至10 mL,混匀37 ℃孵育20~30 min;管中加入1 mL 新鲜固定液,室温固定5 min,1000 r/min离心10 min,弃上清。缓慢加入新鲜固定液1 mL,室温固定30 min,吹打均匀,1000 r/min离心10 min,弃上清。取0 ℃冰冻的载玻片,距玻片15 cm高度,向玻片滴加1~2 滴细胞悬液,室温干燥。Giemsa染色10~20 min,流水冲洗玻片背面,晾干。二甲苯透明,中性树胶封片,油镜下随机计数50 个处于分裂相的染色体,选取10 个分散好的G 显代标本进行染色体核型分析。
1.7 细胞生长曲线验证SV40LT 和hTERT 稳转细胞系生物学表型情况
将im PSCs 细胞消化后种于96 孔板,细胞1×104/mL,100 μL/孔铺板,3 个复孔;采用 CCK8 法,连续 10 天,每 24 h 测 450 nm 处 OD 值,以时间为横轴,细胞数为纵轴做曲线即为生长曲线。
1.8 裸鼠成瘤实验观察SV40LT 和hTERT 稳转细胞系动物体内成瘤能力
取 6~8 周龄,雌性 Balb/c-nu 裸小鼠 6 只,16~18 g 环境适应7 天后,裸鼠被随机分配至两组,进行细胞注射,观察细胞成瘤能力。其中阳性对照组:人胰腺细胞癌Panca-1;实验组:imPSCs(n=3)。5×106细胞重悬于0.1 mL PBS,注射于裸鼠左协腹部;后每周观察小鼠精神、饮食及排便情况,称重小鼠体重,用游标卡尺测量肿瘤结节的长度和宽度。观察8 周后终止实验,断髓处死小鼠取瘤块称重。摘取瘤体固定于4%甲醛用于组织学研究。
1.9 SV40LT 和hTERT 稳转细胞系促胰腺癌细胞增殖迁移侵袭能力的情况
将 imPSCs 和原代 hPSCs 利用 Transwell 小室与胰腺癌Panc-1 细胞(中国科学院上海细胞库)共培养,将imPSCs 和原代hPSCs 分别种植在上室,Panc-1 在下室,37 ℃、5% CO2条件下培养48 h;后将Panc-1 细胞胰酶消化后,分别种板;采用CCK8法检测Panc-1 细胞增殖能力改变、Transwell 小室检测Panc-1 细胞迁移侵袭能力改变,未共培养的Panc-1 细胞做对照。
1.9.1 CCK8法检测Panc-1细胞增殖能力改变 将共培养后Panc-1 细胞消化后种于96 孔板,细胞1×104/mL,100 μL/孔铺板,3 个复孔;采用 CCK8 法,连续 7 天,每 24 h 测 450 nm 处 OD 值,检测细胞生长增殖情况。
1.9.2 划痕实验检测Panc-1 细胞增殖能力改变将6孔板接种细胞前先用marker笔在孔板背面画横线标记;共培养后Panc-1细胞消化后3×105/孔接种,细胞铺满板底后,用1 mL 枪头垂直于孔板制造细胞划痕,吸去培养液,PBS 冲洗三次,洗去细胞碎片。加入无血清培养基,12 h、24 h取出拍照记录。
1.9.3 Transwell 小室检测Panc-1 细胞迁移侵袭能力改变 侵袭试验前,Transwell 上室铺250 μg/mL Matrigel 胶,37 ℃4 h,迁移试验无需铺胶。共培养的和对照Panc-1 细胞按1×104/孔接种在上室,下室加入500 μL 含10% FBS 的完全培养基,37 ℃、5%CO2条件下培养20 h(迁移试验)或40 h(侵袭试验)。纯甲醛室温下固定细胞15 min,PBS 洗2 次,室温风干5 min;Wright-Giemsa 应用染色液染色30 min,双蒸水洗3 次,室温风干;显微镜下观察,计算穿膜细胞数。
1.10 统计学方法
应用SPSS 17.0 统计软件进行统计分析,结果以均数±标准差(mean ± SD)表示,两组间定量资料比较,符合正态分布者采用t检验和方差分析,不符合者采用Mann-WhitneyU检验。统计检验均为双侧检验,检验水准α=0.05,以P<0.05 为差异有统计学意义。
2 结 果
2.1 稳定高表达SV40LT 基因和hTERT 基因hPSCs 细胞系的建立
通过outgrowth 方法提取的原代hPSCs,贴壁良好,呈多角形和梭形(图1A);传至第3 代时,将SV40LT 重组慢病毒和hTERT 重组慢病毒转染hPSCs 细胞中,以获得稳定高表达两个基因的hPSCs细胞株(称为im PSCs),阴性对照病毒为对照细胞株(nc PSCs)。由于慢病毒载体自带GFP荧光蛋白,显微镜下可看到imPSCs 呈梭形、带有绿色荧光,而hPSCs 和ncPSCs 则不带有绿色英光,提示imPSCs成功感染慢病毒(图1A);且三组细胞生长状态和形态基本一致,提示病毒感染对细胞生长状态和形态未产生明显影响。病毒感染72 h 后,荧光显微镜确定成功转染后,用嘌呤霉素连续筛选14 d,后常规传代培养,并进行qRT-PCR 和Western blot检测两个基因的表达情况。结果显示,与阴性对照组相比,imPSCs 细胞 SV40LT 和 hTERT 基因在mRNA(图1B)和蛋白(图1C)水平表达量均显著升高,提示慢病毒感染成功。
2.2 免疫荧光方法检测稳转细胞系im PSCs 生物学表型情况
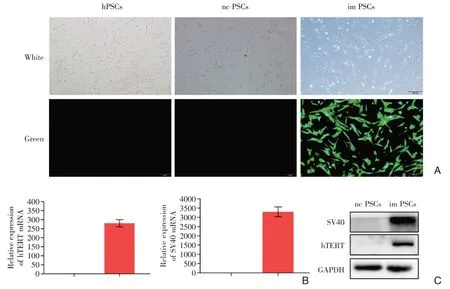
图1 永生化PSCs(imPSCs)验证 A:胰腺星状细胞呈梭形和多角形,永生化imPSCs 显微镜下呈星芒状绿色荧光,证实慢病毒转染成功;B:qRT-PCR 方法验证hTERT 和SV40 基因高表达;C:Western blot 方法验证hTERT 和SV40 基因高表达
经过嘌呤霉素连续筛选的稳定高表达SV40LT和 hTERT 的 imPSCs,具有活化 PSCs 的功能,可表达α-SMA、Collagen I、Fibronectin 蛋白。如图 2 所以,免疫荧光方法检测imPSCs 呈典型的活化状态,高表达α-SMA、Collagen I、Fibronectin 蛋白。
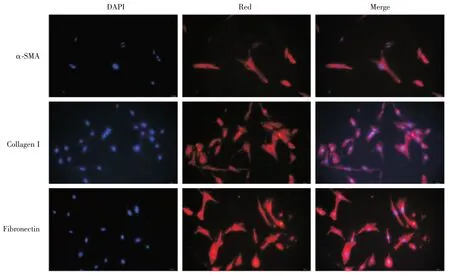
图2 细胞免疫荧光imPSCs 表达α-SMA、Collagen I、Fibronectin 蛋白(蓝色细胞核,红色目的蛋白)
2.3 im PSCs 染色体核型分析及生长曲线
观察第15 代im PSCs 细胞染色体核型分析可见,im PSCs 染色体总数增多,提示细胞处于分裂相(图3A)。将imPSCs 和ncPSCs 消化后种板,采用CCK8 法连续10 天检测细胞增殖情况,imPSCs 细胞呈典型的“S”型(图3B),增殖能力较对照组明显增加,且形态未发生改变。这些结果提示imPSCs有不断增殖分裂的能力,具有永生化的潜能。
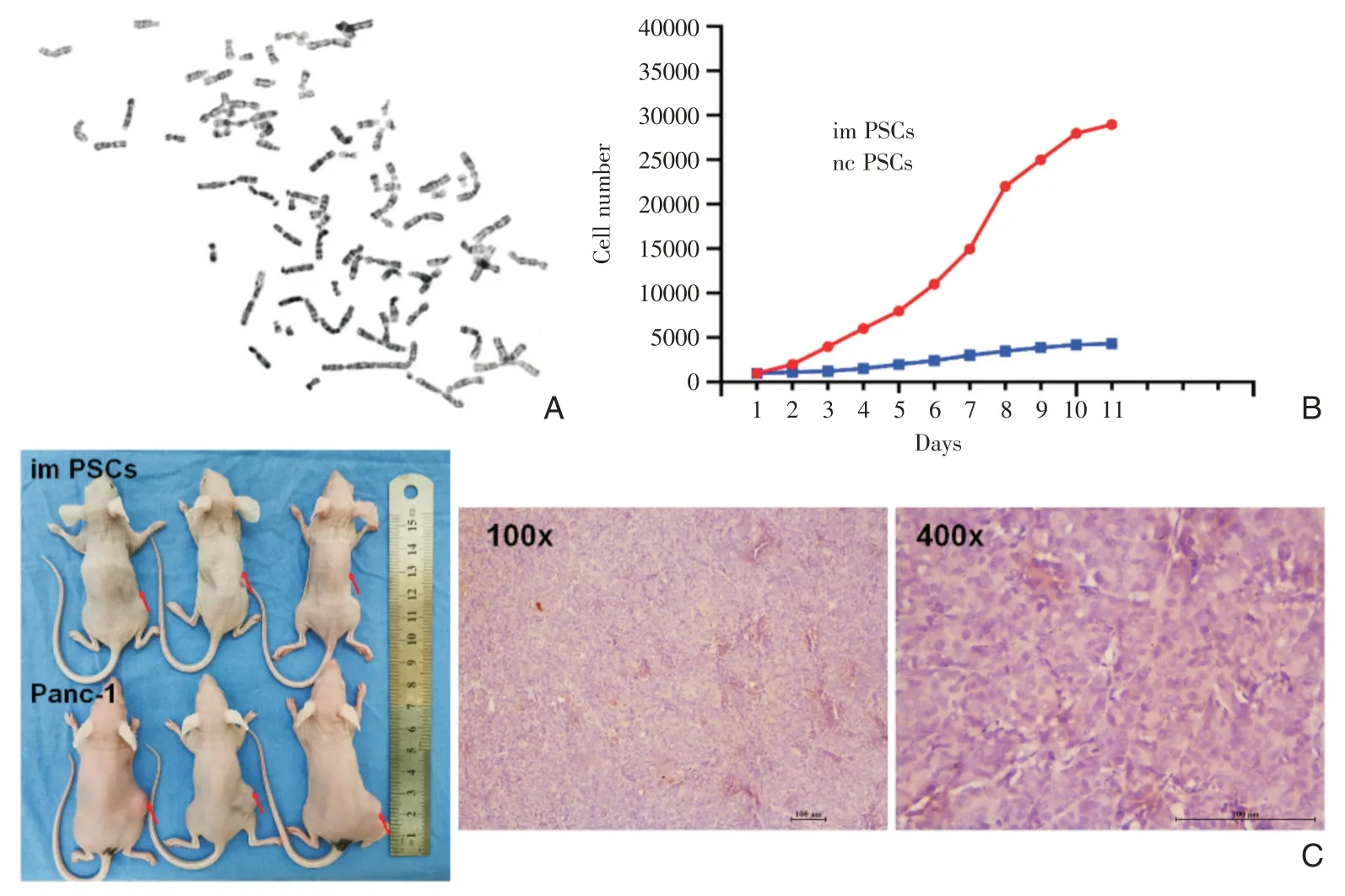
图3 imPSCs 表型情况 A:染色体核型分析证实永生化imPSCs 染色体数目增多;B:生长曲线呈典型的“S”型;C:体内证实imPSCs不具有成瘤能力,无恶性表型转化(红色箭头接种部位)
2.4 细胞成瘤实验
取imPSCs 细胞及胰腺癌Panc-1 细胞,分别接种于裸鼠背部,连续培养2 月,观察到imPSCs 组未形成瘤块(图3C);而Panc-1 组在接种2 周后可观察到肿瘤形成,并逐渐增大。实验终点,取出肿瘤组织行HE 染色,显示细胞核排列杂乱、大小不一的特点(图3C)。该结果说明成瘤实验操作无误,imPSCs 在裸鼠内无成瘤性,无恶性转化。
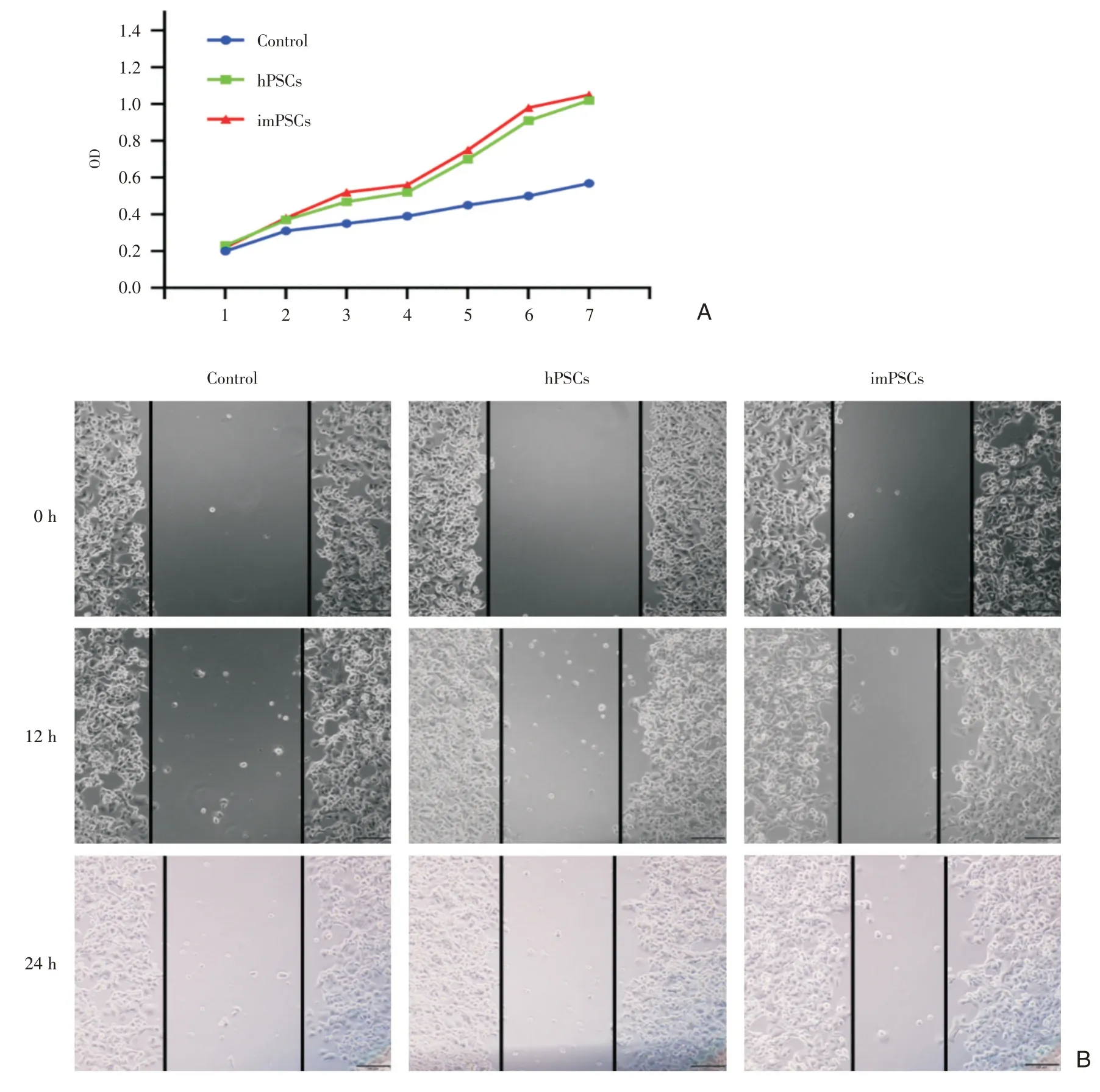
图4 imPSCs 促胰腺癌细胞增殖能力验证 A:imPSCs 和hPSCs 与胰腺癌Panc-1 共培养后,胰腺癌Panc-1 细胞增殖速度增快;B:细胞划痕实验证实imPSCs 的促癌作用
2.5 检测imPSCs 和人原代hPSC 同样的促胰腺癌细胞增殖能力
将人原代hPSCs 和imPSCs 分别与胰腺癌Panc-1 细胞共培养,48 h 后消化Panc-1 细胞分别行CCK8、细胞划痕实验和迁移侵袭实验,未共培养Panca-1 做对照,结果显示和 hPSCs 和 imPSCs 共培养的Panc-1 细胞增长速度明显快于对照组,hPSCs和imPSCs 两组之间没有明显差异(图4A)。划痕实验结果亦提示永生化细胞系具有促imPSCs 增殖能力(图4B);迁移侵袭实验显示同样的结果,hPSCs 和imPSCs 组穿膜细胞数明显多于对照组(P<0.05),但 hPSCs 和 imPSCs 两组之间没有差异(图5)。
3 讨 论
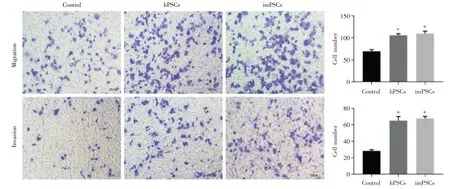
图5 imPSCs 促胰腺癌细胞迁移侵袭能力验证:imPSCs 和hPSCs 与胰腺癌Panc-1 共培养后,与未共培养Panc-1 细胞相比,迁移侵袭能力增加(*P<0.05 vs.Control);imPSCs 和hPSCs 对比无差异
胰腺癌症状隐匿,早期诊断率低且恶性程度高,大部分患者确诊时已是晚期,失去了手术机会,化疗是主要治疗方法;即使使用一线化疗药物吉西他滨,5 年生存率仍低于 5%[1,2]。间质纤维化使化疗药物难以渗透入肿瘤组织内部,这是导致胰腺癌患者化疗效果差的重要原因之一[23],针对肿瘤间质进行干预以提高抗肿瘤效果是胰腺癌研究的热点和新方向[24]。PSCs 是胰腺癌间质成分的主要来源,是肿瘤间质主要的研究靶点;但其没有可供使用的细胞株,使用鼠源或人原代培养纯化的hPSCs,持续分裂能力有限,且来源于不同组织标本原代分离的细胞会受标本来源的性别、年龄、遗传背景等方面的影响,实验数据的稳定性较差。鉴于此,构建永生化PSCs 细胞系对于进行PSCs 及其与胰腺癌细胞之间的研究非常必要。
研究发现,SV40LT 抗原可通过与抑癌基因Rb及P53 相互作用发挥促进细胞转化和永生化的功能[25-27],重组慢病毒 hTERT 基因导入细胞后可通过重建端粒酶活性的方法使细胞具有永生化功能。在此研究基础上,我们拟联合使用SV40LT 基因和hTERT 基因构建永生化PSCs 细胞系并验证其功能,将其运用到后续实验研究中。
我们收集胰腺癌患者外科手术组织标本,采用outgrowth 方法提取并纯化原代PSCs,显微镜下观察到呈多角形和梭形的细胞,生长状态良好;然后采用慢病毒感染方法将SV40LT 抗原基因和hTERT 基因导入细胞内,采用嘌呤霉素筛选。由于慢病毒带有GFP 质粒,自带绿色荧光,成功感染病毒的hPSCs在显微镜下会发出强绿色荧光。确定成功感染病毒后进一步通过qRT-PCR 和Western blot 方法验证细胞内SV40T 和hTERT 基因的表达情况,结果显示在mRNA 和蛋白水平,这两个基因均高表达,提示病毒感染后这两个基因成功转入hPSCs 发挥作用。为进一步明确成功导入两个基因的imPSCs 是否具有永生化的功能及保持PSCs活化的表型,采用CCK8 法观察imPSCs 生长状态,生长曲线显示其呈典型的“S”型生长趋势,且随着培养时间延长,细胞生长状态良好;核型分析显示imPSCs 细胞染色体总数增多,大部分细胞处于细胞分裂状态;这些结果均提示imPSCs 细胞呈现良好的分裂能力,具备持续分裂潜能。为验证永生化imPSCs 是否具备活化PSCs 的表型,我们采用免疫荧光方法验证其活化标记物α-SMA 和基质蛋白Collagen I、Fibronectin 表达情况,结果显示 imPSCs高表达α-SMA、Collagen I、Fibronectin 蛋白,保持为PSCs 的活化状态。imPSCs 细胞染色体总数发生改变,为验证其是否发生恶性表型转化,采用裸鼠皮下成瘤的方法验证,接种8 周后imPSCs 组未出现皮下肿瘤组织,而对照胰腺癌细胞株Panc-1 组长出肿瘤组织。以上这些结果表明,永生化imPSCs 不仅保持了PSCs 的形态和活化状态,还具备了持续分化的潜能、未发生恶性表型转化,细胞系构建成功,可用于相关研究。
PSCs 活化后,可分泌多种细胞因子及生长因子与胰腺癌细胞相互作用,促肿瘤转移侵袭等能力明显增强[5,6]。为进一步验证 imPSCs 的促瘤作用,我们将imPSCs 和肿瘤细胞共培养,未共培养的肿瘤细胞作阴性对照,与人原代hPSCs 共培养的肿瘤细胞做阳性对照。采用CCK8 法和细胞划痕实验观察肿瘤细胞增殖情况、迁移侵袭实验观察肿瘤细胞转移侵袭能力;结果表明,共培养的两组肿瘤细胞增殖、转移侵袭能力较未共培养组明显增强,且imPSCs 和人原代hPSCs 促肿瘤增殖、转移侵袭能力相当。这些结果说明imPSCs 还保持了人原代PSCs 的促肿瘤作用,可以运用于与胰腺癌肿瘤细胞相关关系研究。
综上所述,本研究利用胰腺癌组织标本获得原代PSCs,并采用慢病毒转染方法,导入SV40LT 和hTERT基因,构建一株稳定高表达两个基因的人胰腺星形细胞系imPSCs,并采用多种方法验证imPSCs不但具有人胰腺星型细胞的生物学特性和功能,且未发生恶性表型转化,为胰腺星形细胞自身功能和其与胰腺癌细胞相互作用关系、胰腺癌肿瘤微环境相关研究提供了可靠、理想的实验模型。
