转录因子YY1在肝细胞癌中的表达和功能研究
2021-03-26黄贻培罗伟鑫许磊波
黄贻培 ,罗伟鑫 ,许磊波 *
肝细胞肝癌(Hepatocellular Carcinoma,HCC)是肝脏最常见的原发恶性肿瘤,具有起病隐匿及容易复发转移的特点,往往预后不良[1-3]。目前根治性手术及手术替代方案(如靶向治疗)均有较大的缺陷和不确定性。弄清HCC 发生发展机制仍然是科研人员不断追求的目标。Yin Yang 1(YY1)是一类含有C2H2 型锌指结构的转录因子,属于GL1-Kruppel 蛋白质家族,通过不同的活性区域与靶基因启动子结合而发挥转录调节功能,参与调控细胞干性、分化以及细胞复制、增殖等生物学过程[4-6]。近来的研究显示,YY1 可通过抑制肿瘤细胞增殖、侵袭转移或诱导肿瘤细胞凋亡,在乳腺癌、胰腺导管腺癌及食管鳞状细胞癌起抑癌基因的作用[7-11];与此相反,在肺癌、胃癌及结直肠癌等肿瘤的发生发展中则发挥原癌基因的作用[11-13],表明YY1 在肿瘤进展中功能的发挥具有背景依赖性。YY1 在肝癌中的作用尚存在争议,Kim JS 等学者报道YY1 分布在肝癌细胞核及细胞浆中,细胞核中YY1 高表达的肝癌患者肿瘤分期更晚,且多合并血管侵犯,患者的生存预后更差,表明YY1在肝癌中发挥促癌作用[14];而Wang LM 等的研究则显示,YY1 在肝癌组织中低表达,并于体外实验证实抑制YY1 表达后肝癌细胞凋亡减少、侵袭转移能力显著增强,表明YY1在肝癌的进展中发挥抑癌基因作用[15]。因此,YY1 在肝癌的发生、发展过程中的作用亟待更多临床样本验证及深入的分子生物学机制研究。本研究通过公共数据库及临床组织样本分析YY1 在肝癌中的预后意义,同时探讨YY1 对肝癌细胞生物学行为的影响,观察其对肝癌细胞体外增殖、迁移及侵袭能力的影响。
1 材料与方法
1.1 肝癌转录组测序数据
从肿瘤基因组图谱计划(The Cancer Genome Atlas,TCGA)数据库中查找并下载肝癌的转录组测序数据TCGA-LIHC 及相关临床参数进行分析,得到374 例肝癌及配对的50 例癌旁组织的mRNA表达数据。同时从美国国家生物信息中心(National Center for Biotechnology Information,NCBI)创建的基因表达数据库(Gene Expression Omnibus,GEO)和国际癌症基因组联盟数据库(The International Cancer Genome Consortium,ICGC)中下载肝癌mRNA 片数据作为验证队列,获取GSE14520、GSE25097 及LIRI-JP 转录组测序数据。其中GSE14520 有225 例肝癌及220 例配对癌旁组织的mRNA 表达数据;GSE25097 有 6 例正常肝组织,40 例肝硬化组织,268 例肝癌及243 例配对癌旁组织的 mRNA 表达数据;LIRI-JP 包括有 243 例肝癌及配对的202 例癌旁组织的mRNA 表达数据。
1.2 肝癌组织样本
本研究经中山大学孙逸仙纪念医院临床研究伦理委员会批准,并获得受试者的知情同意。本研究采用自 2019 年 9 月~2019 年 12 月在中山大学孙逸仙纪念医院行手术切除治疗的30 对肝癌组织及配对的正常肝组织标本,经10%福尔马林溶液固定后用石蜡包埋长期保存,并制成4 μm 厚组织切片行免疫组化染色,所有患者术后病理学报告证实为肝细胞癌。
1.3 肝癌细胞系及细胞培养
人肝癌细胞系 Huh7、PLC/PRF/5、HepG2 和Hep3B 购自美国模式培养物集存库(American type culture collection,ATCC),正常肝细胞系L02、肝癌细胞系 BEL-7402、MHCC97H、HCCLM3 均购自中国科学院典型培养物保藏委员会细胞库,在含有10%胎牛血清(Gibco,USA)的DMEM(BI,Israel)培养基中培养,常规添加100 μg/mL 链霉素及100 U/mL青霉素(BI,Israel),于5% CO2、37℃恒温培养箱中培养。
1.4 实验试剂
YY1 和GAPDH 兔抗人单克隆抗体分别购自美国 Abcam 和 Cell Signaling Technology 公司;免疫组化试剂盒(Dako,Denmark);BCA 蛋白定量试剂盒(Invitrogen,USA);反转录试剂盒及TB Green染料法标准型定量试剂盒(Takara,Japan);Cell Counting Kit-8(CCK-8)检测试剂盒(Yeasen,China);Edu 检测试剂盒(Beyotime,China)8 μm 孔径的 Transwell 小室及 Matrigel 购自美国 Corning 公司 ;YY1 及 GAPDH 引 物 序 列 为 :GAPDH-F:GGAGCGAGATCCCTCCAAAAT;GAPDH-R:GGCTGTTGTCATACTTCTCATGG;YY1-F:AAGAGCGGCAAGAAGAGTTAC;YY1-R:CAACCACTGTCTCATGGTCAATA。
1.5 免疫组化
肝癌组织石蜡切片经60℃烘烤2 h,趁热置于二甲苯中10 min 进行脱蜡处理,使用不同浓度梯度的酒精(无水酒精,95%,80%,75%)行水化处理,经0.3%的过氧化氢处理10 min 去除内源性过氧化氢酶后,使用Tris-HCl(pH=9.2)抗原修复液于高压锅中修复10 min,YY1 抗体按1∶1 000 浓度4℃于湿盒孵育过夜。次日PBS 洗去一抗,37℃温箱孵育二抗30 min,DAB(DAKO,Denmark)显色后用苏木素进行细胞核染色。根据染色强度,将YY1组织染色强度评分分为:0=无染色,1=染色弱,2=染色中等,3=染色强,染色范围按百分比计算(0~100)。强度评分乘以染色范围即为YY1 的染色评分。
1.6 蛋白免疫印迹实验
处于对数生长期的细胞用预冷的PBS 洗去培养基,甩干后加入预先配好的细胞裂解液(RIPA裂解液+1∶100 蛋白酶抑制剂+1∶100 磷酸酶抑制剂,均购自中国康为世纪公司),冰上裂解15 min,15 000 rpm 离心20 min 后取上清经BCA 法测定蛋白浓度。按细胞总蛋白量20 μg 进行上样,经10%的SDS-PAGE 进行蛋白电泳,然后经电转至PVDF膜(Millipore,USA)上。加入一抗(YY1 与GAPDH均按照1∶1000 稀释使用)后置于4℃冰箱过夜孵育,次日TBST 洗去一抗后,抗兔二抗(Cell Signaling Technology,USA)室温孵育1 h。BCL 超敏发光液(Millipore,USA)曝光并拍摄。
1.7 实时荧光定量PCR
按照试剂说明书使用RNAiso Plus(Invitrogen,USA)提取细胞RNA,采用PrimerScript RT Master Mix 试剂盒(Takara,Japan)进行逆转录得到cDNA。实时定量PCR 实验按照TB Green Premix Ex Taq 试剂盒说明书(Takara,Japan)进行,操作仪器为Roche LightCycler 480Ⅱ。PCR 实验以 GAPDH 作为内源性对照,每个反应的溶解曲线只有一个峰才可视为有效结果。实验重复3 次。
1.8 CCK-8 法检测细胞增殖
处于对数生长期的细胞,经胰酶消化及离心后,用完全培养基重悬成单细胞悬液,计数后将细胞接种至96 孔板,密度为1000 个/孔,每孔完全培养基为100 μL。置于细胞培养箱中培养。待细胞贴壁后,沿孔壁缓慢加入10 μL CCK-8 试剂,轻微摇匀后置于细胞培养箱中,待孵育1 h 后使用酶标仪在450 nm 处检测每个孔的吸光值。同样的方法检测第24 h、48 h、72 h、96 h 的吸光值。实验重复3 次。
1.9 Edu 法检测细胞增殖
按3000 个/孔的密度将细胞接种于96 孔板中,置于细胞培养箱中培养过夜。按照试剂盒说明书加入预先配置好的1X Edu 溶液,细胞培养箱中孵育2 h,弃去Edu 溶液,4%多聚甲醛固定15 min,用0.3%TritonX-100/PBS 溶液室温孵育15 min 进行膜通透处理,用Hoechst 给细胞核染色后于荧光显微镜下拍照保存、计数。实验重复3 次。
1.10 克隆形成实验
按每孔1000 个细胞接种于6 孔板中,混匀后置于细胞培养箱中,培养箱温度保持37℃,二氧化碳体积浓度比维持5%,每2~3 d 给细胞换液。待细胞长出明显的单细胞克隆后,吸去孔中培养基,PBS 清洗后加入4%多聚甲醛固定15 min,加入0.1%结晶紫溶液给细胞染色30 min,用ddH2O 洗去残留的结晶紫溶液,晾干后拍照、计数。实验重复3 次。
1.11 Transwell 细胞迁移侵袭实验
基质胶提前一晚放于冰上化冻,用预冷的无血清DMEM 培养基按1∶3 的比例稀释基质胶,将80 μL 稀释后的凝胶滴入 8 μm 孔径的 Transwell 小室上室面,使凝胶铺匀后,室温静置2 min 后吸去60 μL,上室面留下 20 μL 稀释后的基质胶,放入细胞培养箱2 h 待其凝固备用。将细胞消化离心,用PBS 洗去残留的培养基,再次离心后用无血清的DMEM 重悬计数,调整细胞密度为5×105个/mL,分别取 200 μL 加入上室,下室加入 700 μL 含 10%血清的DMEM 完全培养基,置于细胞培养箱中培养24 h。取出Transwell 小室,弃去上室中培养液,PBS 清洗后置于4%多聚甲醛中固定15 min,PBS 清洗后置于0.1%浓度的结晶紫中染色30 min,ddH2O洗去结晶紫,晾干后于显微镜下拍照计数。迁移实验不铺基质胶,上室加入100 μL 细胞悬液,余实验步骤相同。实验重复3 次。
1.12 基因集富集分析
将TCGA 数据库中的肝癌mRNA 表达数据根据YY1 表达高低进行分组,YY1 表达高于总体75%者归于YY1 高表达组,表达低于总体25%者归于YY1低表达组,两组间的基因表达矩阵用于基因集富集分析(gene set enrichment analysis,GSEA)[16],选用c2.cp.kegg.v6.0.symbols.gmt 作为预定义基因集,分析与YY1 表达最相关的生物过程及信号通路。
1.13 基因富集分析
利用R 软件包“clusterProfiler”对筛选出来的93 个YY1 共表达基因进行KEGG 富集分析和GO富集分析[17],分析共表达基因的生物学功能。绘制柱状图:横坐标为基因数,纵坐标为各信号通路,柱状图颜色代表p 值。
1.14 蛋白质互作网络构建
利用String 数据库(https://string-db.org/)对93个YY1 共表达基因构建蛋白质互作网络(protein -protein interaction network,PPI)[18],置信度设置为0.7(高度可信),所得结果用Cytoscape 软件行可视化分析。
1.15 统计学分析
本研究采用GraphPad Prism 8.0 及R 3.6.1 软件对实验数据进行统计学分析。生存分析使用Kaplan-Meier法。体外细胞功能学实验均重复3次,所有实验数据显示为3 次独立实验的均数±标准差。两样本之间比较,数据呈正态分布且方差齐采用Studentt 检验;方差不齐的数据采用校正t检验。P<0.05 时差异有统计学意义。
2 结 果
2.1 YY1 在肝癌中表达上调且与不良预后相关
在TCGA 数据库的肝癌队列中发现,YY1 在肝癌中表达量显著上调(图1A),高表达YY1 的患者总体生存期(overall survival,OS)较短(图1B)。其中,低表达YY1 的肝癌患者中位生存期为5.84 年,而高表达YY1 的肝癌患者中位生存期仅为3.14年。进一步分析发现,在肿瘤体积分期为T3 及T4的患者中YY1 表达更高(10.36±3.64 vs 9.04±2.75,P<0.01,图1C);肿瘤分期越晚(Ⅲ+Ⅳ)、组织学分化更差(Ⅲ+Ⅳ)的患者中YY1 表达显著增加(图1D-1E,P<0.05),提示YY1 表达可能与肝癌增殖、恶性进展相关。在GSE14520、GSE25097 及ICGCLIRI-JP 肝癌验证队列中,我们发现YY1 在肝癌组织中表达量显著高于癌旁组织,差异均有统计学意义(P<0.0001,图1F~1H)
2.2 YY1 在肝癌组织及细胞系中的表达情况
分析我院30 对肝癌及配对癌旁组织的YY1免疫组化染色发现,YY1 集中表达在细胞核中,相比于癌旁组织,YY1 在肝癌组织内阳性区域更多、染色更强(图2A),肝癌组织的免疫评分显著高于癌旁组织(P<0.05,图2B)。通过蛋白质免疫印迹实验,我们发现YY1 在BEL-7402、HepG2、Hep3B、Huh7、MHCC97H、HCCLM3 等肝癌细胞系中高表达,在PLC/PRF/5 中低表达(图2C)。因此,我们使用敲降表达及过表达YY1 的慢病毒载体构建稳定转染的肝癌细胞株;其中,肝癌细胞Huh7 敲降 YY1 表达,低表达 YY1 的 PLC/PRF/5 细胞则过表达 YY1。如图 2D 中显示,Huh7 敲低 YY1 表达后,蛋白水平明显下降;PLC/PRF/5 经过表达YY1后,蛋白水平也明显增加。实时荧光定量PCR 实验证实,在Huh7 中敲低YY1 表达后mRNA 水平明显下降(P<0.05,图 2E);PLC/PRF/5 中过表达YY1 组较对照组mRNA 的表达明显上调(P<0.05,图2F)。
2.3 YY1 对肝癌细胞体外增殖功能的影响
在TCGA 数据库肝癌研究队列中,YY1 的表达与患者肿瘤大小显著相关(图1C)。进一步研究发现,YY1 的表达水平与常见的增殖相关基因MKI67、PCNA 及MCM2 表达水平呈显著正相关(Spearman相关系数分别为:Ki67:R=0.46,P<0.0001;PCNA:R=0.44,P<0.0001;MCM2:R=0.46,P<0.0001;图3A-3C)。体外CCK-8 检测实验显示,在Huh7 中干扰YY1 表达后,细胞增殖减慢,在第 96 h 的 OD450 显著低于对照组(1.040±0.092vs1.447±0.099,P<0.01,图 3D);PLC/PRF/5 过表达YY1 后细胞增殖显著加快,PLC/PRF/5-YY1 在第96 h 的吸光值显著高于对照组(1.266±0.053vs0.963±0.041,P<0.001,图3F)。在 Edu 增殖检测实验中,Huh7-shYY1 组较对照Huh7-shCon 组Edu 阳性的细胞比例明显减少(P<0.001,图3E),提示细胞增殖比例下降;在PLC/PRF/5-YY1 相比于对照组细胞,Edu 阳性细胞占比则有所增加(P<0.01,图3G)。克隆形成实验中发现,Huh7 干扰YY1 表达后,其克隆形成数目(392±55.6)少于对照组(151.3±66.9),差异有统计学意义(P<0.01,图3H)。而过表达YY1 的PLC/PRF/5 细胞克隆形成数目(446.7±39.5)显著多于对照组(306±41,P<0.05,图3I)。以上实验结果提示YY1 可影响肝癌细胞的增殖能力,提示YY1 可能在促进肝癌增殖、生长中发挥了重要的作用。
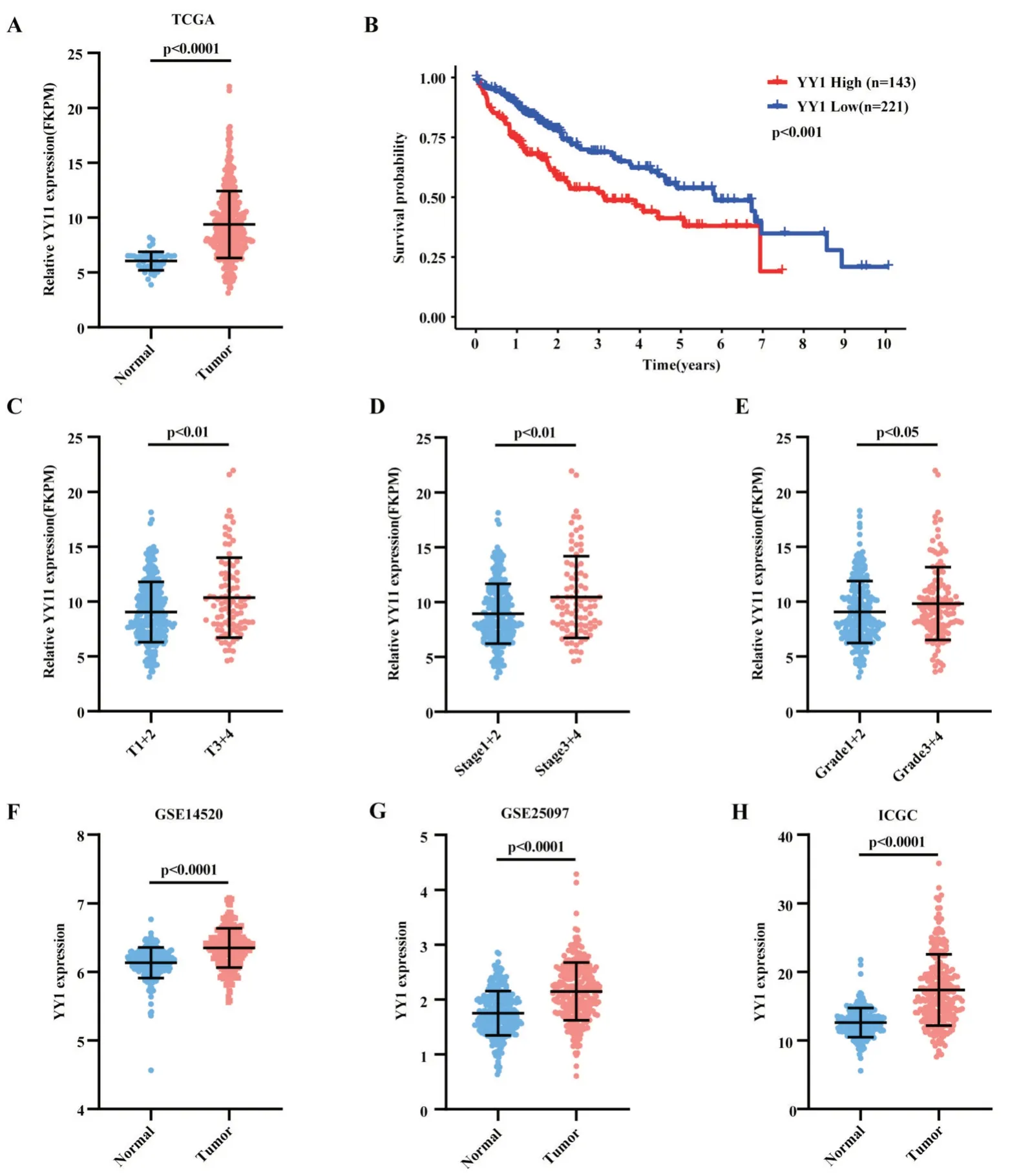
图1 YY1 在肝癌组织中的表达情况图 A:YY1 在TCGA-LIHC 中的表达情况(t 检验);B:TCGA-LIHC 中YY1 表达与患者总体生存期相关(Kaplan-Meier 法,log-rank 检验);C、D、E:YY1 在TCGA-LIHC 中与肿瘤体积、肿瘤分期、病理学分级相关(t 检验);F:YY1 在GSE14520 中的表达情况(t 检验);G:YY1 在GSE25097 中的表达情况(t 检验);H:YY1 在ICGC-LIRI-JP 中的表达情况(t 检验)
2.4 YY1 对肝癌细胞体外迁移侵袭能力的影响
Transwell 细胞迁移、侵袭实验显示,Huh7 干扰YY1 表达后,Huh7-shYY1 组 24 h 的细胞迁移数(62.7±11.7)较对照组(118.3±7.6)明显减少;侵袭细胞数 Huh7-shYY1 组为 49±2,对照组为 100.7±10.5,迁移、侵袭细胞数两组差异均有统计学意义(P<0.05,图 4A)。过表达 YY1 的 PLC/PRF/5 细胞中,24 h 迁移及侵袭细胞数较对照组均明显增加(迁移细胞数:220.7±14.3vs59.7±13;侵袭细胞数:176.3±15.5vs38±8),两组差异均有统计学意义(P<0.05,图4B)。因此,体外实验证实YY1 可以促进肝癌细胞的侵袭转移能力。
2.5 YY1 与基因集富集分析
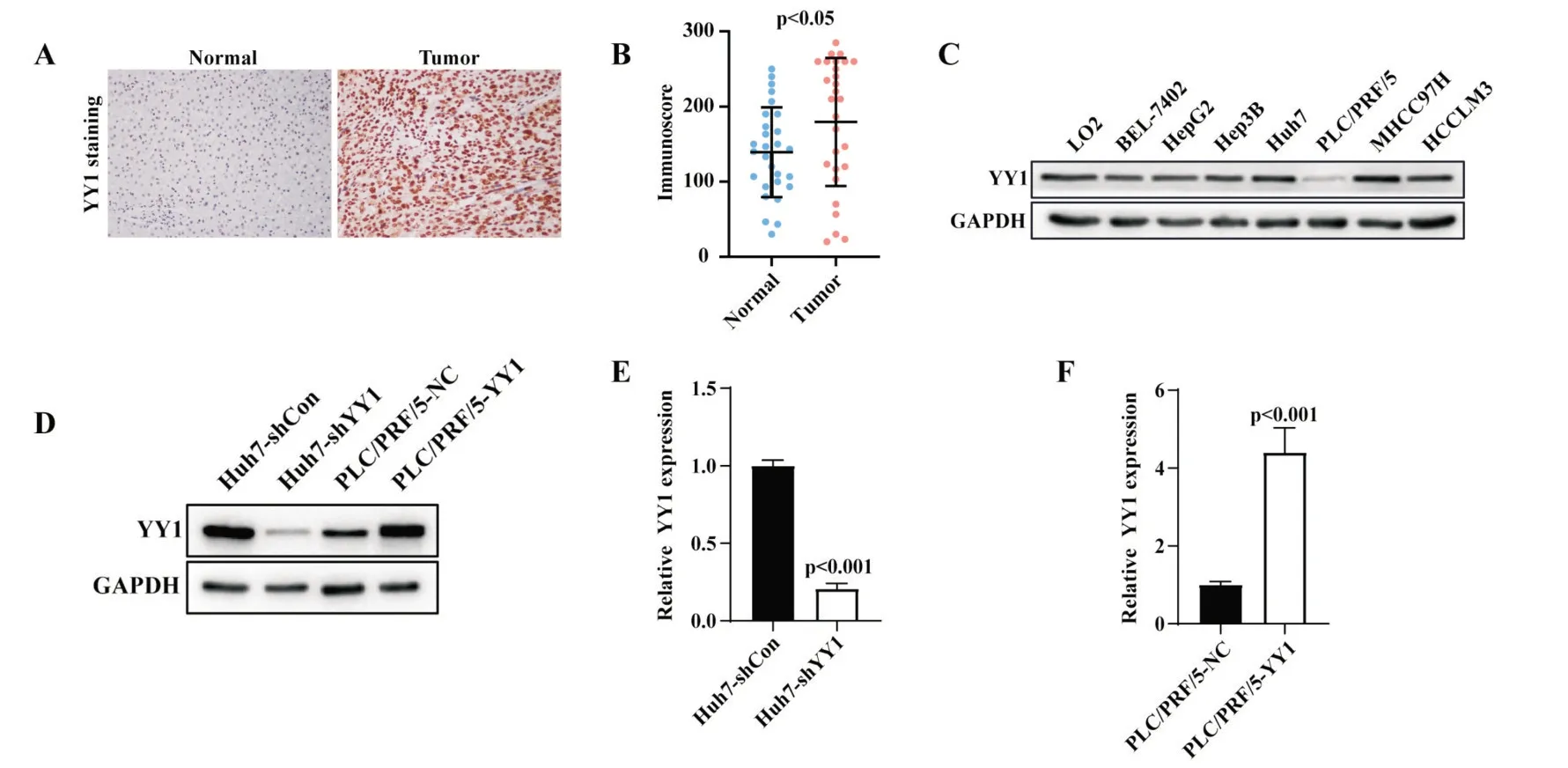
图2 YY1 在肝癌组织及肝癌细胞系中的表达情况 A:YY1 在肝癌组织及配对癌旁组织的免疫组化染色;B:YY1 在30 对肝癌组织及配对癌旁组织的免疫评分(t 检验);C:肝癌细胞系中YY1 的本底表达情况;D:蛋白免疫印迹实验检测YY1 敲降表达及过表达效果;E:q-PCR 实验检测YY1 敲降表达及过表达效果(t 检验)
基因集富集分析比较TCGA-LIHC 中高、低表达YY1 两组之间差异的信号通路,我们发现YY1高表达组中富集了多种肿瘤相关的通路,比如KEGG-PATHWAYS-IN-CANCER、KEGG-CELL-CYCLE、KEGG-APOPTOSIS 和 KEGG-VEGF-SIGNALING-PATHWAY。同时,参与肿瘤发生及进展相关的分子信号通路,比如KEGG-ERBB-SIGNALINGPATHWAY、KEGG-MAPK-SIGNALING-PATHWAY、KEGG-NOTCH-SIGNALING-PATHWAY 及KEGGWNT-SIGNALING-PATHWAY也显著富集于YY1高表达组中(图5A,P<0.05,FDR<0.05)。这些结果提示YY1 的表达上调可能会激活这些信号通路从而促进肝癌进展。
2.6 YY1 与基因共表达分析
具有类似表达模式的基因可能参与相近的分子生物学功能,因此,我们筛选TCGA、GEO 及ICGC 数据库中与YY1 表达显著相关的基因,我们将与YY1 表达相关系数绝对值超过0.4,p 值小于0.05 的基因定义为YY1 的共表达基因,四个不同的肝癌研究队列中筛选出93 个共表达基因(图5B)。经过KEGG 通路富集分析,我们发现这些共表达基因主要参与了基因复制及基因转录相关的信号通路,比如DNA 复制、RNA 转运及细胞周期等(图5C)。在GO 通路富集分析中,这些共表达基因参与了P53基因介导的信号转导,tRNA转运及DNA 复制等(图5D)。进一步分析中,我们通过String 数据库构建YY1 与这些共表达基因的蛋白质互作网络,在置信度为0.7(高度可信)时,我们发现93 个共表达基因之间的蛋白互作网络数(249)比预期的互作网络数(60)显著增加(PPI enrichmentPvalue=1.0×10-16)。其中预测到 YY1 与8 个蛋白存在高度可信的互作网络,包括FKBP3、RBBP7、H2AFV、ACTL6A、PAXIL1、NCOA6、SUZ12和H2AFZ,提示YY1可能与这8个共表达基因存在相互作用关系,参与调控相应的分子生物学功能。
3 讨 论
YY1 是1991 年被发现并纯化的锌指类转录因子,属于GL1-Kruppel 蛋白质家族,编码基因位于人类14 号染色体端粒区q32.2,序列在脊椎动物中高度保守[19,20]。作为一类重要的转录因子,YY1可以影响大约7%的哺乳动物基因的转录活性,通过调控基因转录、大规模染色体重组及X 染色体失活等参与调节细胞增殖、分化和凋亡等生物学过程[21]。多项研究表明YY1 在多种肿瘤中异常表达,发挥抑癌或促癌作用。如在乳腺癌、胰腺导管腺癌及食管鳞状细胞癌中,YY1 能抑制肿瘤进展[7-10],而在肺癌、胃癌及结直肠癌中则发挥促癌作用[11-13]。在肝癌的研究中,Kim 等人报道 YY1 在细胞核中的表达上调与肝癌不良预后相关[14],Tsang 等人分析50 对肝癌与配对癌旁组织免疫组化染色发现,YY1 在68%的肝癌组织中表达量明显增加[22]。而在Wang LM 等人的报道中,他们分析了80 对肝癌组织及配对癌旁组织的mRNA 表达水平,发现65%肝癌组织中YY1 表达低于癌旁组织,而且高表达YY1 的患者肝癌组织病理学分级较好,指出YY1高表达在肝癌中是保护因素而非危险因素[15]。因而不能将YY1 笼统地归为抑癌基因或癌基因,YY1 在不同肿瘤甚至同一肿瘤中功能的差异性可能与其特殊的结构有关,YY1 蛋白包含多个不同的活性催化区域一方面可直接识别结合启动子区的YY1 应答元件促进靶基因转录,另一方面还可以通过招募共激活因子(如p300、CBP或PRMT1 等)或共抑制因子(如HDACs、EZH2 或DNMTs)改变下游基因YY1 应答元件附近染色质的表观遗传修饰状态,促进或抑制下游基因的表达[23,24]。
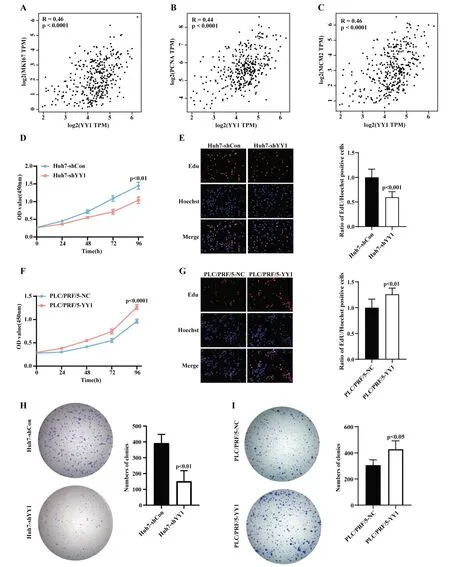
图3 YY1 对肝癌细胞增殖和克隆形成能力的影响 A、B、C:YY1 在TCGA-LIHC 中与增殖相关基因MKI67、PCNA 和MCM2 显著正相关(Spearman 相关性分析);D、F:CCK-8 实验检测敲降或过表达YY1 后细胞增殖情况(t 检验);E、G:Edu 染色法检测敲降或过表达YY1后细胞增殖情况(t 检验);H、I:敲降或过表达YY1 后细胞克隆形成能力改变情况(t 检验)
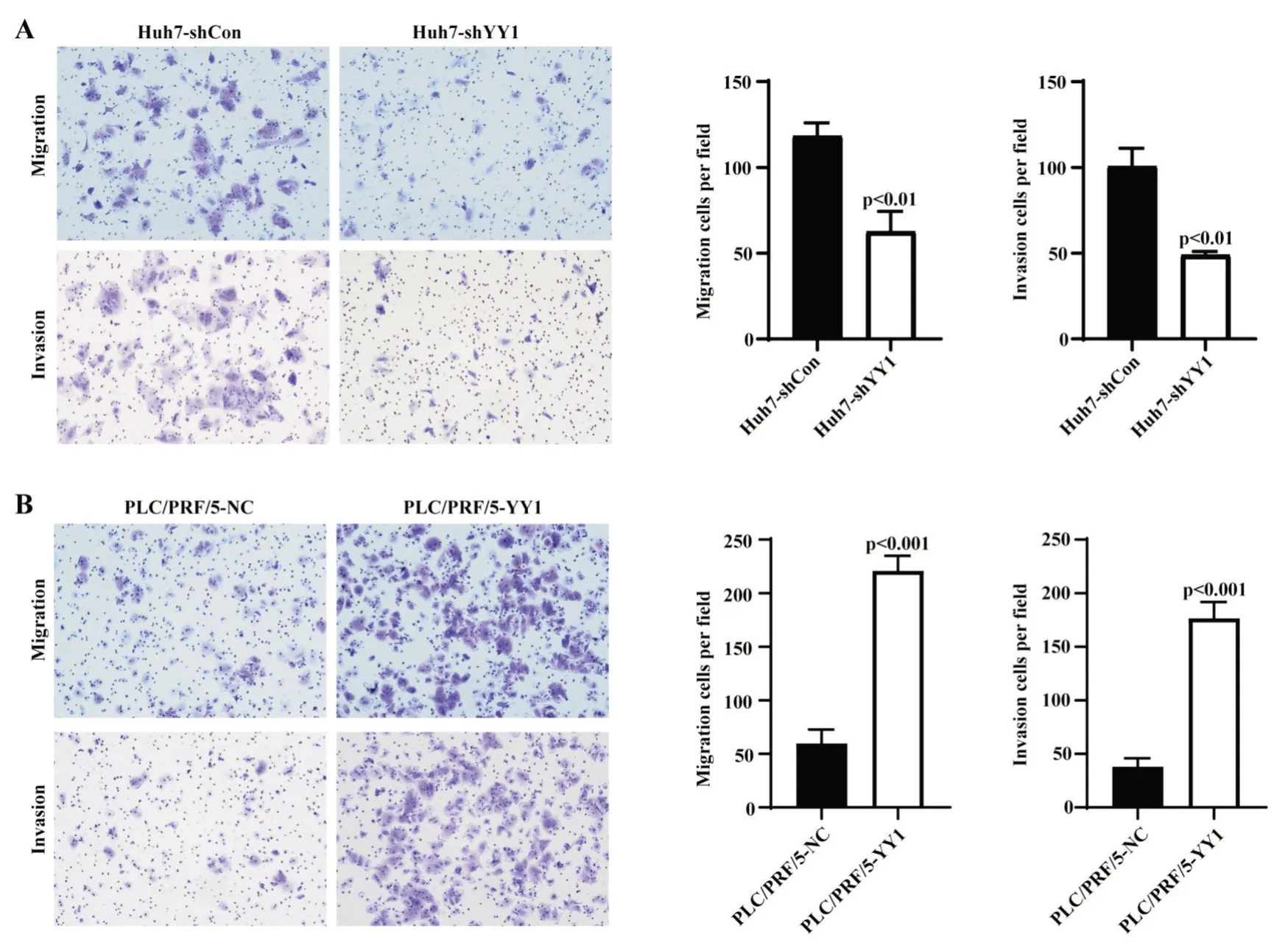
图4 YY1 对肝癌细胞迁移、侵袭能力的影响 A:敲降YY1 表达后Huh7 迁移、侵袭能力显著降低(t 检验);B:过表达YY1 后PLC/PRF/5 迁移、侵袭能力显著增强(t 检验)

图5 基因集富集分析、基因共表达分析及蛋白质互作网络构建 A:YY1 高表达的HCC 患者明显富集多种与肿瘤发生发展相关的信号通路;B:筛选并确定93 个TCGA-LIHC、GSE14520、GSE25097 及ICGC-LIRI-JP 数据集中的YY1 过表达基因;C、D:93 个YY1 共表达基因的KEGG、GO 通路富集分析;E:构建YY1 与共表达基因之间的蛋白质互作网络
本研究分析TCGA-LIHC、GSE14520、GSE25097及ICGC-LIRI-JP 四个肝细胞癌研究队列中YY1 的表达及临床意义,并在本院收集的样本中进行验证,分析结果均显示YY1 在肝癌组织中的表达显著高于正常肝组织,且YY1 高表达能指示患者的不良预后。值得注意的是YY1 与肿瘤体积、肿瘤分期、肿瘤病理学分级密切相关,提示YY1 可能在多方面影响肿瘤进展。我们的体外实验结果显示,YY1 可以促进肝癌细胞增殖、迁移及侵袭,进一步证实YY1 确实可以从多个方面影响到肝癌细胞。在探讨YY1 在肝癌中发挥作用的潜在机制时,我们分析了TCGA-LIHC 研究队列的转录组测序数据,与预期一致,结果显示YY1 高表达组富集到更多与肿瘤发生及进展相关的信号通路。此外,分析YY1 的共表达基因并构建蛋白质互作网络发现,YY1 与这些共表达基因参与DNA 复制、RNA 转运及细胞周期等生物学过程,进一步提示转录因子YY1 在肝癌中可能广泛参与调控基因复制及转录;预测到与YY1 存在高度可信的蛋白质互作网络的基因可能是YY1 的下游靶基因,这可以为我们后续的机制研究提供参考和方向。
综上所述,本研究初步探讨了YY1 基因在肝癌中的预后意义,体外实验证明YY1 可以促进肝癌细胞的增殖及恶性转化能力,靶向干扰肝癌组织中的YY1 表达可能是潜在的药物治疗靶点。
