醇沉金蝉花粗多糖对宫颈癌细胞的增殖抑制作用及可能机制
2021-03-25吕万林周红秋朱益灵王一姝魏渊欧阳臻
吕万林,周红秋,朱益灵,王一姝,魏渊,欧阳臻
(江苏大学药学院,江苏 镇江 212013)
金蝉花(Cordycepscicadae)又名蝉蛹草、蝉草、蜩、蝉茸等,为麦角菌科真菌蝉草及其寄主山蝉若虫形成的干燥复合体,其性寒味甘,具有定惊镇痉,散风热,眼疾消炎等作用[1]。金蝉花与无性型冬虫夏草同属,具有的功能活性组分相似[2],但冬虫夏草生长在条件严苛的青藏高原[3],而金蝉花一般生长于海拔为200~400 m的苦竹林或海拔750~900 m的针阔叶混交林地区,在我国主要分布在江苏、台湾、海南、四川、福建、浙江、云南和广东等地[4]。因此,金蝉花有望成为冬虫夏草的代用品,改善冬虫夏草资源稀缺状况,发展成为新的保健品、药品。
现代药理学研究发现金蝉花具有肝损伤保护[5]、肾脏保护[6]、抗肿瘤[7]、免疫调节[8]、抗氧化[9]、降血糖[10]等多种药理作用。多糖作为许多中药的主要活性成分,其抗肿瘤活性受到医药科研工作者的青睐。据报道,金蝉花不同纯化组分单独使用均对人肺腺癌PAA-1细胞具有抑制作用;联合化疗药物使用后则呈现不同的效果,总多糖表现为抑制作用,而腺苷则起协同作用[11]。王育纯等[12]连续10 d给S180肉瘤鼠灌胃金蝉花水煎液(20 mL/kg),肿瘤抑制率达22.5%。且研究发现金蝉花水提取液的抗肿瘤活性要高于虫草头孢菌、蝙蝠蛾拟青霉菌和蛹虫草水提液[13]。Wang等[14]实验表明金蝉花水提取物(0、100、250、500和1 000 μg/mL)通过作用于G2/M期细胞周期并以剂量依赖的方式抑制人肝癌MHCC97H细胞的生长,但没有凋亡迹象。Xie等[15]研究表明,金蝉花乙醇提取物对人肺腺癌A549细胞、宫颈癌Hela细胞、人胃癌SGC-7901细胞均具有增殖抑制作用,其中SGC-7901细胞的凋亡是通过增加内质网应激,阻滞细胞S期,并激活Caspase信号通路实现的。
宫颈癌是妇科最常见的癌症之一,对大多数抗肿瘤药物不敏感,化疗有效率低,发病率居女性生殖系统肿瘤的首位。本研究以金蝉花为原料,制备了50%和80%两种浓度的醇沉金蝉花多糖,探讨醇沉金蝉花多糖体外抗人宫颈癌Hela细胞活性及可能的机制,以期为金蝉花抗肿瘤药品的开发提供理论依据。
1 材料与方法
1.1 主要材料与试剂
野生金蝉花于2018年7月采自江苏省句容市天王镇磨盘山,由江苏大学药学院欧阳臻教授鉴定;牛血清白蛋白(上海蓝季科技发展有限公司);考马斯亮蓝、葡萄糖、5-氟尿嘧啶(上海国药集团化学试剂有限公司);胎牛血清(美国Gibco公司) ;高糖DMEM培养基(以色列Biological Industries公司);兔抗人BAX、BCL2、P53单克隆抗体(美国CST公司);β-肌动蛋白抗体(武汉三鹰生物技术有限公司);羊抗兔二抗(南通碧云天生物技术有限公司);BCA蛋白定量试剂盒、2′,7′-二氯荧光黄双乙酸盐(2′,7′-Dichlorodihydrofluorescein diacetate,DCFH-DA)活性氧检测试剂盒(上海碧云天生物技术有限公司);Trizol总RNA提取试剂盒(徐州溥博生物科技有限公司);0.25%胰酶消化液(上海创赛科技有限公司);脱脂奶粉(澳大利亚迈高乳业有限公司);苯酚、硫酸、95%乙醇、磷酸、三氯甲烷、正丁醇均为分析纯。人宫颈癌Hela细胞(CBP60232)购于中国科学院上海生科院细胞资源中心。
1.2 仪器
B-490旋转蒸发仪(瑞士步琪有限公司);RO-MB-10D高纯水机(浙江杭州永洁达膜分离设备厂);高速低温离心机(美国Beckman公司);SpectraMax190酶标仪(美国Molecular Devices公司);倒置显微镜TS100(日本Nikon公司);核酸蛋白检测仪(日本岛津公司);基因扩增仪2720型(美国应用生物系统公司);荧光定量PCR仪LightCycle96(瑞士罗氏公司)。
1.3 两种浓度醇沉金蝉花多糖的制备
将金蝉花去泥,粉碎,过80目筛。取50 g干燥粉末于1 L圆底烧瓶中,加入500 mL去离子水,88 ℃水浴加热,提取2次,每次2 h。3 990 r/min离心15 min,分离滤渣与滤液,合并两次滤液,旋转减压浓缩至70 mL。活性炭脱色3次,获得金蝉花多糖。然后将获得的多糖配置成5%的溶液,加入1/3体积的Sevage试剂(V三氯甲烷∶V正丁醇=4 ∶1),充分振摇20 min,4 000 r/min离心15 min,脱蛋白4次,取少量上清液测定蛋白质及多糖含量,剩余上清液分别加入乙醇使其浓度为50%和80%,4 ℃静置过夜以沉淀金蝉花多糖,冷冻干燥,获得CP50和CP80。金蝉花多糖含量的测定参照中华人民共和国农业行业标准NY/T1676-2008《食用菌中粗多糖含量的测定》中的苯酚—硫酸法。采用考马斯亮蓝微盘比色法测定蛋白质含量[16]。
1.4 CCK-8法检测金蝉花多糖处理后人宫颈癌Hela细胞的增殖
收集对数生长期的Hela细胞,计数并调整细胞密度为约5 × 104个/mL,每孔加100 μL于96孔板中。药物处理组分别加入不同浓度的CP50和CP80培养液(25,50,100,200,400,800,1 600 μg/mL);阳性对照组用5-氟尿嘧啶(50 μg/mL)处理;对照组用培养基处理;空白组为不加细胞的培养基。设5个复孔,培养24 h,每孔加入10 μL CCK-8溶液避光培养4 h,用酶标仪在波长450 nm处测定光密度(D)值,并计算细胞存活率。细胞存活率=(实验组D值-空白组D值)/(对照组D值-空白组D值)×100%。使用GraphPad Prism软件计算半数抑制浓度(IC50),筛选活性较好的多糖进行后续实验。
1.5 显微镜观察金蝉花多糖处理后Hela细胞的形态
将对数生长期的Hela细胞稀释成1 × 105个/mL的细胞悬浮液,并接种于24孔培养板中,每孔500 μL,培养24 h,除去培养基,PBS清洗2次,加入CP80多糖各样液(50、100、200、400、800 μg/mL),对照组用培养基处理,阳性对照组加入5-氟尿嘧啶(50 μg/mL),培养24 h,于显微镜下观察细胞形态。
1.6 DCFH-DA探针法检测金蝉花多糖处理后Hela细胞内活性氧水平
将Hela细胞(5×104个/mL)加入96孔板中,每孔100 μL,培养24 h,加入不同浓度的CP80培养基,24 h后吸除培养基,用PBS漂洗3次,加DCFH-DA溶液于培养箱内孵育20 min,用无血清培养基洗涤3次。使用荧光酶标仪检测荧光强度(激发光波长488 nm,发射光波长525 nm),计数并计算DCF荧光强度/104个细胞。
1.7 实时定量PCR检测金蝉花多糖处理后Hela细胞P53、BAX和BCL2 mRNA表达
使用60 mm培养皿培养Hela 24 h,加入不同浓度的CP80培养基继续培养24 h。除去CP80培养基,用PBS洗涤2遍,按照Trizol提取试剂盒说明书提取Hela细胞总RNA,取1 μL测浓度,-80 ℃保存。按cDNA逆转录试剂盒说明书进行操作,于PCR仪中在42 ℃ 60 min,80 ℃ 10 min的条件下合成cDNA。RT-PCR反应体系:Master Mix 9 μL,上、下游引物(10 μmol/L)各2 μL,cDNA模板各2 μL,加无RNA酶去离子水至20 μL。以β-肌动蛋白作为内参基因,进行实时荧光定量PCR分析,实验平行3次。
实验反应条件如下,P53:95 ℃预变性10 min,95 ℃变性3 s,55 ℃退火10 s,72 ℃延伸10 s,反应42个循环。BAX:95 ℃预变性5 min,92 ℃变性30 s,68 ℃退火30 s,72 ℃延伸45 s,反应42个循环。BCL2:95 ℃预变性10 min,95 ℃变性30 s,55 ℃退火30 s,65 ℃延伸20 s,反应46个循环。实验数据采用2-ΔΔCt法进行相对定量分析。RT-PCR引物由上海生工生物技术有限公司合成。引物序列如下,P53:上游 5′-TTCCTGAAAACAACGTTCTGTC-3′,下游 5′-AACCATTGTTCAATATCGTCCG-3′;BAX:上游 5′-CGAACTGGACAGTAACATGGAG-3′,下游5′-CAGTTTGCTGGCAAAGTAGAAA-3′;BCL2:上游 5′-GACTTCGCCGAGATGTCCAG-3′,下游 5′-GAACTCAAAGAAGGCCACAATC-3′;β-肌动蛋白:上游 5′-CCTGGCACCCAGCACAAT-3′,下游 5′-GGGCCGGACTCGTCATAC-3′。
1.8 蛋白质印迹检测金蝉花多糖处理后Hela细胞P53、BAX和BCL2蛋白表达
取对数生长期细胞按1×106个/mL接种于培养皿中。培养24 h后,加入不同浓度的CP80培养基继续培养24 h,PBS洗涤2遍,加胰蛋白酶消化1 min,完全培养基终止消化,4 ℃,4 000 r/min离心10 min。加入含PMSF的细胞裂解液冰上裂解35 min,4 ℃,12 000 r/min离心30 min,收集上清液,BCA法准确测定蛋白浓度。加入5×SDS蛋白上样缓冲液溶解,煮沸5 min,以β-肌动蛋白作为内参。
蛋白样品上样30 μg,以10%的分离胶和5%的浓缩胶进行凝胶电泳分离。浓缩胶:80 V 30 min;分离胶:110 V 70 min。在 80 V条件下转膜60 min;37 ℃封闭1 h,用一抗稀释液β-肌动蛋白(1 ∶1 500),BCL2(1 ∶1 000),BAX(1 ∶1 000)以及P53(1 ∶1 200)孵育2 h,用二抗稀释液(1 ∶1 000)孵育1 h,曝光仪曝光,记录成像结果。使用Image J软件分析蛋白灰度值,计算蛋白相对表达量。
1.9 统计学分析
2 结果
2.1 CP50和CP80的含量
CP50和CP80的粗多糖得率分别为2.69%、18.79%,多糖含量分别为2.11%、6.23%。
2.2 两种浓度醇沉金蝉花多糖对Hela细胞增殖的影响
CCK-8结果如图1和图2。随着浓度的增加,CP50和CP80对Hela细胞的增殖均有一定的抑制作用(F=44.47,P<0.01;F=74.65,P<0.01)。与对照组相比,CP80浓度为100 μg/mL时,Hela细胞的存活率为87.73%(P<0.05)。随着浓度的升高,细胞存活率降低。当浓度为200、400、800 μg/mL时具有显著性差异,细胞存活率分别为84.85%、71.58%和58.60%(P<0.01),当浓度达到1 600 μg/mL时,细胞已经大量凋亡,存活率为34.40%(P<0.01)。而CP50在浓度400 μg/mL时,细胞存活率降低才具有统计学意义,为82.98%(P<0.05),随着浓度的升高,其抑制细胞增殖的作用较CP80小。通过GraphPad Prism软件计算得到CP50和CP80对Hela细胞抑制的IC50值分别为1 203.0 μg/mL和778.9 μg/mL。因此,后续实验使用CP80对人宫颈癌Hela细胞进行处理。
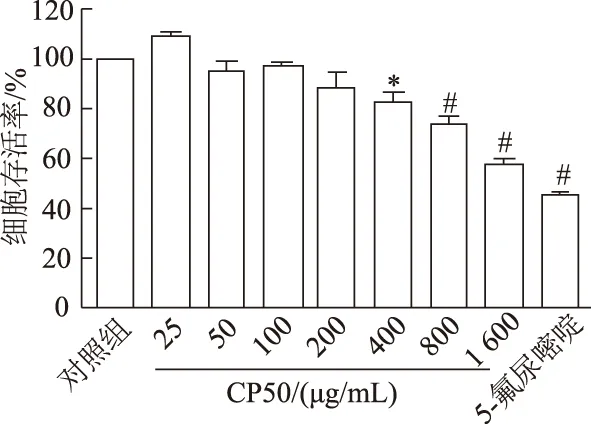
*:P<0.05,#:P<0.01,与对照组比较

*:P<0.05,#:P<0.01,与对照组比较
2.3 CP80处理后Hela细胞的形态
由图3可见,对照组中细胞生长良好,细胞数目多且形态为正常的梭形;5-氟尿嘧啶阳性对照组中细胞数目相对较少,细胞皱缩成团,死细胞、细胞碎片较多;CP80多糖处理组中活细胞数量与对照组相比,随浓度的递增,细胞逐渐减少,细胞死亡数也增多。

图3 CP80处理后Hela细胞24 h的形态(×100)
2.4 CP80处理后Hela细胞内的活性氧水平
如图4所示,CP80处理Hela细胞24 h后,细胞荧光强度较对照组显著增强,且荧光强度随CP80浓度的升高而增加(F=131.105,P<0.01),当多糖浓度达800 μg/mL时,细胞荧光强度达最大值。
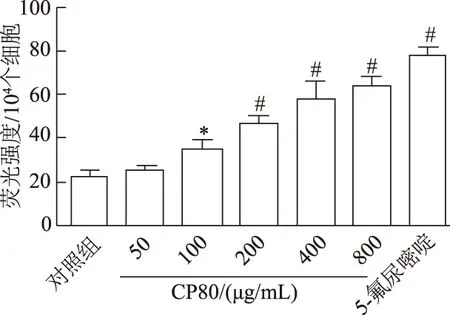
*:P<0.05,#:P<0.01,与对照组比较
2.5 CP80处理后Hela细胞内P53、BAX和BCL2的mRNA表达
实时定量PCR结果显示,与对照组相比,随着CP80多糖浓度的增加,Hela细胞中BCL2mRNA的表达水平逐渐降低(F=5.246,P<0.01),而BAX、P53mRNA的表达水平逐渐升高(F=17.642,P<0.01;F=7.661,P<0.01)。当CP80多糖浓度达到800 μg/mL时,三者表达水平与阳性对照组相当。见图5。
2.6 CP80处理后Hela细胞P53、BAX和BCL2蛋白的表达
不同浓度CP80培养后,蛋白质印迹结果显示,与对照组相比,CP80能明显降低Hela细胞中BCL2蛋白的表达(F=141.506,P<0.01),BAX、P53蛋白在CP80多糖浓度分别达到200 μg/mL、100 μg/mL时,表达水平即明显升高(F=6.256,P<0.01;F=3.804,P<0.05)。见图6。
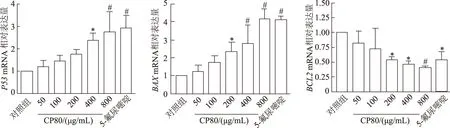
n=3;*:P<0.05,#:P<0.01,与对照组比较

*:P<0.05,#:P<0.01,与对照组比较
3 讨论
宫颈癌作为女性高发恶性肿瘤,发病率在女性妇科恶性肿瘤中居第1位,在女性恶性肿瘤中居第2位,仅次于乳腺癌。部分恶性肿瘤可通过手术、化疗等治愈,但多数恶性肿瘤治疗无法达到预期效果。因此,寻找新的疗效好、安全低毒的抗肿瘤药仍是当今人类面临的难题之一。随着科研理念和技术的不断更新,越来越多的科研工作者开始研究中药及其活性成分的抗肿瘤活性。何蒙娇等[17]研究表明,白藜芦醇可以下调人宫颈癌Hela细胞hTERTmRNA 和蛋白表达水平,抑制Hela细胞端粒酶活性,且呈浓度依赖性。中药活性成分蛇床子素能显著抑制Hela-S3增殖,其机制可能是升高细胞内活性氧水平,下调BCL2、Survivin蛋白表达,上调 BAX、Cleaved-PARP、Cleaved-Caspase-3 蛋白表达[18]。
本研究采用CCK-8法检测CP50和CP80两种粗多糖对Hela细胞增殖的影响,结果显示随着多糖浓度升高,两种多糖对Hela细胞的增殖均有抑制作用,但CP80的抑制效果更为显著,其原因可能是CP80多糖含量较CP50高。
本研究结果显示CP80对Hela细胞的IC50值为778.9 μg/mL,该浓度剂量远大于西药使用剂量(阳性对照5-氟尿嘧啶为50 μg/mL)。据文献报道,金蝉花水提物对肝癌MHCC97H细胞的IC50值为500~1 000 μg/mL[14],金蝉花乙醇提取物对人胃癌SGC-7901细胞的IC50值为400 μg/mL左右[15]。可能因为中药多糖粗提物一般含有较多的杂质,并且通常分子量很大,难以通过细胞膜作用于肿瘤细胞,无法达到非常理想的治疗效果。而有研究报道榕属植物pandurata H分离纯化的均相多糖作用于Hela细胞24 h和48 h后的IC50值分别为31.50和22.62 μg/mL[19]。板栗纯化多糖YCP-H对人肝癌HepG2细胞的IC50值为 0.08 μg/mL,在剂量为1 mg/mL时,抑制率接近 95%,接近于临床上紫杉醇对人体的正常使用浓度。此外该多糖对人非小细胞肺癌A549细胞的IC50值为17.1 μg/mL[20]。因此,后续可以对金蝉花粗多糖进行分离纯化,以进行更深入系统的研究。
细胞内活性氧水平升高会启动氧化应激反应,从而诱导肿瘤细胞凋亡[21]。本研究中,随着CP80浓度的增加,Hela细胞内活性氧水平显著增加。在细胞凋亡过程中,BAX蛋白与细胞膜透化作用密不可分。而BCL2作为细胞外膜上的抗凋亡蛋白,能够与BAX前体结合阻止细胞凋亡的发生[22]。冯嘉昆等[23]研究表明半夏提取物抑制髓系白血病、T淋巴细胞白血病细胞增殖的作用机制与其调节BAX/BCL2、Caspase-3蛋白表达有关。而改善BAX、BCL2蛋白的表达,有利于非小细胞肺癌患者的康复[24]。本研究中,CP80处理后Hela细胞P53、BAXmRNA和蛋白表达水平显著上调,BCL2mRNA和蛋白表达水平显著下调。以上结果表明,金蝉花多糖抑制人宫颈癌Hela细胞的机制可能是通过提高细胞内活性氧,调控BAX/BCL2的基因及蛋白质表达,同时激活P53信号通路,介导Hela细胞凋亡。
综上,本研究以人宫颈癌Hela细胞为肿瘤研究模型,探讨了金蝉花粗多糖CP50和CP80的抗肿瘤活性作用,并对其机制进行了初步研究。后续将对CP50和CP80进一步分离纯化以进行更深入的研究,为金蝉花多糖开发应用于肿瘤的临床治疗提供有利的实验数据。
