柯萨奇病毒A 组6 型通用抗原检测试剂盒的建立
2021-03-20刘思远卞莲莲高帆刘佩霍雅倩王泽鋆张中洋李雅静戈小琴顾美荣安超强李克雷毛群颖姜崴
刘思远,卞莲莲,高帆,刘佩,霍雅倩,王泽鋆,张中洋,李雅静,戈小琴,顾美荣,安超强,李克雷,毛群颖,姜崴
1.中国食品药品检定研究院,北京102600;2.长春生物制品研究所有限责任公司,吉林 长春130000;3.武汉生物制品研究所有限责任公司,湖北 武汉430207;4.国药中生生物技术研究院有限公司,北京101111;5.北京科兴生物制品有限公司,北京100085;6.北京民海生物科技有限公司,北京102600
柯萨奇病毒A 组6 型(Coxsackievirus A6,CV-A6)属于微小核糖核酸病毒科肠道病毒属(Enterovirus,EV),遗传物质为单股正链RNA,包含于无包膜的病毒衣壳内[1]。CV-A6 感染通常引起婴幼儿人群手足口病(hand,foot and mouth disease,HFMD)、疱疹性咽峡炎等暴发或散发,部分患儿预后出现脱甲症,并可引起无菌性脑膜炎、病毒性脑炎等神经系统重症甚至死亡[2-4]。2008 年芬兰暴发CV-A6 引起的HFMD[5],随后CV-A6 在世界范围广泛传播,先后引起2008 年西班牙[6]、2008 年新加坡[7]、2010 年法国[8]、2011 年日本[9]、2012 年泰国[10]等国家HFMD暴发。我国自2008 年起,CV-A6 在HFMD 病原谱中比例呈逐年升高趋势,在部分地区逐渐成为HFMD主要病原之一[11-17]。
目前尚无针对CV-A6 感染的特异性治疗药物,疫苗是防控CV-A6 相关疾病最有效的手段。已上市的EV-A71 疫苗与CV-A6 病毒之间无交叉保护效应,使CV-A6 单价疫苗或含CV-A6 的多价HFMD疫苗的研发得到越来越多的重视。但目前尚处于临床前研究阶段[18-22]。
准确定量疫苗抗原含量是疫苗工艺优化、质量一致性的保证,也是疫苗免疫原性和保护效果评价以及疫苗剂量确定的关键指标,但尚无市售CV-A6抗原检测试剂盒以及相关试剂盒建立的报道。因此,中国食品药品检定研究院联合多家疫苗研发企业,建立了通用的CV-A6 抗原含量检测试剂盒,并初步筛选出CV-A6 抗原含量参考品,为保证CV-A6 抗原含量检测的准确性,推动疫苗的研发进程提供基础工具。
1 材料与方法
1.1 抗体和抗原 多克隆抗体(CV-A6-3I)、CV-A10抗原由武汉生物制品研究所有限责任公司惠赠,6个CV-A6 单克隆抗体9H1、3D9、10F4、5A6、6D12 和10G8 为采用灭活CV-A6 抗原纯化制备的鼠单克隆抗体,均由该公司惠赠;CV-A6 抗原分别由武汉生物制品研究所有限责任公司、北京科兴生物制品有限公司、国药中生生物技术研究院有限公司及北京民海生物科技有限公司提供,包括CV-A6 病毒培养、灭活、纯化原液(Ag1 ~ 3),CV-A6 病毒样颗粒(VLP)表达和纯化原液(Ag4),以及灭活疫苗生产过程中各工艺环节制品(中间产物1 ~ 4);CV-A6 抗原参考品采用CV-A6 / CY223 毒株经Vero 细胞培养、收获、灭活和纯化后制成,蛋白含量为17.8 μg / mL,-80 ℃保存;CV-A16、EV-A71 抗原、甲型肝炎病毒(hepatitis A virus,HAV)抗原均由中国食品药品检定研究院提供。
1.2 毒株及细胞 3 个CV-A6 毒株:Gdula(基因型A)购自ATCC;CA6-2007-00141(No.KR706309,D1 基因型)和WH-A6(基因型D1)由中国食品药品检定研究院保存。人胚胎横纹肌肉瘤细胞(RD 细胞)由中国食品药品检定研究院保存。
1.3 主要试剂 HRP-羊抗鼠IgG 购自北京鼎国昌盛生物技术有限公司;10%胎牛血清购自美国Gibco公司;含5%蔗糖的PBST 及抗体稀释液ED-33 购自北京万泰生物药业股份有限公司。
1.4 双抗体夹心ELISA 方法的建立
1.4.1 单克隆抗体的筛选
1.4.1.1 与CV-A6 抗原结合能力 采用间接ELISA法。将4 家企业的疫苗纯化后抗原(Ag1 ~4)稀释至0.1 μg /mL,包被96 孔板,100 μL / 孔,2 ~8 ℃过夜;洗涤5 次,拍干,加入洗涤封闭液,200 μL / 孔,37 ℃封闭2 h;洗涤3 次,拍干,用样品稀释液将6个CV-A6 单克隆抗体稀释至1 μg / mL 后,10 倍梯度稀释3 个稀释度,双复孔加样,100 μL / 孔,37 ℃孵育1 h;洗涤5 次,拍干,加入HRP-羊抗鼠IgG(抗体稀释液1 ∶8 000 稀释),100 μL/孔,37 ℃孵育1 h;洗涤5 次,拍干,加入A 和B 显色液,各50 μL / 孔,37 ℃避光显色8 ~12 min;加入终止液,50 μL / 孔,于450 / 630 nm 波长处读取A值。
1.4.1.2 中和活性 采用微量细胞病变法。取96孔板,将1 μg / mL 的6 个单克隆抗体以1 ∶32 ~1 ∶16 384 进行2 倍系列稀释后,分别与100 CCID50的Gdula、CA6-2007-00141 和WH-A6 3 个毒株37 ℃中和2 h;加入浓度为(1 ~2)× 105个/ mL 的RD细胞悬液,100 μL / 孔,35 ℃,CO2培养箱培养7 d;观察细胞病变效应(cytopathic effect,CPE),以可抑制50% CPE 最高稀释度的倒数判为中和抗体效价。试验同时设细胞对照和病毒回滴,仅有细胞对照无CPE,且病毒回滴在30 ~300 CCID50/ 孔时,试验方可成立。
1.4.2 方法的优化 采用棋盘法对包被浓度(1 ∶1 000 ~1 ∶32 000)和酶标记单克隆抗体的工作浓度(1 ∶1 000 ~1 ∶128 000)进行优化。用包被液[碳酸盐缓冲液(CBS)pH 9.6)]梯度稀释CV-A6-3I,100 μL / 孔,2 ~8 ℃包被过夜;洗涤5 次,拍干,加入封闭液,200 μL / 孔,37 ℃封闭2 h;洗板3 次,拍干,将参考品稀释至180 ng / mL,100 μL / 孔加样,37 ℃孵育1 h;洗板5 次,拍干,用抗体稀释液梯度稀释单克隆抗体,100 μL / 孔加样,37 ℃孵育1 h;加入显色液A 和B 液,各50 μL / 孔,37 ℃避光显色8 ~12 min;加入终止液,50 μL / 孔,于450 / 630 nm波长处读取A值。根据结果选择最佳包被浓度与酶标抗体浓度搭配。
1.5 双抗体夹心ELISA 方法的验证
1.5.1 线性范围 将CV-A6 参考品用样本稀释液从356 ng / mL 开始2 倍梯度稀释6 个稀释度,检测CV-A6 抗原含量,重复6 次,以阴性对照值的2.1 倍为Cut-off 值,确定线性范围和定量限。
1.5.2 专属性 选择与CV-A6 同为微小核糖核酸病毒科的CV-A16、CV-A10、EV-A71 和HAV 抗原,分别稀释至1 000 和100 ng / mL 作为待测样品,并将CV-A6 抗原样品中的其他成分MEM、DMEM 和FBS 作为待测样品,以CV-A6 疫苗原液作为阳性对照,PBS 作为阴性对照,检测CV-A6 抗原含量。
1.5.3 准确度 将参考品用样品稀释液稀释至高、中、低(120、60 和30 ng / mL)3 个浓度,检测CV-A6抗原含量,重复6 次,按下式计算样品回收率。

1.5.4 精密度
1.5.4.1 重复性 将参考品使用样品稀释液稀释至120、60 和30 ng / mL,单个实验员重复检测6 次,分别计算CV-A6 抗原含量及重复检测的CV值。
1.5.4.2 中间精密度 将参考品用样品稀释液稀释至120、60 和30 ng / mL,2 个实验员重复检测3次,计算CV-A6 抗原含量及CV值。
1.5.5 耐用性 在其他反应时间或温度不变的情况下,分别改变反应体系的单个条件,包括将抗原孵育时间或酶标抗体(5A6-HRP)孵育时间上下浮动5 min,整个体系的反应温度上下浮动2 ℃等,分别检测高、中、低(120、60 和30 ng / mL)浓度参考品CV-A6 抗原含量,并根据结果计算检测回收率。
1.6 方法适用性 [将CV-A6 抗原检测试剂盒和CV-A6 工作参考品分发给国内四个主要CV-A6 疫苗研发企业:武汉生物制品研究所有限责任公司(企业1)]、北京科兴生物制品有限公司(企业2)、国药中生生物技术研究院有限公司(企业3)及北京民海生物科技有限公司(企业4)。企业1 采用该试剂盒分别对该企业按CV-A6 灭活疫苗生产工艺制备的关键环节产物(中间产物和原液)进行抗原含量检测,企业2 ~4 采用该试剂盒分别对各实验室制备的CV-A6 疫苗原液进行检测。
1.7 统计学分析 应用Statistical Analysis 软件采用双平行线法对抗原定量检测结果进行统计学分析,应用EXCEL、GraphPad Prism 7.00 等软件对实验数据进行统计学分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 单克隆抗体筛选结果 ELISA 检测结果显示,9H1、3D9、5A6、6D12 与4 个抗原结合能力较强,而10F4 和10G8 与4 个抗原结合能力相对较弱。10G8、3D9、5A6 和10G8 在RD 细胞上均具有中和CV-A6的能力,但对不同CV-A6 毒株的中和能力存在差异。其中10G8 对CA6-2007-00141 及3D9 对Gdula 均具有较高的中和能力,分别为>16 384 和384,而仅有5A6 对包括原型株在内的3 个病毒株均表现出了高效价和广谱中和能力,中和效价均>16 384,见表1。表明5A6 对CV-A6 具有广谱和高效价的结合能力及中和能力,选择5A6 作为检测单克隆抗体。

表1 单克隆抗体与3 个CV-A6 毒株的中和能力Tab.1 Neutralizing abilities of mAb to three CV-A6 strains
2.2 双抗体夹心ELISA 方法优化结果 确定包被抗体最佳浓度及酶标抗体最佳工作浓度均为1 ∶8 000。包被条件为4 ℃过夜,封闭液为10% FBS + PBST +5%蔗糖,封闭时间为37 ℃2 h,抗体稀释液为ED-33,酶标抗体作用条件为37 ℃1 h,显色条件为37 ℃10 min。
2.3 方法的验证结果
2.3.1 线性范围 当抗原浓度在11 ~178 ng / mL之间,6 次试验的R2值均在0.992 5 ~0.997 5 之间,斜率在1.298 4 ~1.411 7 之间,表明该试剂盒具有良好的线性,线性范围为11 ~178 ng / mL,定量检出限为11 ng /mL,见表2。
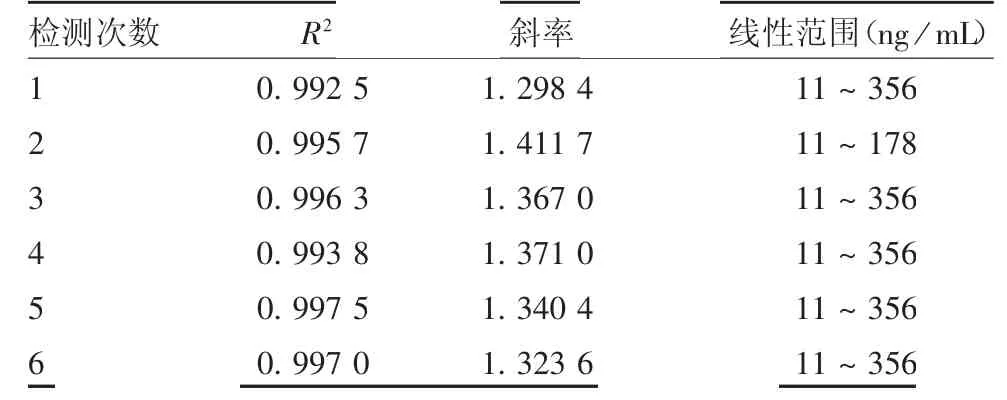
表2 线性范围验证结果Tab.2 Verification for linear range
2.3.2 专属性 阳性对照CV-A6 抗原的S/CO 值为22.48;CV-A10、HAV、EV-A71、CV-A16、MEM、DMEM、FBS 的检测结果均为阴性,其S /CO 值均<1。
2.3.3 准确度 当CV-A6 抗原含量在高、中、低3 个浓度时,回收率均值分别为109.83%、105.06%和97.37%,CV值分别为1.60%、4.07%和5.10%,表明本试剂盒在高、中、低3 个浓度均具有良好的定量准确性,见表3。

表3 准确度验证结果(%)Tab.3 Verification for accuracy(%)
2.3.4 精密度 当CV-A6 抗原含量在高、中、低3 个浓度,试剂盒重复性CV值分别为4.98%、8.22%和10.30%,实验员1 和2 中间精密度CV值分别为7.07%、4.95%和2.17%和6.25%、8.23%和11.50%,均在15%以内,见表4 和表5,表明试剂盒在高、中、低浓度均具有良好的重复性和中间精密度。
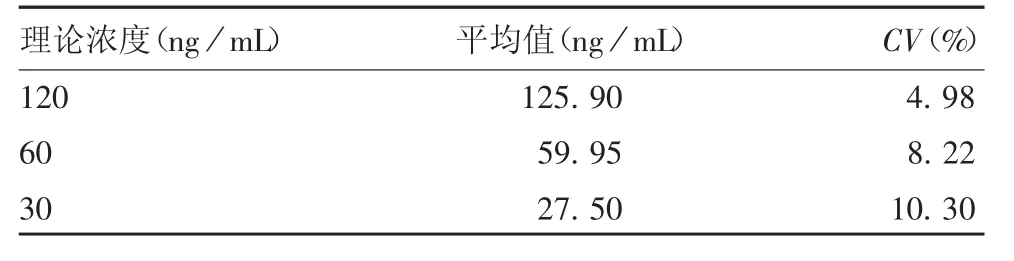
表4 重复性验证结果(n = 6)Tab.4 Verification for reproducibility(n = 6)
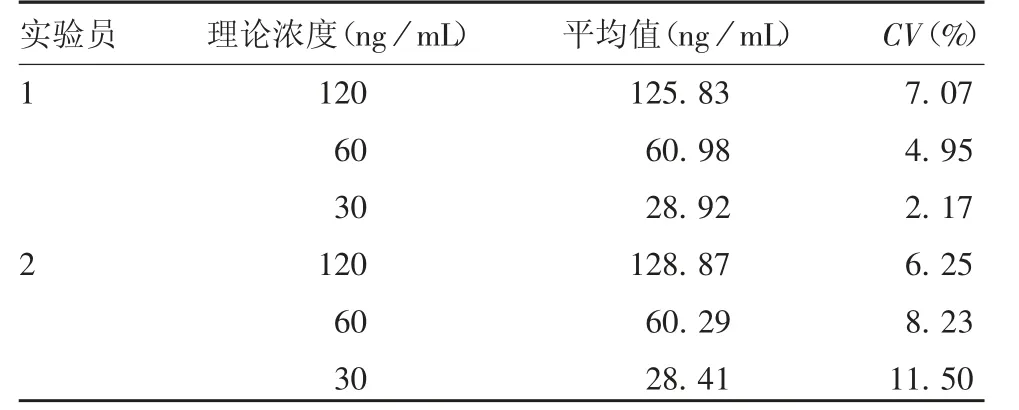
表5 中间精密度验证结果(n = 3)Tab.5 Verification for intermediate precision(n = 3)
2.3.5 耐用性 当CV-A6 抗原含量在高、中、低3个浓度时,检测结果的回收率分别在99% ~107%、87% ~102%和83% ~105%之间,见表6,表明试剂盒耐用性良好。
2.4 适用性 企业1 按其工艺制备的灭活疫苗原液和其中间产物1 ~4,经本试剂盒检测线性、平行性良好,见图1A ~D;企业1 ~4 按各自工艺制备的灭活疫苗原液和VLP 疫苗原液Ag1 ~4,经本试剂盒检测线性、平行性良好,见图1E ~H。表明本试剂盒对以上不同毒株、不同工艺以及不同中间环节的制品均具有良好的适用性。

表6 耐用性验证Tab.6 Verification for durability
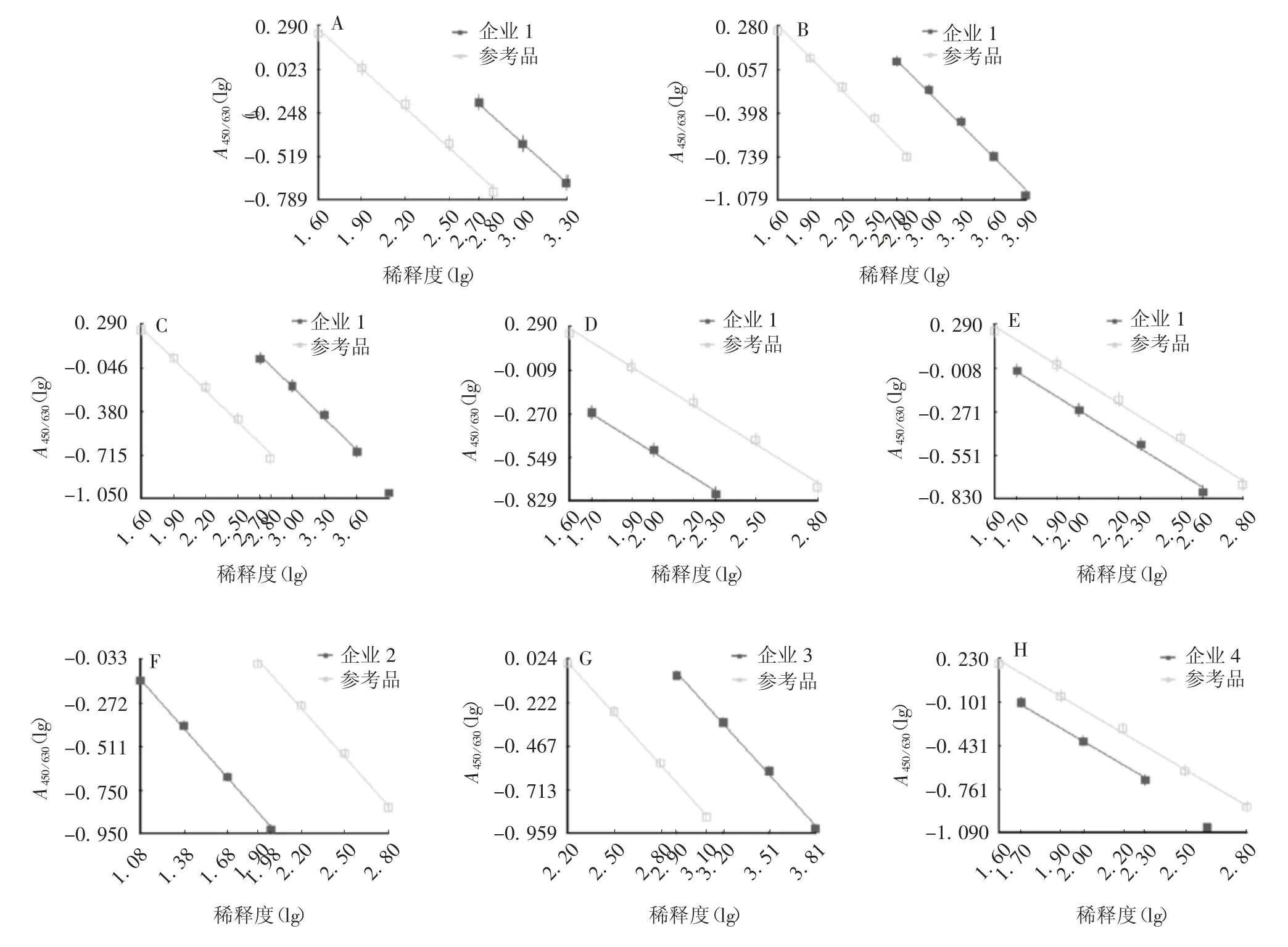
图1 4 家企业各工艺阶段原液适用性研究Fig.1 Suitability of develop kit to bulks from four manufacturers at various steps of production process
3 讨 论
HFMD 是由EV-A71、CV-A16、CV-A6 等20 余种肠道病毒引起的5 岁以下婴幼儿常见传染病,以粪口传播途径为主,全球均有流行。多数患者出现手、足、口部皮疹、疱疹和发热,不需特殊干预,可自愈[23]。但其中部分患者可出现脑炎、心肌炎、弛缓性麻痹、肺炎等重症神经系统症状[2-4,24]。随着我国自主研发的EV-A71 疫苗的上市及应用,我国HFMD死亡人数逐年下降,至2019 年已较疫苗上市前下降了96%[25],EV-A71 的流行得到有效控制。但CV-A6的流行逐渐增强,甚至在部分地区已取代EV-A71成为HFMD 主要病原之一[26-27]。目前已有多家企业开展CV-A6 疫苗和包含CV-A6 在内的HFMD 多价疫苗的研发工作,包括灭活疫苗和VLP 疫苗,均处于临床前研究阶段[18-22]。
疫苗的研发面临诸多瓶颈,其中抗原含量准确定量为疫苗工艺优化、质量一致性评价、疫苗免疫原性和保护效果评价以及疫苗剂量确定的关键指标。在EV-A71 疫苗研发早期,EV-A71 抗原检测试剂盒的建立就得到高度重视,各企业均建立了经验证的检测试剂盒,使得EV-A71 疫苗在研发临床前阶段、临床阶段和上市后,得以持续开展体外效力稳定性监测,有效保证了研发以及上市疫苗的稳定过度,从而保证疫苗的有效性和可靠性。2019 年,由中国食品药品检定研究院和英国国家生物制品检定所共同开展的通用EV-A71 抗原检测试剂盒成功建立,已应用于国际EV-A71 疫苗标准品的国际协作标定研究,并推动第一代国际EV-A71 疫苗标准品于同年获得WHO 批准[28-29],同时有力促进了国际EV-A71疫苗指南的编写和制订工作,为我国独创EV-A71疫苗走入国际奠定了坚实的基础。
为保证CV-A6 疫苗以及HFMD 多价疫苗的顺利研发,早期开展CV-A6 抗原检测试剂盒的研制,尤其是特异性好、定量准确、与体内效力相关的通用CV-A6 抗原检测试剂盒具有重要意义。用多克隆抗体-单克隆抗体建立的双抗体夹心ELISA 体系,由于多克隆抗体的广谱性,以及单克隆抗体的高特异性和高亲和力,是抗原定量检测的常用手段。其中,单克隆抗体的性质往往决定了检测试剂盒的特性,因此单克隆抗体的筛选被认为是检测试剂盒建立的核心环节。本研究从6 株单克隆抗体中筛选出1 株对分属于2 个基因型的3 个病毒株均具有高效价中和能力(中和效价均>16 384),且对4 个毒株均具有广谱、高效结合作用的单克隆抗体,建立了CV-A6 抗原定量检测试剂盒。经验证,该试剂盒特异性良好,对同源性最高的CV-A10、HAV、EV-A71、CV-A16 均无交叉反应,定量准确性良好,灵敏度、精密度、专属性、耐用性均符合《中国药典》四部(2020 版)相关规定。将该检测试剂盒分发给4 个企业,各企业采用该试剂盒对各自制备的疫苗原液以及中间环节制品进行检测,平行性与线性均良好。表明该试剂盒对不同企业采用不同毒株和工艺制备的CV-A6 疫苗表现出广谱适用性,且满足疫苗生产环节中各阶段制品中抗原含量的准确定量的需求。
综上所述,本研究选择具有高效价、广谱中和活性的单克隆抗体和多克隆抗体建立了双抗体夹心ELISA 法CV-A6 疫苗抗原定量检测试剂盒,适用性研究证实,该试剂盒对不同企业制备的CV-A6 疫苗原液以及不同制备工艺环节的阶段样品均具有良好的适用性,可应用于CV-A6 疫苗研发和质量评价。下阶段我们将进一步应用该试剂盒开展体内和体外效力相关性研究,并开展CV-A6 抗原定量标准品研制,为建立标准化CV-A6 抗原检测工具,促进CV-A6 疫苗以及HFMD 多价疫苗研发顺利开展奠定基础。
