二十二碳六烯酸诱导小鼠宫颈癌相关肿瘤细胞免疫原性死亡的作用
2021-03-20陈永俊孙文佳何金蓉马雁冰
陈永俊,孙文佳,何金蓉,马雁冰
中国医学科学院北京协和医学院医学生物学研究所,云南昆明650000
据2018 年世界卫生组织发布的数据显示,全球每10 万人中,即有3 人患宫颈癌,而每10 万死亡人数中,即有7 人是由于宫颈癌而死亡;在56.9 万例新发宫颈癌中,约84%出现在经济欠发达国家[1]。随着人乳头瘤状病毒(human papillomavirus,HPV)疫苗的应用,宫颈癌的发病率和死亡率明显下降,但由于预防性疫苗对已建立的持续感染及肿瘤无显著效果,以及接种率、接种人群、保护面等的影响,仍存在大量由于HPV 感染而患宫颈癌的人群。免疫治疗在宫颈癌治疗中具有广阔的应用前景。肿瘤免疫治疗通常通过激活人体内杀伤肿瘤的免疫细胞以及调控肿瘤营造的免疫环境而达到治疗目的。在肿瘤免疫治疗中存在以下难题:肿瘤的高突变引起的异质性和低免疫原性,以及肿瘤细胞、免疫抑制细胞和其他人体细胞构成的免疫抑制微环境,显著制约免疫细胞的产生及其对肿瘤细胞的识别与杀伤,从而促进肿瘤的发生发展,解决这两个难题成为肿瘤免疫治疗的关键[2]。
免疫原性细胞死亡(immunogenic cell death,ICD)指细胞在死亡过程中会释放细胞内的ATP、钙网蛋白、热休克蛋白70(heat shock protein 70,HSP70)和高迁移率簇蛋白1(high mobility group box protein B1,HMGB1)等,起到“发现我”、“吃我”的信号作用,趋化并激活免疫细胞,从而达到抵抗病原体的作用[3]。最近有文献报道,部分化疗药物能引起肿瘤细胞发生ICD,协同扩大肿瘤的治疗效果,如奥沙利铂、米托蒽醌、和多柔比星等[4],但化疗药物在使用过程中通常具有明显的副作用,会出现血细胞减少症状、代谢毒性等问题[5];同时,要在体内诱导免疫原性焦亡往往需要更高的剂量,因此,筛选能够有效诱导肿瘤发生ICD 的低毒性药物是近几年癌症治疗的研究方向之一。
焦亡是新型的ICD 方式,其首次报道是在弗氏志贺菌感染的巨噬细胞中,其特征是细胞膜打孔膨胀,出现空泡状细胞形态,在细胞膜破裂前,会释放很多焦亡小体、胞内物质和炎症因子[6]。已有研究显示,二十二碳六烯酸(docosahexaenoic acid,DHA)、花青素和二甲双胍作为肿瘤治疗的潜在药物,能诱导部分肿瘤细胞出现焦亡形式的ICD,起到抑制肿瘤增殖的作用,如在三阴性乳腺癌中,DHA 能诱导MDA-MB-231 细胞出现焦亡,并释放大量的炎症因子[7];二甲双胍能激活人乳腺癌细胞MCF-7 和结直肠癌细胞HT-29 中的GSDME 切割,诱导炎症,抑制细胞增殖[8];花青素为一种天然的水溶性色素,具有抗氧化特性,能诱导口部鳞状细胞癌出现焦亡性死亡[9]。上述研究表明,二甲双胍、花青素及DHA 具有诱导肿瘤ICD 的治疗潜力。
本研究使用不同药物处理小鼠宫颈癌TC-1 细胞,筛选出能有效诱导ICD 的药物,并根据其药物毒力动力学特征优化策略,为进一步开展肿瘤细胞焦亡研究,以及基于小鼠肿瘤模型开展以诱导焦亡的纳米化药物及ICD 细胞疫苗进行免疫治疗研究奠定基础。
1 材料与方法
1.1 细胞 小鼠宫颈癌TC-1 细胞由中国医学科学院医学生物学研究所分子免疫实验室保存。
1.2 主要试剂 RPMI1640 培养基购自以色列biologicalindustrial 公司;胎牛血清(FBS)购自美国Gibco公司;ECL 化学发光底物、IL-1β、IL-6、TNF-αELISA试剂盒购自美国ThermoFisher Scientific 公司;RIPA细胞裂解液购自北京索莱宝科技有限公司;甲醇等购自西陇化工股份有限公司;DHA 购自美国MCE公司;花青素购自中国维克奇生物科技公司;二甲双胍购自北京索莱宝科技有限公司;小鼠抗β-actin 单克隆抗体、兔抗LC3b 多克隆抗体抗体以及HRP 标记的山羊抗兔和抗鼠IgG 均购自英国Abcam 公司;ATP 检测试剂盒和LDH 检测试剂盒购自中国碧云天生物技术公司公司。
1.3 细胞培养 用含10% FBS、100 U / mL 青霉素和0.1 mg/L 链霉素的RPMI1640 培养基培养TC-1 细胞。
1.4 花青素、二甲双胍和D H A 对T C-1 细胞毒性的检测 将TC-1 细胞按5 × 104个/ 孔接种12 孔板,1 mL / 孔,过夜培养后,用20 mmol / L 二甲双胍处理TC-1 细胞33 h[8],2 mg / mL 花青素处理TC-1 细胞23 h[9],100 μmol / L DHA 处理TC-1 细胞23 h、200 μmol / L DHA 处理TC-1 细胞4 h[10],以不加药物的细胞作为对照。显微镜观察不同药物处理后的细胞形态。
1.5 不同剂量D H A 对T C-1 细胞死亡影响的检测 将TC-1 细胞按5 × 104个/ 孔接种12 孔板,1 mL / 孔,过夜培养后,用不同浓度DHA(0、40、80、120、160、200 μmol / L)处理TC-1 细胞8 h,显微镜观察细胞死亡情况,并检测LDH 释放率。试验重复3 次。
1.6 D H A 处理不同时间对T C-1 细胞死亡影响的检测 将TC-1 细胞按5 × 104个/ 孔接种12 孔板,1 mL / 孔,过夜培养后,根据1.5 项试验结果,用160 μmol / L DHA 处理TC-1 细胞不同时间(4、6、8、10、12 h),显微镜观察细胞死亡情况,并检测LDH释放率。试验重复3 次。
1.7 D H A 诱导T C-1 细胞IC D 的检测 将TC-1 细胞按5 × 104个/ 孔接种12 孔板,1 mL / 孔,过夜培养后,用不同浓度DHA(0、80、120、160、200 μmol / L)处理TC-1 细胞8 h,再用160 μmol/L DHA 处理TC-1细胞不同时间(0、4、8、12 h),检测细胞培养上清中ATP 释放量。另用160 μmol / L DHA 处理TC-1 细胞6 和12 h,检测细胞培养上清中细胞因子IL-6、IL-1茁、TNF-α 的含量。试验重复3 次。
1.8 LD H 检测 收样前1 h,在阳性孔中加入10%乳酸脱氢酶释放剂,取上清,400 ×g离心5 min,取120 μL 加入96 孔板,再加入60 μL 检测工作液(乳酸溶液、酶溶液、INT 溶液按体积比1 ∶1 ∶1 混匀),反应5 min,在酶标仪波长490、620 nm 处测定吸光度值,并按下式计算细胞死亡率。
细胞死亡率(%)=(处理样品吸光度值- 培养基吸光度值)/(细胞最大酶活性的吸光度值- 样品对照孔吸光度值)×100%
1.9 A T P 检测 细胞培养上清经4 ℃,12 000 ×g离心5 min,取上清置于4 ℃。配置10 μmol / L、5 μmol / L、1 μmol / L、0.5 μmol / L、0.1 μmol / L、1 nmol / L 的ATP 标准液,在96 孔板中加入100 μL稀释好的ATP 检测工作液,室温放置5 min,再加入20 μL 样品和标准品,反应5 min 后,在化学发光检测仪上检测。
1.10 细胞因子检测 采用夹心ELISA 法。用捕获抗体(1 ∶250 稀释)包被96 孔板,100 μL / 孔,置于湿盒中4 ℃过夜;用洗液(PBST,含0.5‰吐温-20的PBS)洗涤3 次,每次2 min,用200 μL ELISA /ELISPOT Diluent(1 ×)室温封闭1 h;至少洗涤1 次,加入经DHA 处理的细胞上清和倍比稀释的标准品,室温放置2 h;洗涤3 次,加入检测抗体(1 ∶250稀释),室温孵育2 h;洗涤5 次,加入HRP 标记的Streptavidin(1 ∶100 稀释),室温孵育30 min;洗涤7次,加入TMB 溶液,室温避光反应15 min,加入终止液(2 N H2SO4),在酶标仪波长450 和620 nm 处测定吸光度值。试验重复3 次。
1.11 D H A 诱导T C-1 细胞自噬的检测 有文献报道,DHA 会诱导细胞的自噬[11]和焦亡,本研究对不同浓度DHA 处理的TC-1 细胞进行Western blot 检测,以了解DHA 诱导肿瘤细胞死亡的可能形式。将TC-1 细胞按1 × 106个/孔接种6 孔板,培养1 d 后,用不同浓度的DHA(0、40、80、120、160、200 μmol/L)处理5 h。收集细胞和上清,用PBS 清洗细胞3 次,用体积为60 μL 含10 μg /mL 蛋白酶抑制剂和磷酸化酶抑制剂的RIPA 细胞裂解液裂解细胞,冰浴30 min,期间反复吹打细胞提取总蛋白,4 ℃,13 800 ×g离心15 min,吸取上清液,BCA 法测定蛋白浓度,取10 μg,经12% SDS-PAGE 分离后,半干法转移至PVDF 膜上,加入50 mL 5%脱脂奶,室温封闭2 h;分别加入LC3b(1 ∶1 000 稀释)、茁-actin(1 ∶3 000稀释)抗体,4 ℃孵育过夜;1 × TBST 清洗3 次,每次10 min,加入HRP 标记的山羊抗兔及抗鼠IgG(均1 ∶5 000 稀释),室温孵育2 h;1 × TBST 清洗3 次,每次10 min,使用ECL 化学发光显色液进行显色,成像并拍摄照片,用ImageJ 测定灰度值。试验重复3 次。
1.12 统计学分析 应用GraphPadPrism 进行数据的整理、分析及作图。组间比较采用非配对t检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 花青素、二甲双胍和D H A 对T C-1 细胞的毒性显微镜下观察显示,经20 mmol / L 二甲双胍处理的TC-1 细胞与对照组相比增殖减缓,且发生细胞死亡,见图1;经2 mg / mL 花青素处理23 h 的TC-1细胞与对照组相比,呈现明显的死亡情况,且也具有细胞焦亡的胞膜膨胀形状,见图2;经200 μmol / L DHA 处理4 h 的TC-1 细胞出现大量细胞死亡,且死亡的细胞具有焦亡的特征,而经100 μmol / L DHA处理23 h 的细胞仅状态不佳,见图3。根据不同药物处理细胞后的死亡形态、细胞死亡率和药物成本,本研究以DHA 作为主要研究对象,探究其对TC-1细胞特性的影响。
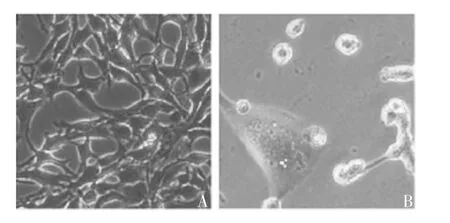
图1 显微镜观察二甲双胍对TC-1 细胞的毒性(× 400)Fig.1 Microscopy of toxicity of metformin to TC-1 cells(× 400)

图2 显微镜观察花青素对TC-1 细胞的毒性(× 400)Fig.2 Microscopy of toxicity of anthocyanins to TC-1 cells(× 400)
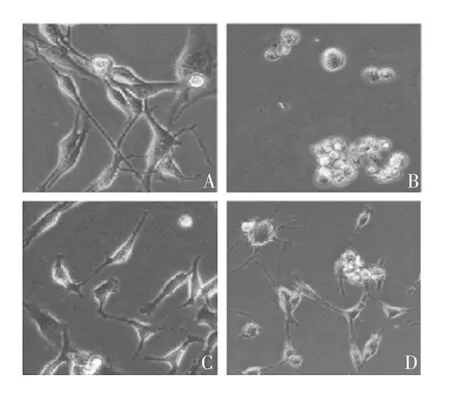
图3 显微镜观察DHA 对TC-1 细胞的毒性(× 400)Fig.3 Microscopy of toxicity of DHA to TC-1 cells(× 400)
2.2 不同剂量D H A 对T C-1 细胞死亡的影响 显微镜下观察显示,随着DHA 浓度的增加,TC-1 细胞的状态越差,经160 和200 μmol / LDHA 处理后,出现大量悬浮死亡的细胞,见图4。LDH 释放检测结果显示,DHA 对TC-1 细胞具有剂量依赖性地诱导细胞死亡作用(P <0.05),见图5。
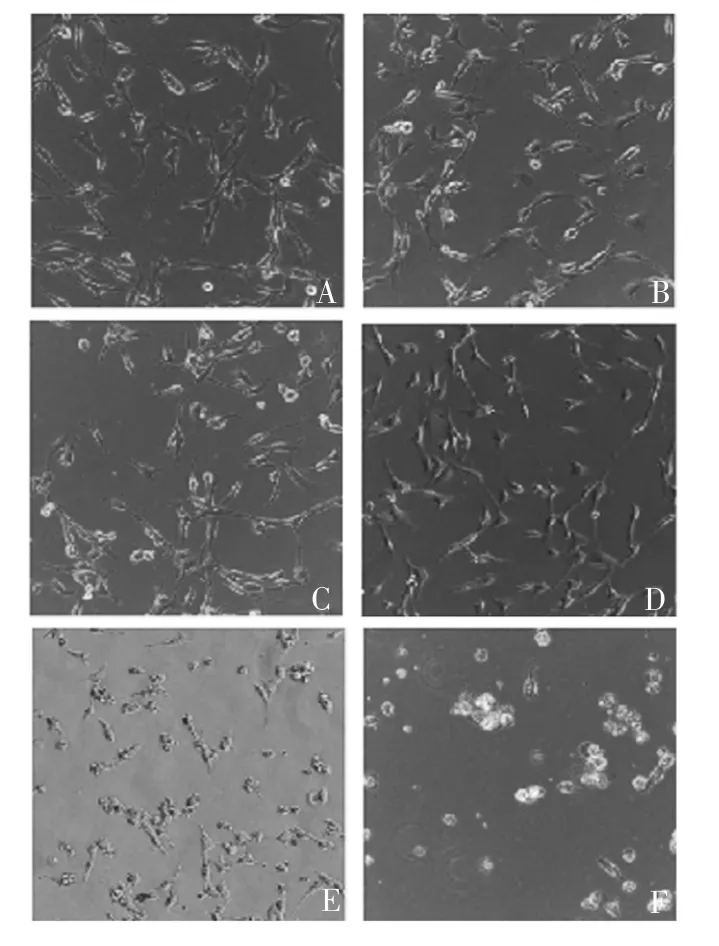
图4 显微镜观察不同浓度DHA 对TC-1 细胞死亡的影响(× 400)Fig.4 Microscopy of effect of different concentrations of DHA on death of TC-1 cells(× 400)
2.3 D H A 处理不同时间对T C-1 细胞死亡的影响 显微镜下观察显示,经160 μmol / L DHA 处理的TC-1细胞随着处理时间的延长,细胞死亡率也逐渐增加,6 h 时,TC-1 细胞出现死亡情况,处理12 h 的细胞呈现明显的细胞焦亡形态特征,见图6。LDH 释放检测结果显示,随着DHA 处理时间的延长,与对照组相比,细胞死亡率明显增加(P <0.05),见图7。
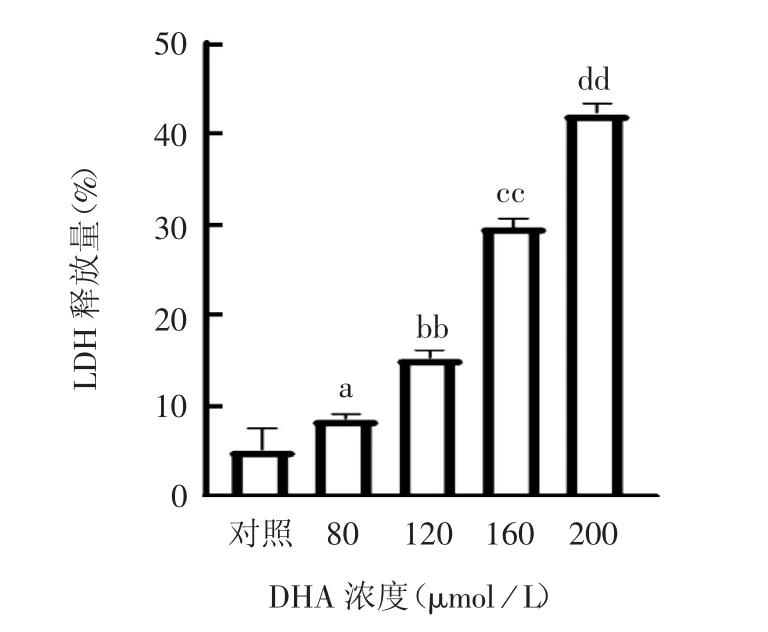
图5 不同浓度DHA 对TC-1 细胞LDH 释放的影响Fig.5 Effect of different concentrations of DHA on release of LDH from TC-1 cells
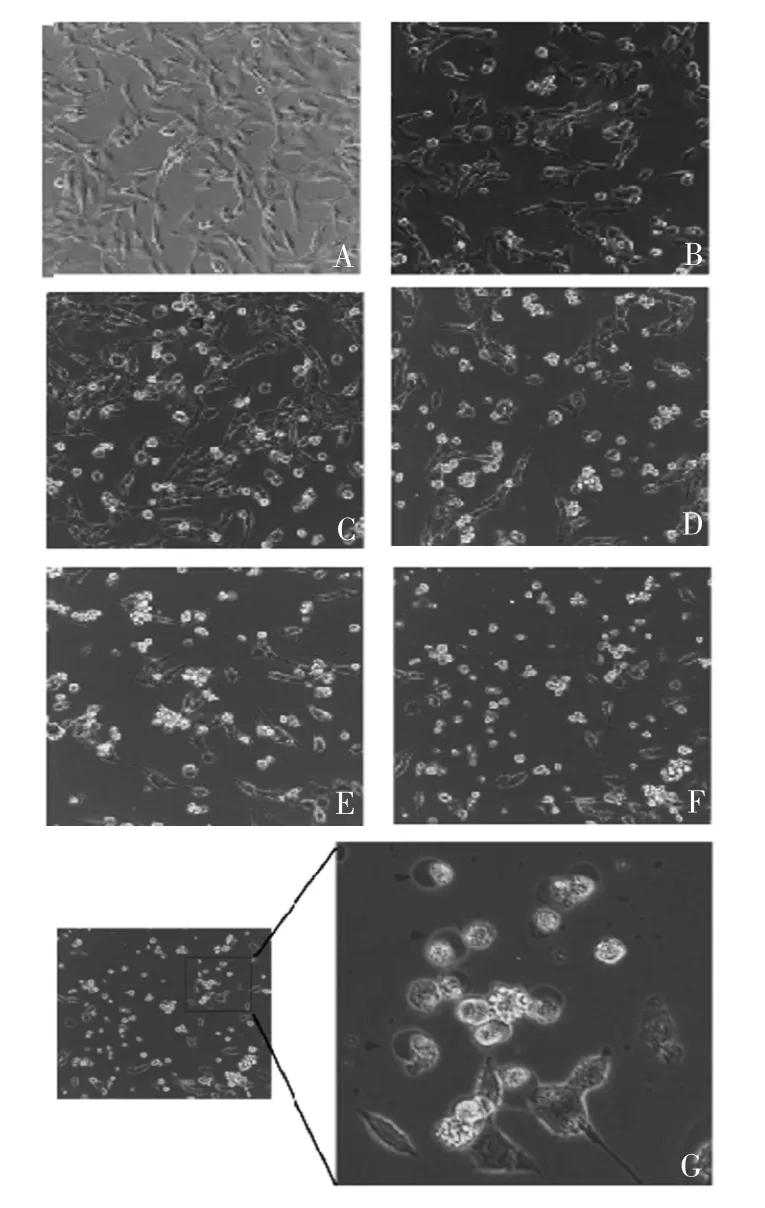
图6 显微镜观察DHA 处理不同时间对TC-1 细胞死亡的影响(× 400)Fig.6 Microscopy of effect of DHA treatment on death of TC-1 cells for different time durations(× 400)

图7 DHA 处理不同时间对TC-1 细胞LDH 释放的影响Fig.7 Effect of DHA treatment for different time durations on release of LDH from TC-1 cells
2.4 D H A 诱导T C-1 细胞的IC D 经不同浓度DHA处理8 h,TC-1 细胞释放了更多的ATP,且160 μmol/L DHA 处理组的细胞释放量更高(P<0.05);经160μmol/L DHA 处理4 h,细胞上清中的ATP 升至最高,随后下降,但均高于未处理组(P <0.05)。见图8。经160 μmol / L DHA 处理后的TC-1 细胞与未处理组相比,其IL-6、IL-1β、TNF-α 的分泌量显著升高(P <0.05),见图9。综合以上结果,表明DHA 能够诱导TC-1 细胞ICD。
2.5 D H A 诱导T C-1 细胞的自噬 经DHA 处理后的TC-1 细胞其LC3bⅡ与Ⅰ型比例升高,见图10 和图11。表明DHA 能够有效诱导TC-1 细胞提高自噬相关蛋白的表达。
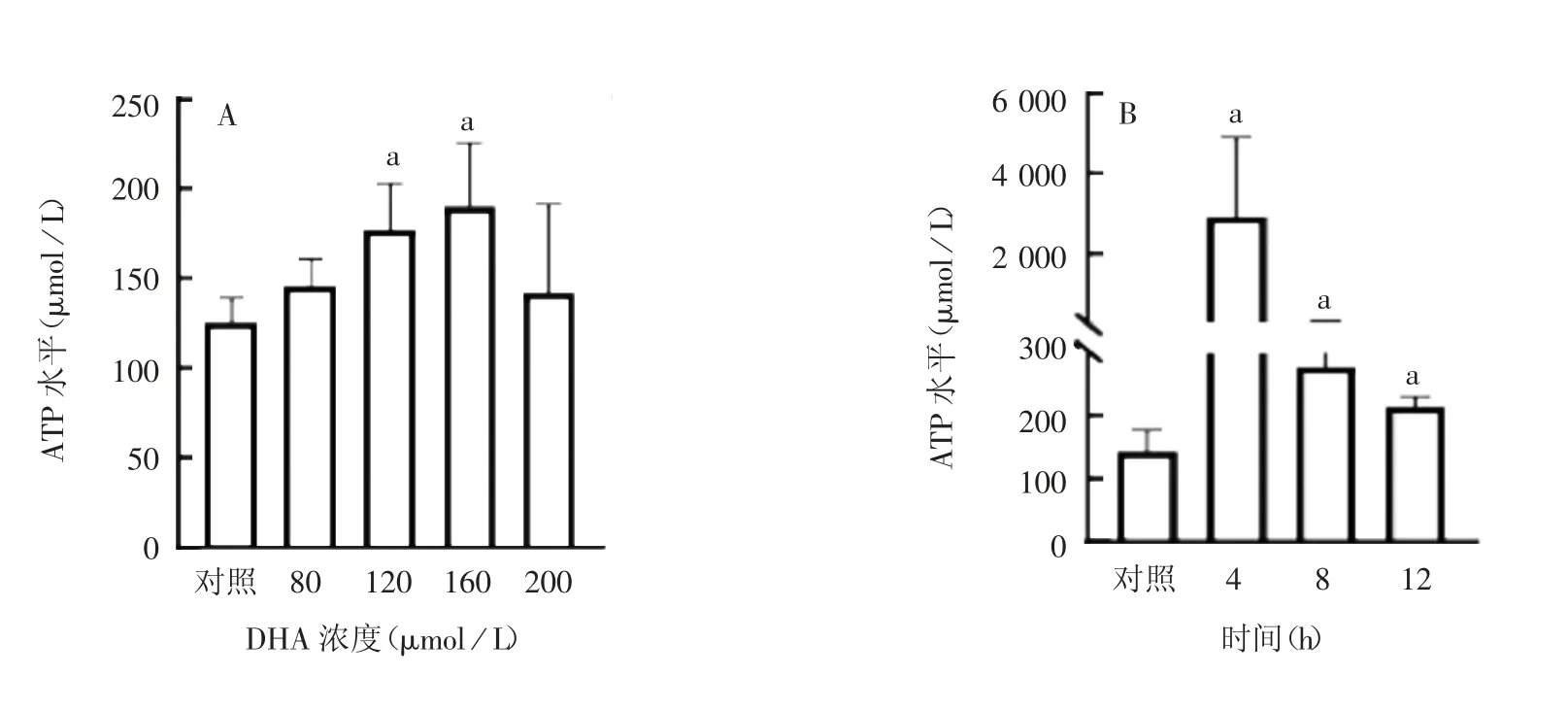
图8 DHA 诱导TC-1 细胞释放ATP 的情况Fig.8 Induction of ATP release from TC-1 cells by DHA
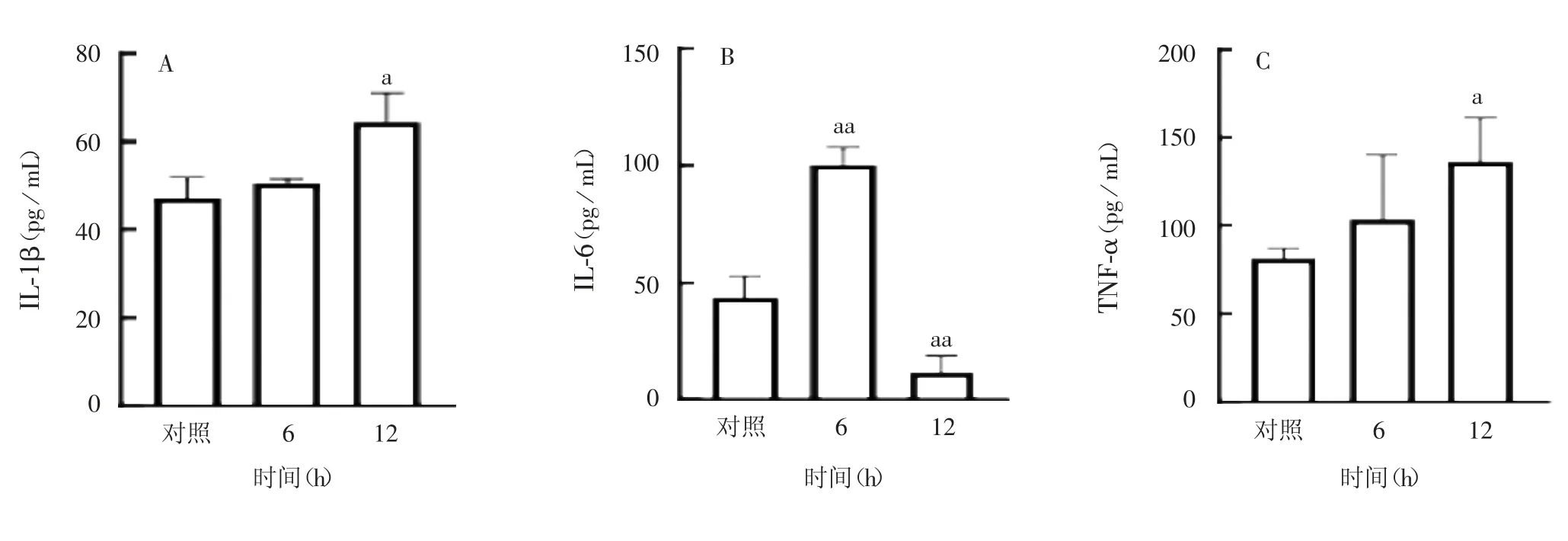
图9 DHA 诱导TC-1 释放炎症因子IL-1β、IL-6、TNF-α 的情况Fig.9 Induction of releases of inflammatory factors IL-1β,IL-6 and TNF-α from TC-1 by DHA

图10 Western blot 分析不同浓度DHA 处理5 h TC-1 细胞LC3bⅡ的表达情况Fig.10 Western blotting of expression of LC3bⅡin TC-1 cells treated with different concentrations of DHA for 5 h
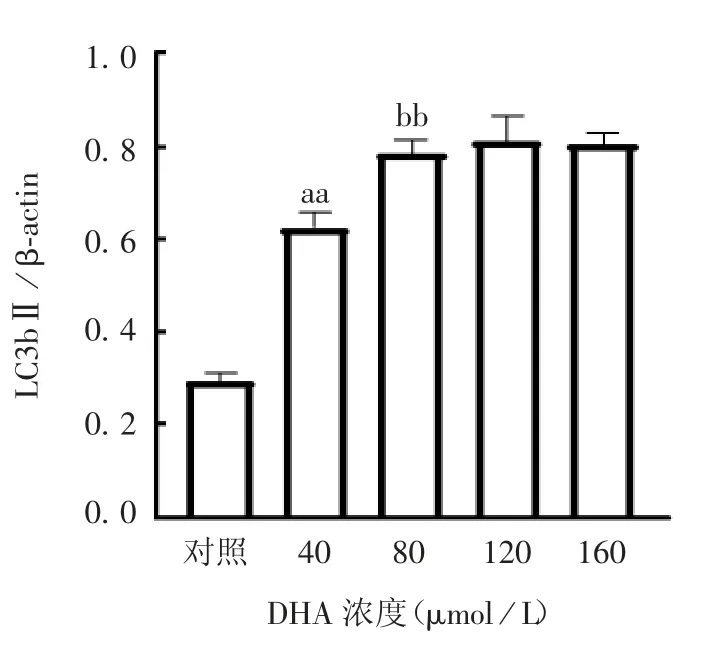
图11 不同浓度DHA 处理5 h TC-1 细胞LC3bⅡ的表达情况Fig.11 Expression of LC3b Ⅱin TC-1 cells treated with different concentrations of DHA for 5 h
3 讨 论
目前癌症的主要临床治疗手段仍为手术切割、化疗、放疗等,而免疫疗法具有广阔的发展前景。嵌合抗原受体T 细胞疗法(cChimeric antigen receptorsmodified T cells,CAR-T)和免疫检查点疗法的出现,给癌症的免疫治疗带来了希望,但仍受到明显的限制,如肿瘤类型、个体应答情况及可能的副作用等。近年来发现,一些化疗药物能引起癌细胞发生ICD,激发机体免疫,增强治疗效果,如何有目的的安全而高效地诱导肿瘤细胞ICD,并充分利用其特征实现有效肿瘤治疗成为新的研究方向,因此,探讨低毒性、可诱导癌细胞ICD 的药物,摸索其优化诱导策略,研究ICD 的死亡动力学与免疫应答特征,对于有效利用肿瘤细胞ICD 达到治疗目的具有重要意义。
DHA 是Omega-3 不饱和脂肪酸家族中的重要成员,是身体发育必要的营养成分,具有抑制机体炎症、抗氧化的作用。在细胞实验水平,已有研究发现DHA 对癌细胞可能具有较好的靶向毒性作用[12];同时,也有小鼠模型研究报道,利用DHA 和二甲双胍制备纳米药物,抑制了4T1 乳腺癌的肺转移[13]。焦亡是新的细胞ICD 方式,本课题组拟基于诱导肿瘤细胞焦亡,探讨有效的肿瘤免疫治疗策略,如纳米化药物靶向递送焦亡诱导剂,以及利用焦亡的肿瘤细胞作为疫苗激发机体抗肿瘤免疫应答等。而这些研究的重要基础是如何诱导肿瘤细胞的焦亡。本研究用二甲双胍、花青素和DHA 分别对宫颈癌相关细胞TC-1 进行体外诱导处理,发现花青素和DHA 能有效刺激细胞出现空泡的焦亡形态,但花青素所需成本较高。在用DHA 体外诱导TC-1 细胞死亡的过程中,重点考察了诱导物浓度效应及死亡进程的时间特征;此外,对DHA 诱导的TC-1 细胞进行LC3b 检测发现,DHA 能诱导TC-1 细胞提高自噬,并释放了大量的炎症因子及ICD 的相关分子ATP,结合其“细胞溶胀”这一典型的焦亡形态特征,提示DHA 诱导了TC-1 细胞的免疫原性焦亡。
综上所述,本研究初步确定了DHA 诱导TC-1细胞ICD 的优化条件,并了解了基本特征,为相关研究的进一步开展奠定了基础。
