鹅源巴氏杆菌的分离鉴定及体外抑菌试验
2021-03-20周亚南文东旭区海蕴高蕊刘雨星李欢黄靖文朱芝秀
周亚南,文东旭,区海蕴,高蕊,刘雨星,李欢,黄靖文,朱芝秀
(江西农业大学动物科学技术学院,江西南昌330045)
鹅巴氏杆菌病又叫做鹅出血性败血症,是由于感染多杀性巴氏杆菌而引起的一种急性、接触性、败血性传染病[1]。该病主要症状包括急性败血症以及全身各组织器官出血,肝组织肿胀凝固性坏死灶,伴发明显的下痢等,是目前危害禽类养殖业的多种严重疫病中的主要疾病之一,给养禽业带来了非常大的损失[2]。鹅可发生外源性感染和自体感染,外源性感染主要指的是通过采食污染巴氏杆菌的饮水或者饲料引起,自体感染则因动物上呼吸道巴氏杆菌数量急剧增加所致[3]。
多杀性巴氏杆菌是多种动物都易感共患的一种毒力较强的病原菌,在添加了哺乳动物血清或血液的培养基上可以生长良好[4~5]。本试验通过对患病鹅心脏、肝脏进行病原菌分离鉴定及体外抑菌等试验,给临床上该病的诊治提供相应数据及有效的方法,进一步促进健康、科学养鹅的发展。
1 材料及方法
1.1 病料及试验动物
病鹅:2 只,江西省南昌市某鹅场提供;试验小白鼠:25 只,18~22 g/只,购于南昌大学实验动物室。
1.2 主要试剂及仪器
主要试剂有:5%兔血琼脂培养基(自制)、瑞氏染色液(自制)、革兰氏染色液(自制)、细菌微量生化鉴定管购自杭州微生物试剂有限公司;药敏纸片购自杭州微生物试剂有限公司;鸡唾液乳酸杆菌(J2-100-R2) 由江西农业大学动物科学技术学院预防兽医教研室保存并提供;猪小肠乳酸杆菌(ZCR1-2)由江西农业大学动物科学技术学院预防兽医教研室保存并提供。
主要仪器有:牛津杯购自上海申源科学仪器有限公司;COCI 光学显微镜购自重庆光学仪器厂;电子数显游标卡尺购自上海美耐特旗舰店;PCR 仪购自Bio-Rad 公司;电泳仪购自Bio-Rad 公司;凝胶成像系统购自Bio-Rad 公司。
1.3 临床剖检
将病死的鹅在新洁尔灭消毒液中浸泡表面消毒后,腹部朝上置于解剖盘中,将下腹部皮肤提起剪开一小口,沿开口处撕开皮肤,观察胸腹部皮下与肌肉出血状况,打开胸腹腔,观察胸腹腔脏器病变状况;剪开颈部皮肤,观察颈部皮下与肌肉出血状况,从肋骨处向上剪开颈部,观察食管与气管环出血状况,从食管处往下依次剪开所有消化道,观察其黏膜病变状况同内容物的性质。取肝组织触片瑞氏染色,干燥镜检。
1.4 细菌分离培养
无菌取患病鹅的肝脏组织与心脏组织接种于5%兔血琼脂培养基上,置于37 ℃恒温培养箱培养24 h,无菌挑选单个优势菌落,进行革兰氏染色境检,并接种于5%兔血琼脂培养基中进行纯化培养,37 ℃恒温培养箱培养24 h,纯培养物置于4 ℃冰箱保存备用。
1.5 细菌生化鉴定
取分离菌纯培养物,接种于微量生化鉴定管,置于37 ℃恒温培养24 ~48 h,观察并对照《伯杰细菌鉴定手册》判定反应结果。
1.6 细菌16S rRNA 基因序列分析
参照文献方法[6],采用细菌16S rRNA 通用引物,27F:5'-AGAGTTTGATCCTGGCTCAG-3',1492R:5'-GGTTACCTTGTTACGACTT-3',引物由湖南擎科生物技术有限公司合成,目的片段1 500 bp 左右。将分离菌进行PCR 扩增,取2 μL 纯培养菌液为模板,PCR 反应体系 50 μL:ddH2O 37.5 μL、dNTP 4 μL、10X Buffer 5 μL、Taq 酶 0.5 μL、上下游引物各 0.5 μL 以及模板 2 μL。反应条件:95 ℃预变性5 min,95 ℃变性 1 min,55 ℃退火 1 min,72 ℃延伸2 min,共进行 35 个循环;72 ℃延伸 8 min。取 5 μL PCR 产物在1%琼脂糖凝胶上进行电泳分析;剩余的PCR 产物送到湖南擎科生物技术有限公司测序,将测序结果在NCBI 数据库中进行BLAST 同源性比对。选取同源性较高菌株的16S rRNA 基因序列, 应用Mega 7.0 软件中的NJ 方法构建系统进化树。
1.7 分离菌药敏试验
参照参考文献进行药敏试验[7],用灭菌棉签沾取活化的分离菌培养液,均匀涂布于5%兔血平板,用无菌眼科镊将药片均匀放置其上,轻按纸片使其与琼脂表完全接触,置于37 ℃恒温温箱培养24 h,记录各药敏纸片的抑菌圈直径大小。
1.8 体外抑制试验
按照参考文献[7],将分离菌血清肉汤培养物均匀涂布5%兔血培养基,培养基上等距离放置2 个牛津杯,牛津杯内分别滴加J2-100-R2 菌液和ZCR1-2 菌液,每孔 280 μL 菌液,置于 4 ℃冰箱过夜后,置于37 ℃恒温温箱培养24 h,测量并记录抑菌圈直径大小。
1.9 动物回归试验
将试验小鼠随机分为4 组试验组,1 组对照组(5 只/组)。试验组分别腹腔注射分离菌血清肉汤培养物(0.1 mL/只),对照组注射等量的0.85%生理盐水,做好标记后放入鼠笼中,时刻观察并记录动物的发病死亡情况,及时剖检死亡的实验动物,取肝脏处组织触片瑞氏染色,分离培养细菌。
2 结果与分析
2.1 临床剖检
死亡白鹅头颈呈反弓状(图1);剖检后可见病鹅多处皮下与肌肉出血;在其肝脏可见大量白色坏死灶(图2);剖开胸腔可见心冠脂肪有大量出血斑(图 3),心包大量积液(图 4),气管环出血(图 5),肺部多处出血,喉头处水肿,肠道弥漫性出血(图6),内容物呈绿色稀状,。取其肝脏组织触片后瑞氏染色,油镜下可见大量两端浓染的椭圆形杆菌(图 7)。
2.2 细菌分离培养
血清平板有大量单个光滑、湿润,圆形、凸起的小菌落,在灯光下观察泛蓝色荧光(图8);血平板上生长成灰白色、湿润、粘黏的1 mm 左右的圆形不溶血菌落(图9);麦康凯琼脂平板上不能生长。分离菌分别命名为 BE-X-1、BE-X-2、BE-G-1、BE-G-2,经革兰氏染色镜检,均呈革兰氏阴性小球杆状(图 10)。
2.3 细菌生化鉴定
生化鉴定结果见表1,分离菌分解甘露醇、葡萄糖产酸,但却不能分解乳糖,与《伯杰细菌鉴定手册》对照,可能是巴氏杆菌属。

图1 角弓反张
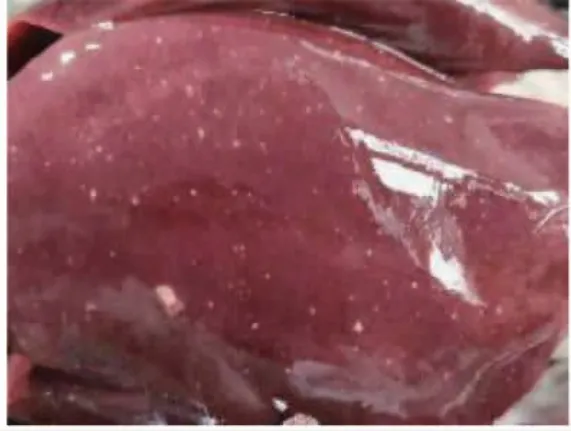
图2 肝脏坏死点
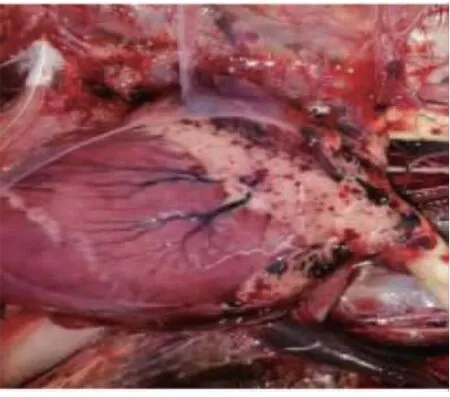
图3 心冠脂肪出血斑
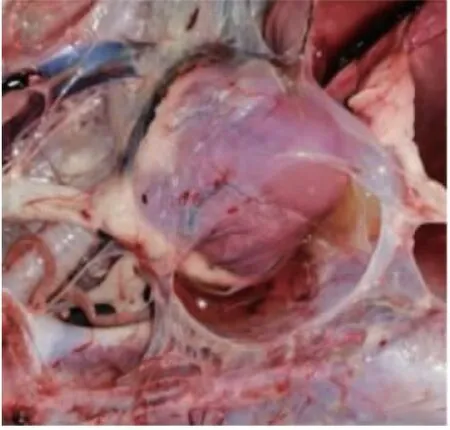
图4 心包积液
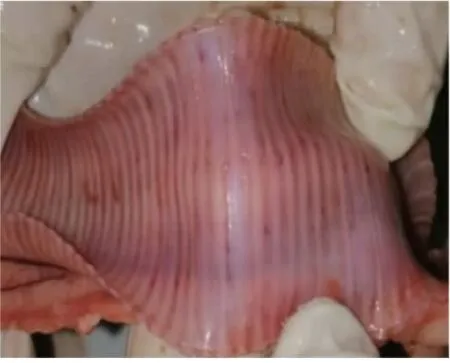
图5 气管环出血
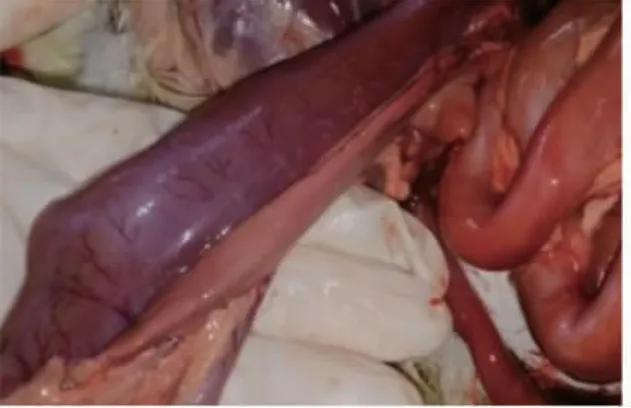
图6 肠道弥漫性出血

图7 瑞氏染色(10 ×100)

图8 血清平板上的菌落
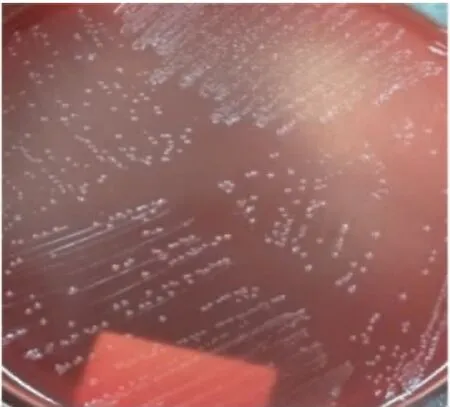
图9 血平板上的菌落

图10 革兰氏染色镜检(10×100)

表1 4 株分离菌生化结果
2.4 细菌16S rRNA 基因序列分析
分离菌的PCR 产物在琼脂糖凝胶上电泳结果,在1 400 bp 处有目的条带出现(图11)。将测序结果与 GenBank 数据库进行 BLAST 比对(图 12),4 株分离菌与多杀性巴氏杆菌 (GenBank 登录号:MN080875.1) 相似性分别达到99%以上。采用MEGA7.0.26 软件中的Neighbor-Joining Tree 程序制作分离菌基因序列进化树 (图13),结果BE-X-1、BE-X-2、BE-G-1、BE-G-2 与多杀性巴氏杆菌为一支。

图11 分离菌电泳结果

图12 分离菌16S rDNA 核苷酸同源性

图13 分离菌16S rDNA 序列进化树
2.5 药敏试验结果
药敏试验结果见表2,分离菌的高敏药物有阿莫西林等;对万古霉素等药物中等敏感;低敏药物有乙酰螺旋霉素等。

表2 药敏试验结果 mm
2.6 乳酸菌体外抑制试验结果
结果见表3:鸡唾液乳杆菌、猪小肠乳杆菌发酵液具有抑菌效果,其中鸡唾液乳杆菌效果更佳。
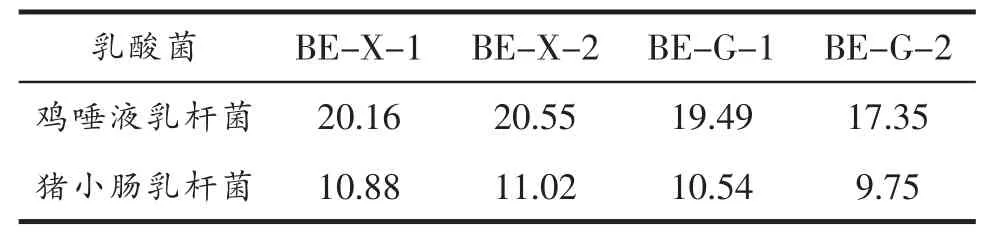
表3 体外抑菌试验结果 mm
2.7 动物回归试验
12 ~24 h 内攻毒小白鼠全部死亡,对照组小白鼠活泼健康。从试验死亡鼠中分离病原菌、染色镜检,发现所分离的细菌与原分离株形态一致,瑞氏染色呈两端浓染,革兰氏染色呈阴性短杆菌。
3 讨论
根据临床剖检所见病理学特征、病原菌的分离培养特性以及生化特性等,初步诊断分离菌为巴氏杆菌。使用分子生物学法鉴定后,确定该分离菌为多杀性巴氏杆菌,该鹅所患疾病是由多杀性巴氏杆菌引起的鹅巴氏杆菌病。
将分离菌的测序结果通过NCBI 的Blast 系统进行同源性分析, 是分子水平进行细菌分类鉴定的一个十分有力的工具[6],对于病原追本溯源具有重要意义。
分离菌生化试验结果,能分解甘露糖产酸,不能分解乳糖,与秦绪伟等人发表的论文结果相似[8];靛基质等阳性,与武春燕发表的论文结果有差异[9];MR、VP 阴性,与张邑帆等发表的论文结果基本一致[10]。分离菌药敏试验结果,高敏药物为阿莫西林等,中等敏感药物为万古霉素等,低敏药物为乙酰螺旋霉素等,与之前刘燕发表的论文结果大致相似[7],但沈国安等发表的论文的结果差异较大[11],可能是菌株差异造成。目前,动物用抗生素市场秩序仍旧不够规范、饲料的生产和养殖环节抗生素用药还不尽合理、安全使用抗生素的意识不够强等诸多问题比较突出[12],细菌耐药性越来越强,所以临床一定要掌握科学合理的用药原则,能用低级抗生素治疗的绝不用高级抗生素[13]。在对病鹅进行治疗时,首先对小群进行药敏试验,并根据结果选择使用最敏感的药物[14]。乳杆菌是消化道中的优势菌群,且其能产强酸抑制病原菌生长,维持其长期的益生作用[15],与分离菌体外抑菌结果一致,鸡唾液乳杆菌、猪小肠乳杆菌可用于由巴氏杆菌所致疾病的防治,减少抗生素的使用。
鹅巴氏杆菌病的急性病例传播迅速、发病急、死亡快,常造成较大的经济损失。因此,鹅巴氏杆菌病的预防十分重要,养殖人员、兽医师坚持定期检疫,遵循早发现早治疗的原则,以达到降低养殖损失的目的[16]。临床上应用效果较佳的疫苗用于预防该病:禽霍乱弱毒疫苗G190E40 菌苗,肌注2 mL,有效免疫期为6 个月,同时可将乳酸菌等微生态制剂预防性投喂[17]。
4 结论
从江西省南昌市某鹅场提供的2 只病死鹅的肝脏和心脏中分离纯化得到4 株多杀性巴氏杆菌,对头孢曲松等药物高敏,通过动物回归实验可知其均具有致病性且致病性较强。建议立即将病鹅隔离,抗生素治疗,在整个鹅群中进行预防性投喂阿莫西林、头孢类药物。
