一例猪链球菌病的诊断及其病原分离鉴定
2021-03-20胡换仪林敏刘小兰刘昌锦聂佳婷邓舜洲
胡换仪,林敏,刘小兰,刘昌锦,聂佳婷,邓舜洲
(江西农业大学动物科学技术学院,江西南昌330045)
猪链球菌病是由多种不同群的链球菌引起的不同临诊类型传染病的总称。侵害各种年龄的猪只,通常以败血症、脑膜炎、关节炎和淋巴结炎为主要特征。一年四季均可发生,通常在夏秋炎热季节出现大面积流行,发病多,死亡率高[1]。根据荚膜抗原的差异,猪链球菌有35 个血清型(1~34 及1/2)及相当数量无法定型的菌株,其中1、2、7 和9 型是猪的常见致病菌,而2 型猪链球菌是可致病的猪源链球菌中最常见的一种,不仅能引起猪只急性败血死亡,同时又能通过皮肤伤口感染人群甚至致死[2~3]。
2020 年12 月,某规模化猪场的保育仔猪出现零星发病死亡,临床症状以体温升高,不能站立,角弓反张和眼球震颤等神经症状为主。通过对该猪场送检病料进行细菌分离鉴定,确诊为猪链球菌感染。
1 材料与方法
1.1 病料
某猪场的一份表现为神经症状的保育仔猪脑组织病料。
1.2 主要试剂及培养基
TSA 培养基和琼脂粉购自Solarbio 公司;马丁肉汤液体培养基和琼脂糖购自金克隆(北京)生物技术有限公司;药敏纸片、链球菌细菌生化编码鉴定管、链球菌编码册、显色指示剂液体石蜡和VP(甲液、乙液)等均购自杭州滨和微生物试剂有限公司;DL2000 DNA Marker 、10× PCR buffer 和 rTaq酶购自Takara 公司;dNTPs 购自北京全式金生物技术有限公司;检测引物由南京金斯瑞生物科技有限公司合成。
1.3 分离鉴定
无菌条件下挑取病猪脑组织划线接种于TSA血清平板(含10%新生牛血清)中,37℃恒温培养24~48h。观察并记录菌落形态特征,挑取单个优势菌落进行革兰氏染色镜检,可疑菌落再次划线接种TSA 血清平板进行纯化培养。
1.4 生化鉴定
用接种环取纯培养的菌落4~5 个接种到细菌微量生化反应管内并加入1 滴小牛血清,置灭菌平皿内放入37℃生化培养箱培养,18~24h 观察并记录观察结果。将试验结果分为4 组,每组对应1 个数字,可得到1 个4 位数的编码,在链球菌编码册检索该编码,得出鉴定结果。
1.5 PCR
根据Genbank 中猪链球菌16S rRNA 序列设计并合成 1 对检测引物, 上游引物:5'-AGAGTTTGATCCTGGCTCAG-3', 下 游 引 物 :5'-AGAGTTTGATCCTGGCTCAG-3',预期扩增片段大小为1500bp。参考文献提取细菌DNA用于PCR 检测[4]。PCR 反 应 体 系 :ddH2O 17μL ,10 × PCR buffer 2.5μL,dNTPs 2μL,上下游引物(20nmol/mL)各0.5 μL ,DNA 模板 2μL,rTaq 酶 0.5μL。PCR 反应程序:95℃ 预变性 5min,95℃变性 30s,52℃退火30s,72℃ 延 伸 90s, 共 32 个 循 环 ,72℃ 总 延 伸8min。PCR 产物进行1%琼脂糖凝胶电泳后送南京金斯瑞生物科技有限公司进行序列测定。将测序结果与NCBI GenBank 中的参考序列进行同源性比对并绘制进化树。
1.6 药敏试验
挑取纯培养的菌落4~5 个,接种于马丁肉汤液体培养基,37℃培养过夜。用灭菌棉签蘸取菌液少许,均匀涂于TSA 血清平板上,取药敏纸片均匀贴于培养基表面,37℃培养24~48h,测量抑菌圈直径并判断细菌对药物的敏感性。
2 诊断结果
2.1 临床症状和病理剖检
发病猪为保育仔猪,出现后肢瘫痪、角弓反张和眼球震颤等神经症状(图1)。剖检发现病猪脑膜充血明显,呈树枝状(图2)。结合临床症状和剖检病变怀疑为猪链球菌病。

图1 发病保育仔猪

图2 脑部剖检病变
2.2 细菌形态特征
分离菌株在TSA 血清平板中长出表面光滑,针尖大小的灰白色透明菌落;在5%绵羊血平板中呈现α 溶血。挑取纯培养的菌落进行革兰氏染色,光学显微镜下可见革兰氏染色阳性,圆形或卵圆形菌体,成双或成链状排列(图3)。

图3 分离菌革兰氏染色(1000 倍)
2.3 生化试验结果
分离菌株生化试验结果显示,该菌对精氨酸、DPP、七叶灵、TMZ、蕈糖和蔗糖等反应结果为阳性,对 PYR、VP、PMG、MAG、山梨醇等反应结果为阴性,溶血反应为非乙型溶血。按照链球菌编码册得到一组四位数编码1534,在编码本中检索该编码,结果为好鉴定,猪链球菌2 认定指数85。
2.4 测序结果分析
用16S rRNA 引物进行PCR 扩增,产物进行1%琼脂糖凝胶电泳,图4 可见扩增条带大小1500bp,与预期一致。运用DNAstar 软件将上述PCR 产物测序结果与Genbank 中10 株国内外的猪链球菌参考序列(主要是常见的致病血清型)进行同源性比较并绘制系统发育树。由图5 可知,分离菌株与 2 型猪链球菌 P1/7 株、SC84 株、BM407 株、A7 株、GZ1 株、98HAH33 株和 05ZYH33 株等亲缘关系最近,位于一个相对独立的分支,同源性100%,与 1 型猪链球菌 ST1 株、7 型猪链球菌 D9 株和9 型猪链球菌D12 株亲缘关系较远,同源性99.3%~99.7%。综合染色镜检、生化鉴定和测序结果,确定该分离菌株为2 型猪链球菌,命名为JX-N2。

图4 细菌16S rRNA 检测结果
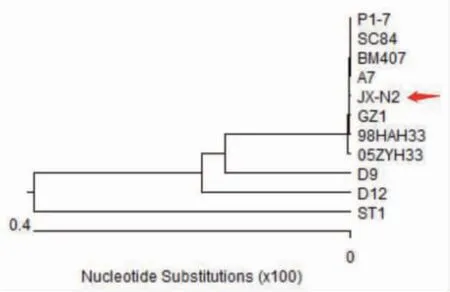
图5 16S rRNA 基因核苷酸序列的系统发育树
2.5 药敏试验结果
药敏试验结果表明,该分离菌株对多种抗生素药物敏感(表1)。其中,对青霉素、恩诺沙星、氨苄西林、氟苯尼考、头孢噻肟、阿莫西林、氧氟沙星、诺氟沙星等高度敏感;对复方新诺明、多西环素、土霉素、头孢曲松、丁安卡那等中度敏感,对磺胺异恶唑耐药。
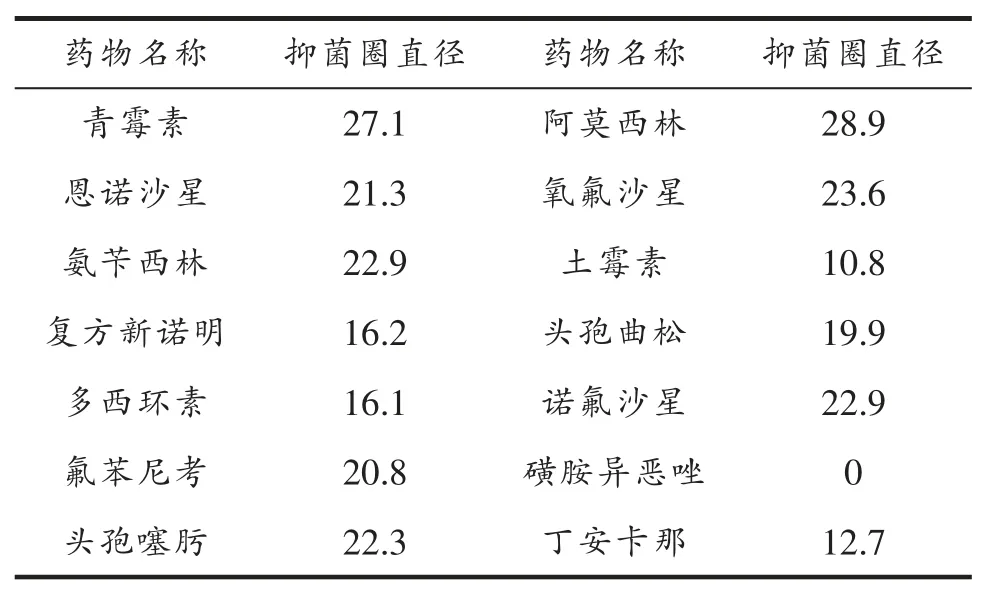
表1 药敏试验结果 mm
3 讨论
从某猪场送检的脑组织病料中分离到了一株革兰氏阳性链状球菌,其生理生化和培养特性与大多数猪链球菌的基本一致[5~8],PCR 测序结果显示该分离菌株与2 型猪链球菌亲缘关系最近,结合流行病学和病理特征确定该猪场发病原因为猪链球菌感染。
由于日常生产过程中抗生素的不合理使用和饲料中长期添加抗生素,使猪场出现了大量多重耐药菌株[9]。本试验分离的菌株仅对磺胺异恶唑完全耐药,对土霉素轻度耐药,对其他大多数抗生素药物保持敏感,耐药情况较轻微,临床治疗选用阿莫西林效果良好。在实际治疗中,即使使用强效阿莫西林治疗能取得理想效果,但是由于病菌的持续存在和强传播性,单纯的对病猪进行强效阿莫西林治疗并不能有效杀灭猪链球菌,而是要采取综合性治疗的措施,为了避免耐药菌株的产生,需要选择敏感药物合理搭配使用[10]。
规模化猪场在高度重视猪病毒性疫病防控的同时,一定要加强猪群中细菌性疫病的防控,确保猪只健康生长,以提高养猪生产效率与经济效益。目前,我国猪群中单独发生链球菌病较少见,疫情趋于平稳,但在猪群中发生蓝耳病、猪瘟、圆环病毒感染及伪狂犬病等疫病时,常见有链球菌和其它细菌继发感染,使病情复杂化,发病率与死亡率增高[11]。为了减少猪链球菌病的发生,猪场应加强饲养管理,改善饲养环境,提高猪只免疫力,定时对猪群中细菌性疾病和病毒性疾病进行监测,防患于未然。
