天台乌药对TNBS 诱导的溃疡性结肠炎模型大鼠的抗炎作用研究
2021-03-19赖慧敏黄敏聪楼招欢伟徐聪杨正标秦荔张立将
赖慧敏 黄敏聪∗ 楼招欢 谢 锋 潘 伟徐 聪杨正标秦 荔张立将
(1.浙江工业大学长三角绿色制药协同创新中心,杭州 310014;2.杭州医学院安全性评价研究中心,杭州 310053;3.浙江中医药大学药学院,杭州 310053)
溃疡性结肠炎(ulcerative colitis,UC)是一种主要累及直肠、结肠黏膜和黏膜下层的慢性非特异性炎症性疾病,与克罗恩病统称为炎症性肠病。随着人们生活方式及饮食结构的改变,我国UC 患病人数显著增多,已成为我国消化系统常见疾病。目前临床上UC 治疗药物主要有氨基水杨酸制剂、糖皮质激素和免疫抑制剂等,但其副作用较大,远期疗效及安全性并不理想[1-2]。而中医药具有多组分、多靶点、从整体论治等特点在治疗UC 等复杂慢性疾病方面具有独特的优势。UC 在中医中属“肠澼”“痢疾”等疾病范畴[3],“健脾温肾,行气导滞”是中医药治疗UC 的重要原则[4-5]。乌药为樟科植物乌药Lindera aggregata(Sims)Kosterm.的干燥块根,属理气药,具有“行气止痛,温肾散寒”的功效,传统常用于胃肠道疾病的治疗。现代研究也已证实天台乌药对胃肠功能具有良好的调节作用[6-9],但迄今乌药对UC 的药效作用及机制仍未见研究报道。课题组前期研究发现乌药能降低酒精性脂肪肝模型大鼠体内炎性细胞因子含量[10-11],推测其可能具有改善UC 的作用。因此,本实验采用TNBS 致UC 大鼠模型,以疾病症状及结肠组织形态学等指标为评价体系考察天台乌药对UC 的药效作用,为后续进一步研究提供治疗依据。
1 材料和方法
1.1 实验动物
雄性SD 大鼠,36 只,SPF 级,体重180~200 g,7 周龄,购买于上海斯莱克实验动物有限责任公司[SCXK(沪)2015-0005]。本研究实验动物饲养于杭州医学院安全性评价研究中心屏障系统[SYXK(浙)2017-0010]。本研究实验动物的使用(动物数量、实验设计及对动物的处理)通过了浙江省医学科学院安全性评价研究中心实验动物管理和使用委员会(Institutional Animal Care and Use Committee,IACUC)审批(20160321)并严格按照审批的内容实施,实验过程中严格遵守3R 原则。整个实验期间,动物饲养室温度在21.5℃~25.0℃之间,相对湿度在40%~65%之间,中央空调集中通风每小时≥15次,12 h 明暗交替。
1.2 主要试剂与仪器
2,4,6-三硝基苯磺酸(TNBS,批号:SLBK1620 V)购自美国Sigma 公司;羧甲基纤维素钠(CMCNa,批号:20150210)购自国药集团化学试剂有限公司;柳氮磺胺吡啶肠溶片(SASP,国药准字H31020557)购自上海信谊天平药业有限公司;大鼠IL-6 ELISA 试剂盒(批号:7179620)、大鼠TNF ELISA 试剂盒(批号:7109996)、FITC anti-rat CD3 抗体(批号:7026976)、APC anti-rat CD4 抗体(批号:7075558)、PerCP anti-rat CD8a 抗体(批号:7132557)、PE anti-rat CD45RA 抗体(批号:7216755) 和 FITC anti-rat CD25 抗体(批号:4027979)均购自美国BD 公司;PE Foxp3 抗体(批号:E12828-106)购自美国eBioscience 公司;髓过氧化物酶(Myeloperoxidase,MPO) 测试盒(批号:20160502)购自南京建成科技有限公司;谷草转氨酶(AST,批号:07349/00002881)、谷丙转氨酶(ALT,批号:07348/00002884)、尿素氮(BUN,批号:07402/00003240)、肌酐(CREA,批号:171037/50003231)、总胆固醇(TC,批号:07284/00002670)和甘油三脂(TG,批号:07236/00002245)检测试剂均购自德国Diagnostio Systems Gmbh。
HITACHI 7180 全自动生化仪(日本日立公司);Synergy HT 全自动荧光酶标仪(美国BioTek 公司);FACS Calibur 流式细胞仪(美国BD 公司);DM3000 显微镜等病理全套设备(德国Leica 公司)。
1.3 实验方法
1.3.1 乌药醇提取物制备
乌药,产地浙江天台县,由浙江省天台山乌药生物工程有限公司提供,经该公司陈方标药师鉴定为樟科(Lauraceae)山胡椒属(Lindera)植物乌药Lindera aggregata(Sims) Kosterm.的干燥块根。称取乌药切片100 g,加入10 倍量的70%乙醇,冷凝回流提取两次,每次1.5 h。将两次药液合并,适当真空减压浓缩并干燥,得14.4 g 乌药70%乙醇提取物(即1 g 提取物相当于6.95 g 生药材)。
1.3.2 分组、造模与给药
SD 大鼠接收后立即对其进行编号标记并称重,适应性喂养3 d 后再次称重,并采用SPSS 软件将其随机分为6 组:正常对照组(NC)、模型对照组(TNBS)、阳性对照组(SASP)、乌药低剂量组(WYL)、乌药中剂量组(WY-M)和乌药高剂量组(WYH),每组6 只,确保各组间大鼠体重无显著性差异。
分组后大鼠禁食不禁水24 h 后,采用1%戊巴比妥钠(40 mg/kg 剂量)麻醉。正常对照组按0.36 mL/100 g 体积灌肠给予生理盐水,模型对照组及其余药物干预组均按90 mg/kg 剂量经灌肠给予TNBS 50%乙醇溶液。具体操作方法如下:将一直径2 mm的橡胶管充分润滑后由肛门轻缓插入深约8 cm,按90 mg/kg 剂量推入TNBS 50%乙醇溶液(浓度:25 mg/mL、灌肠体积:0.36 mL/100 g),完毕后缓慢拔出塑料胶管,用手捏住肛门,提起大鼠尾部,持续倒置1 min,使造模剂充分渗入大鼠肠腔内。
正常对照组和模型对照组大鼠均按10 mL/kg体积灌胃给予0.5%的CMC-Na 溶液,阳性对照组灌胃给予柳氮磺胺吡啶(0.3 g/kg);乌药低、中、高剂量组大鼠按10 mL/kg 给药体积灌胃分别给予0.5、1、2 g/kg 生药剂量的乌药。自TNBS 造模次日开始给药,每日一次,连续9 d。
1.3.3 指标检测
(1)一般体征观察
试验期间每天观察并记录各组大鼠的行为体征及生存状况,观测体重、粪便性状及隐血情况。粪便性状按正常(暗褐色,硬呈椭球形)记0 分,松软记1 分,稀溏记2 分;潜血阴性记0 分,肉眼未见血便但潜血阳性记1 分,肉眼可见血便记2 分,上述两项评分相加为粪便性状指数。
(2)血清生化指标和细胞因子的测定
末次给药后禁食不禁水12 h 后,采用1%戊巴比妥钠按40 mg/kg 剂量进行腹腔注射麻醉大鼠,采用一次性负压采血针从腹主动脉采血至非抗凝真空采血管中,离心收集上清并按需分装。使用日本HITACHI 7180 全自动生化仪检测大鼠血清中AST、ALT、BUN、CREA、TC、TG 等生化指标;采用酶联免疫(ELISA)法检测大鼠血清中IL-6 和TNF-α 水平。
(3)外周血中淋巴细胞亚群的测定
剖解时从腹主动脉采血至EDTA-K 抗凝真空采血管中。分别吸取100 μL 血液样本至两根流式样本管中,一管用于外周血中B 细胞、T 细胞占淋巴细胞比例以及CD4+T、CD8+T 细胞占T 细胞比例检测,另一管用于外周血Treg 细胞检测。
大鼠外周血B、T 等淋巴细胞亚群检测具体方法如下:设置空白对照及单染对照管用于流式细胞仪补偿等参数调节。各样本检测管加入FITC antirat CD3、APC anti-rat CD4、PerCP anti-rat CD8 和PE anti-rat CD45RA 这四种荧光抗体进行表面染色;经溶血、PBS 洗涤等环节以制备样本,随后采用流式细胞仪检测B 细胞(CD3-CD45RA+)、T 细胞(CD3+CD45RA-)、CD4+T 细胞(CD3+CD4+CD8-)及CD8+T细胞(CD3+CD4-CD8+)比例。大鼠外周血Treg 细胞检测具体方法如下:各样本检测管先加入APC anti-rat CD4 和FITC anti-rat CD25 抗体进行表面染色;然后用BD Transcription Factor 溶液进行细胞固定和破细胞核膜;随后加入PE anti-Foxp3 抗体进行核内染色;采用流式细胞仪检测Treg 细胞(CD4+CD25+Foxp3+)比例。
(4)大鼠肠道组织中MPO 的测定
剪取部分结肠组织并称重,根据南京建成MPO检测试剂盒说明进行后续操作,加入系列试剂;使用酶标仪于460 nm 波长检测各样本吸光度。MPO活力(U/g 组织湿重)=(A测定值-A对照值)/11.3×取样量(g)。
(5)结直肠重量、长度及单位长度重量测定
动物剖解前称量大鼠体重,剖解时摘取结肠,沿肠系膜剪开肠腔,用冰生理盐水冲洗干净,用滤纸将结肠吸干,测量总长度并称重,计算单位长度重量及结肠指数。
(6)结肠组织大体观察及病理学检查
剖解时肉眼大体观察结肠外观形态变化(如色泽、水肿、肠壁扩大粘连、溃疡糜烂等);取病变部位组织置于福尔马林溶液中,石蜡包埋后切片,苏木素-伊红(HE)染色,显微镜下进行组织学观察。
1.4 统计学方法
采用SPSS 22.0 软件进行数据统计,应用Graphpad Prism 8.0 软件作图,计量资料数据采用平均数±标准差()表示。选用单因素方差分析(One-way ANOVA)进行显著性分析;总体组间差异有统计学意义时(P<0.05)时,进行组间两两比较;当方差齐性时,组间两两比较采用LSD 法分析,当方差不齐时采用Games-Howell 法分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 对UC 模型大鼠疾病症状的影响
正常对照组大鼠行动活跃,毛发光泽,食欲良好,粪便质地较硬,呈椭球形,暗褐色。与正常对照组比较,模型对照组大鼠自造模次日起即出现自主活动减少、食欲减退、精神萎靡、倦怠懒动同时伴有大便次数增多,腹泻便血等症状,表明造模成功。造模后模型组大鼠体重明显减轻,相对体重百分率始终低于正常对照组,阳性对照组、乌药低、中、高剂量组大鼠的体重降低较少,相对体重百分率高于模型对照组。与模型对照组比较,阳性对照组、乌药低、中、高剂量组大鼠粪便稀软及便血程度较轻,粪便性状指数明显降低(见图1)。上述实验结果表明乌药能够在一定程度上减轻TNBS 造模引起的体重降低及便血等疾病症状,对TNBS 诱导的UC 模型大鼠具有一定的改善作用。
2.2 对UC 模型大鼠结肠组织大体观的影响
正常对照组大鼠结肠粘膜表面光滑,未见明显异常。与正常对照组比较,模型对照组大鼠肠道粘膜充血水肿、肠管缩短、肠壁增厚;并可见多处溃疡,部分形成深大溃疡,甚至与周围组织粘连。模型对照组大鼠结直肠肠壁增厚且长度显著缩短(P<0.01),结肠总重量以及单位长度重量显著增加(P<0.01)。与模型对照组比较,阳性对照组、乌药低、中、高剂量组大鼠结直肠重量及单位长度重量显著降低(P<0.05,P<0.01);阳性对照组、乌药中剂量组大鼠结直肠长度显著增加(P<0.05)(见图2)。上述实验结果表明乌药能够改善TNBS 诱导的UC模型大鼠的结直肠病变。
2.3 对UC 模型大鼠结肠组织病理学的影响
正常对照组大鼠结肠组织可见黏膜上皮细胞完整,隐窝结构正常,腺体排列整齐,未见萎缩、坏死及炎性浸润等病变。与正常对照组比较,模型对照组大鼠结肠组织病理学镜检可见结肠组织上皮细胞严重损伤脱落、腺体破坏、溃疡等病变,其溃疡灶数量较多且面积较大(见图3 中黑色箭头标注),并伴有大量的中性粒细胞等免疫细胞浸润。与模型对照组比较,阳性对照组、乌药低、中、高剂量组大鼠肠道上皮细胞破坏程度有所减轻,溃疡灶数量有所减少,溃疡面积减小,中性粒细胞等免疫细胞浸润程度减轻(见图3),表明乌药能够改善UC 模型大鼠的结直肠组织病理学改变。
2.4 对UC 模型大鼠血清生化指标的影响
各组间大鼠血清中AST、ALT、BUN、CREA、TC和TG 等生化指标均未见显著性差异(见图4)。
2.5 对UC 模型大鼠炎症因子的影响
与正常对照组比较,模型对照组大鼠血清中IL-6、TNF-α 含量显著升高(P<0.01),表明UC 模型大鼠体内存在明显的炎症状况。与模型对照组比较,阳性对照组、乌药低、中、高剂量组IL-6 含量显著降低(P<0.01);阳性对照组、乌药低、中剂量组TNF-α含量显著降低(P<0.05)(见图5),提示乌药可能具有一定的抗炎作用,能够显著改善UC 模型大鼠体内炎症状况。

图1 乌药对UC 模型大鼠体重及粪便性状的影响(n=6)Figure 1 Effects of LREE on body weight and stool features of UC model rats
2.6 对UC 模型大鼠肠道组织MPO 的影响
与正常对照组比较,模型对照组大鼠每克结肠组织中含有的MPO 活性显著升高(P<0.01),表明经TNBS 造模后模型对照组大鼠结肠组织损伤后伴有大量诸如中性粒细胞等免疫细胞浸润。与模型对照组比较,阳性对照组、乌药低、中剂量组大鼠每克结肠组织中含有的MPO 活性显著降低(P<0.05)(见图5),表明乌药能够明显减轻UC 模型大鼠结肠组织中性粒细胞等免疫细胞浸润程度,初步提示乌药在一定程度上减轻了UC 模型大鼠的结肠组织中的炎症状况。

图2 乌药对UC 模型大鼠结直肠大体观及长度的影响(n=6)Figure 2 Effect of LREE on the length and morphology of colon of UC model rats
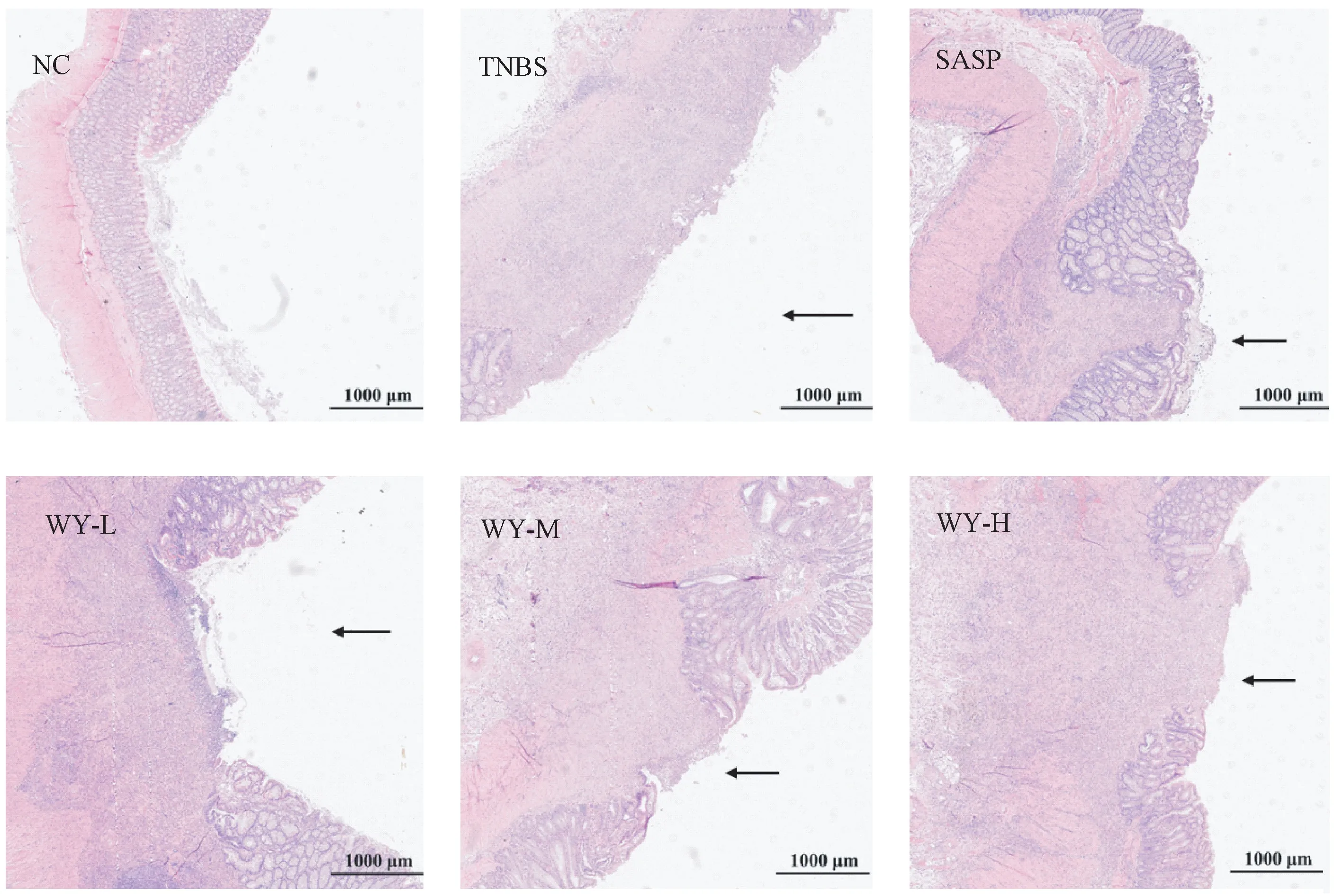
图3 乌药对UC 模型大鼠结肠组织病理学的影响Note.The arrow in the pictures refer to the ulcer focus.Figure 3 Effect of LREE on histopathology of UC model rats
2.7 对UC 模型大鼠外周血Treg 细胞等淋巴细胞亚群的影响
与正常对照组比较,模型对照组大鼠外周血中Treg 占辅助性T 细胞比例显著降低(P<0.05);与模型对照组比较,阳性对照组以及乌药醇提物低、中、高剂量组Treg 占辅助性T 细胞比例均有所升高,但未见统计学差异。各组间大鼠外周血中B 细胞、T细胞占淋巴细胞比例以及CD4+T、CD8+T 细胞占T细胞比例均未见明显变化(见图6)。
3 讨论
据统计溃疡性结肠炎既往多发于西方国家,但是随着社会环境暴露、人们生活方式和饮食结构等改变,UC 已成为我国消化系统常见疾病,且患病人数仍呈明显增加趋势[12-13]。溃疡性结肠炎患者多为青壮年,且呈年轻化趋势,临床主要表现为腹痛、腹泻、粘液血便等症状,目前UC 尚无特效药物导致其病程迁延,常反复发作,严重影响社会生产力和个人生活质量,甚至诱发癌变危及患者生命[14-15]。
中医将溃疡性结肠炎归“肠澼”“痢疾”等疾病范畴,中医药治疗溃疡性结肠炎重在健脾温肾,行气导滞。乌药主产于浙江、安徽、湖南、湖北等地,其中又以产于浙江天台者色白、质嫩、气芳香,质佳为道地药材,称“天台乌药”或“台乌”,为“新浙八味”培育品种之一,常用于治疗胃肠道诸证。试验结果显示,天台乌药低、中、高剂量均可不同程度缓解TNBS 诱导的UC 模型大鼠便血及体重降低等症状;明显改善其结肠黏膜充血水肿、肠壁萎缩增厚、溃疡粘连等病变,减少溃疡灶数量、缩小溃疡面积;显著增加其结直肠长度、重量及单位长度重量(P<0.05)。表明天台乌药能改善TNBS 诱导的溃疡性结肠炎模型大鼠的疾病症状以及结肠病变,具有良好的抗溃疡性结肠炎药效作用。
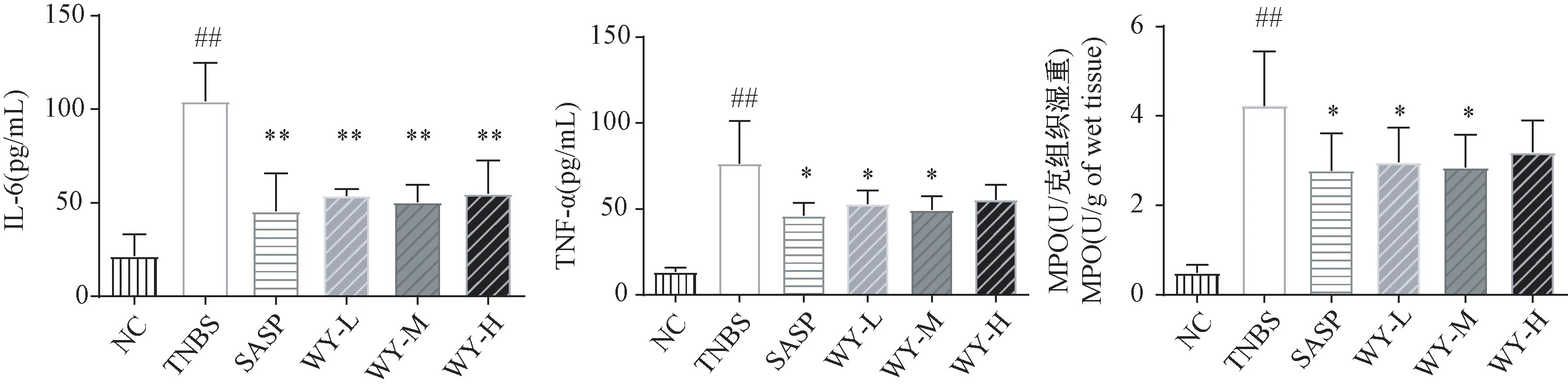
图5 乌药对UC 模型大鼠血清细胞因子及肠道组织MPO 的影响(n=6)Figure 5 Effects of LREE on inflammatory cytokines and myeloperoxidase of UC model rats

图6 乌药对UC 模型大鼠外周血中Treg 等淋巴细胞亚群的影响(n=6)Figure 6 Effects of LREE on lymphocyte subsets in peripheral blood of UC model rats
现代医学认为,UC 与肠道屏障受损导致肠道免疫过度激活甚至失衡密切相关[16]。不当饮食或者诸如TNBS 等外界因素会损伤肠道上皮细胞,破坏肠道黏膜屏障,导致肠道通透性增加,促使肠道微生物及其代谢产物等侵入肠黏膜固有层组织,引起肠道中巨噬细胞等免疫细胞过度激活,大量分泌如IL-6、TNF-α 等炎性细胞因子[17]。已有研究证实IL-6、TNF-α 等促炎性细胞因子是导致UC 发病的重要细胞因子,在溃疡性结肠炎发生发展中起着关键作用[18-19]。TNF-α 是由活化的单核巨噬细胞产生的一种重要的炎性因子,不仅能够通过与肿瘤坏死因子受体-1 结合诱导肠上皮细胞死亡,破坏肠道屏障,诱导UC 发生;还能够诱导巨噬细胞和血管内皮细胞等产生IL-6 等细胞因子和趋化因子,诱导免疫细胞趋化、浸润至肠道病灶部位,加剧肠道炎症,促进UC 发展[20]。IL-6 是由巨噬细胞、淋巴细胞等免疫细胞合成分泌的一种多效性细胞因子,能够促进Th17 细胞分化,抑制调节性T 细胞(Treg)分化,导致Th17/Treg 失衡。过度增殖活化的Th17 细胞能够大量分泌TNF-α 等炎性细胞因子,诱导肠上皮细胞死亡,加剧组织损伤,如此恶性循环促进UC 发展[18]。本试验结果显示TNBS 诱导的溃疡性结肠炎模型大鼠血清中IL-6 和TNF-α 含量以及结肠组织中MPO 活性均显著升高,外周血中Treg 占辅助性T 细胞比例显著降低(P<0.05)。而天台乌药能够降低模型大鼠结肠组织中MPO 活性以及血清中IL-6 和TNF-α 含量,表明其能够减少中性粒细胞等免疫细胞浸润,抑制炎性细胞因子产生,有效改善结肠炎症状况。此外,天台乌药还能够升高模型大鼠外周血中Treg 占辅助性T 细胞比例。综上所述,天台乌药能够改善TNBS 诱导的UC 模型大鼠的疾病症状和肠道组织病变,具有良好的抗UC 作用。该抗UC 作用可能与乌药抑制IL-6 等炎性细胞因子分泌有关,但具体机制仍有待进一步研究。
