丙泊酚对大鼠局灶性脑缺血再灌注模型神经功能改善及PKA-CREB 通路的影响
2021-03-19磊欧阳欣于明帅刘梅张
齐 磊欧阳欣于明帅刘 梅张 科
(成都医学院第二附属医院•核工业四一六医院,成都 610051)
脑血管疾病是全球高致死率和高致残率发生的主要原因之一[1-2]。脑缺血灌注再损伤(cerebral ischemia-reperfusion injury,CIRI)是引发多种脑血管疾病的主要病理机制,而CIRI 病理生理过程极为复杂,且临床上仍缺乏治疗CIRI 的有效药物,故寻找和开发治疗CIRI 有效药物,一直是目前临床研究的热点之一[3]。恢复脑组织血液供应是CIRI 主要治疗目的,但机体恢复血供时,势必会损伤脑组织及神经功能,而目前临床上仍缺乏脑组织及神经保护的有效措施及药物[4]。蛋白激酶A(protein kinase A,PKA)/环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)通路在神经干细胞的增殖、神经元细胞的诱导分化过程中发挥调控作用,且其与脑损伤过程中神经突触传导、重塑及学习、记忆等功能密切相关[5-6]。文献研究发现PKA/CREB 通路与CIRI过程神经功能改善关系密切,并逐渐受到临床研究的重视[7-8]。丙泊酚为短效静脉麻醉药,也是临床上脑损伤外科手术中常用麻药,其可使脑血流量减少,脑耗氧量及颅内压降低,近年来,大量研究发现丙泊酚对CIRI 过程中脑损伤具有保护作用[9]。但丙泊酚对CIRI 过程中神经功能的改善作用及对PKA/CREB 通路的影响,鲜见报导,本研究通过构建大鼠CIRI 模型,并进行探讨,为临床用药提供一定指导。
1 材料和方法
1.1 实验动物
清洁级SD 雄性大鼠62 只,6~8 周龄,体重200~220 g,由成都医学院实验动物中心提供[SCXK(川)2020-0027]。所有大鼠于成都医学院科研实验中心SPF 级实验动物中心动物房中饲养[SYXK(川)2020-0918],饲养条件:温度25℃,相对湿度50%,噪音<80 分贝,自然光照,动物房环境/鼠笼清洁、透气。经本院伦理委员会批准(LL-20200917)后实施本实验;实验动物符合3R 原则。
1.2 主要试剂与仪器
丙泊酚(H20030115,四川国瑞药业有限公司,规格:200 mg);2,3,5-氯化三苯基四氮唑(TTC)(0765,上海研卉生物科技有限公司);苏木精-伊红(HE)染色试剂盒(G1120,北京索莱宝科技有限公司);甲苯胺蓝(Nissl)染色试剂盒(6586-045,Sigma 公司);Tunel 细胞凋亡检测试剂盒(11684795910,Roche 公 司);PKA 抗 体(ab236855)、磷酸化 CREB (p-CREB) 抗体(ab32096)、脑源性神经营养因子(BDNF) 抗体(ab226843)均购自美国abcam 公司;BCA 蛋白定量试剂盒和胰蛋白酶(P0768、P0231,美国Pierce)。手动轮转式切片机(RM2125RTS,德国Leica);半干转膜仪、蛋白电泳仪(Trans-Blot SD、1659001,美国Bio-Rad);凝胶成像仪(GIS-500,Miulab)光学显微镜(SMZ745,日本尼康)等。
1.3 实验方法
1.3.1 CIRI 模型建立及分组
按文献[10]采用改良线栓法建立大鼠局灶性CIRI 模型:将50 只SD 大鼠禁食禁水12 h 后,以3%戊巴比妥钠麻醉,固定(取仰卧位),于颈部正中切口,钝性分离并暴露左侧颈总动脉以及颈内、颈外动脉,将尼龙线从颈外动脉插入至颈内动脉,夹闭左侧颈内动脉,缺血2 h 后拔除线栓恢复缺血再灌注,缝合组织,并给予20 万U 青霉素肌内注射(术后连续使用3 d 以手术预防感染)。待大鼠苏醒后放入笼中观察。再灌注24 h 后,依据大鼠神经功能缺损评分(mNSS)评分[11]对大鼠感觉、运动、反射、平衡等方面损伤情况进行评定,将评分在大于7分以上大鼠纳入实验研究。48 只大鼠造模成功,随机分为丙泊酚[11-12]低、中、高(10、25、50 mg/kg)剂量组及模型组(CIRI 组),每组12 只。另取12 只大鼠。除不插线夹闭左侧颈内动脉外,其余操作同模型组,大鼠苏醒后,作为假手术组。各组大鼠于缺血再灌注24 h 后,开始给药。丙泊酚用生理盐水配制成1 mg/mL、2.5 mg/mL、5 mg/mL 的溶液,丙泊酚各剂量组均按10 mL/kg 的剂量经腹腔注射予相应剂量的丙泊酚溶液,假手术组及模型组按10 mL/kg的剂量经腹腔注射予生理盐水。各给药组连续给药4 周,每天1 次。
1.3.2 神经功能缺损评分(mNSS 评分)及脑梗死体积检测
各组大鼠末次给药12 h 后,参照文献[13]用mNSS 评分对各组大鼠神经缺损情况进行评定,评分越高表明神经损伤越严重。完成mNSS 评分之后,各组均随机取6 只大鼠,麻醉,取脑,于-20℃中冰冻。组织冻硬后,于冰上制备大脑冠状切片。将切片置于2% TTC 染液中,37℃避光染色。白色是梗死灶,红色是正常组织。4%多聚甲醛固定,4℃过夜,拍照。使用Image J 1.41 软件统计脑切片的正常组织/梗死面积,计算梗死体积百分比:V %=(Al+A2+…+An)/(BI+B2+…+Bn)(n 为脑片序号,A 表示每个脑切片梗死区域面积,B 表示每个脑切片梗死侧大脑半球面积)。
1.3.3 大鼠脑皮层组织Nissl 染色观察
各组大鼠末次给药12 h 后,取各组剩下6 只大鼠,麻醉后断头取脑,取0.5 g 脑皮层组织,于-80℃冰箱保存,剩余组织用4%多聚甲醛固定,经脱水、透明、石蜡包埋后取4 μm 冠状切片,根据试剂盒进行Nissl 染色,在显微镜下观察脑皮层组织神经元细胞病理形态学变化情况,采用变性细胞指数(损伤细胞/细胞总数×100%)表示神经元细胞受损程度。
1.3.4 Tunel 染色观察脑皮层组织神经细胞凋亡情况
将脑皮层组织石蜡切片经脱蜡、脱水、封闭后添加Tunel 工作液室温下孵育1 h,随后加入抗荧光猝灭剂进行封片,在共聚焦显微镜下观察切片中细胞凋亡情况,采用Image-pro plus 定量分析神经元细胞凋亡率。
1.3.5 Western blot 法检测脑皮层组织PKA、pCREB、BNDF 蛋白相对表达水平
取1.3.3 中冻存的脑皮层组织,解冻,匀浆,分离出上清液,用蛋白提取试剂盒提取蛋白,蛋白定量BCA 试剂盒测定蛋白总浓度,上样,电泳、转膜,清洗,5%脱脂牛奶封闭1 h,清洗,加一抗(PKA、pCREB、BNDF、β-actin(内参))抗体,4℃过夜,加入HRP 羊抗兔二抗,37℃孵育1 h,显色,拍照,分析各组PKA、pCREB、BNDF 蛋白水平。
1.4 统计学方法
2 结果
2.1 各组大鼠mNSS 评分结果
与假手术组相比,丙泊酚各剂量组及模型组大鼠mNSS 评分升高(P<0.05);与模型组相比,丙泊酚低、中、高剂量组mNSS 评分降低(P<0.05),且丙泊酚各剂量组mNSS 评分呈剂量依赖性降低,见下表1。
2.2 各组大鼠脑梗死体积检测结果
假手术组大鼠,TTC 染色显示大脑组织呈均匀淡红色,无脑梗死病灶;与假手术组相比,模型组大鼠脑梗死部位被染成白色,且梗死体积增大(P<0.05);与模型组相比,丙泊酚低、中、高剂量组组脑梗死体积呈剂量依赖性减小(P<0.05),见图1,表2。
2.3 各组大鼠脑皮层组织神经细胞变性指数及细胞凋亡率比较
假手术组大鼠脑皮层神经细胞排列整齐,核仁清晰,细胞核周围尼氏体颗粒多。与假手术组相比,模型组大鼠脑皮层神经细胞形态不完整、细胞核皱缩,尼氏小体数量减少,且神经细胞变性指数升高(P<0.05)。与模型组相比,丙泊酚各剂量组脑皮层神经细胞上述结构损伤程度逐渐减少,且细胞变性指数呈剂量依赖性降低(P<0.05);与模型组相比,丙泊酚各剂量组脑皮层组织中细胞凋亡率降低,且呈剂量依赖(P<0.05)。见图2,表3。
2.4 各组大鼠脑组织PKA、pCREB、BNDF 蛋白表达结果
与假手术组相比,模型组大鼠脑皮层组织PKA、pCREB、BNDF 蛋白表达降低(P<0.05);与模型组相比,丙泊酚低、中、高剂量组脑皮层组织PKA、pCREB、BNDF 蛋白表达呈剂量依赖性升高(P<0.05),见图3,表4。
表1 各组大鼠mNSS 评分比较(,n=12)Table 1 Comparison of MNSs scores of rats in each group

表1 各组大鼠mNSS 评分比较(,n=12)Table 1 Comparison of MNSs scores of rats in each group
注:与假手术组相比,∗P<0.05;与模型组相比,△P<0.05;与丙泊酚低剂量组相比,#P<0.05;与丙泊酚中剂量组相比,✧P<0.05。Note.Compared with the sham operation group,∗P<0.05.Compared with the model group of propofol,△P<0.05.Compared with the low dose group of propofol,#P<0.05.Compared with the middle dose group of propofol,✧P<0.05.

图1 各组大鼠TTC 染色脑梗死图Figure 1 TTC staining of cerebral infarction in each group

图2 各组大鼠脑皮层组织Nissl 染色图Figure 2 Nissl staining of cerebral cortex in each group
表2 各组大鼠脑梗死体积比较(,n=6)Table 2 Volume comparison of cerebral infarction in each group

表2 各组大鼠脑梗死体积比较(,n=6)Table 2 Volume comparison of cerebral infarction in each group
注:与假手术组相比,∗P<0.05;与模型组相比,△P<0.05;与丙泊酚低剂量组相比,#P<0.05;与丙泊酚中剂量组相比,✧P<0.05。Note.Compared with the sham operation group,∗P<0.05.Compared with the model group of propofol,△P<0.05.Compared with the low dose group of propofol,#P <0.05.Compared with the middle dose group of propofol,✧P<0.05.
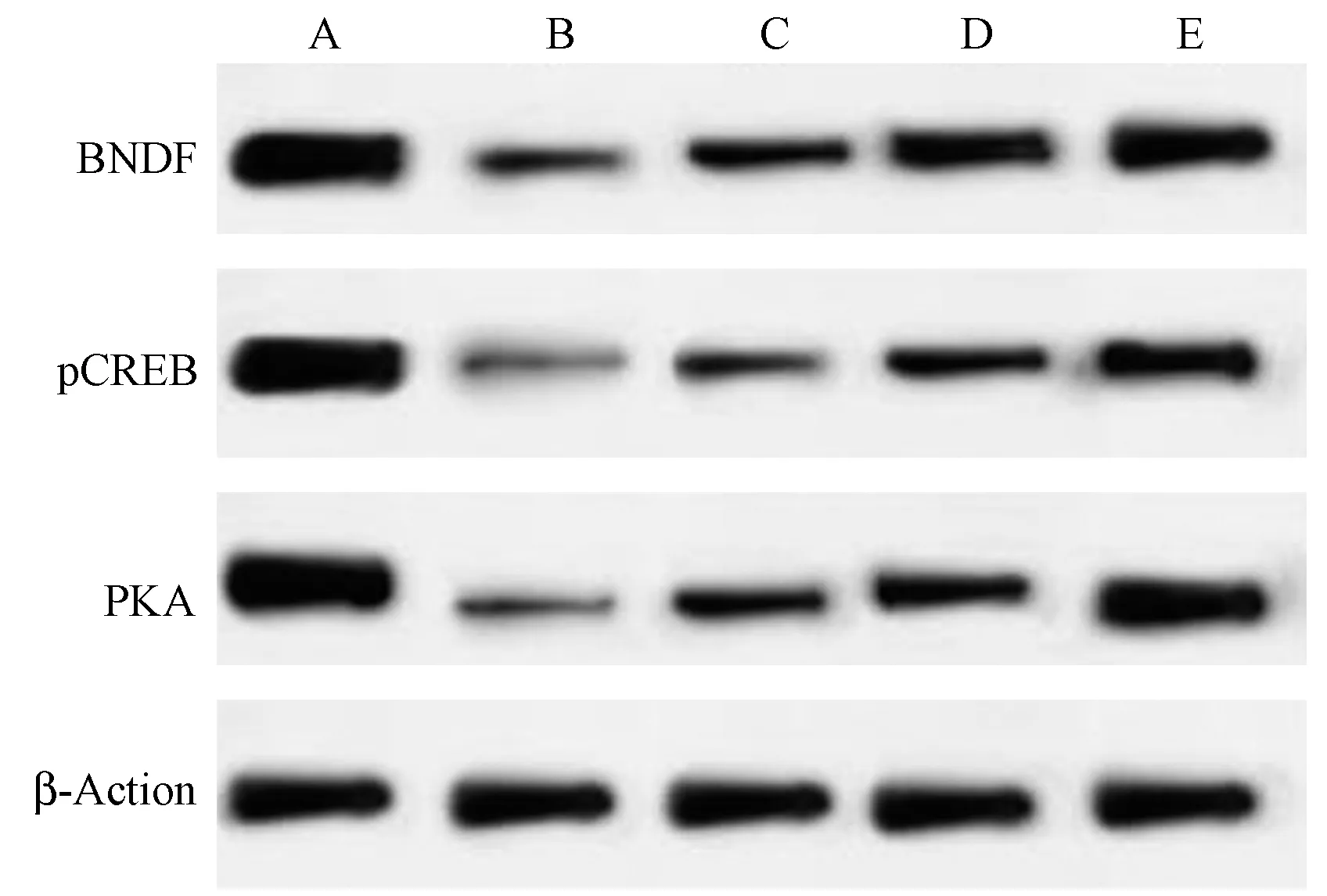
图3 各组大鼠脑皮层组织PKA、pCREB、BNDF 蛋白表达免疫印迹图Note.A,Sham operation.B,Model.C,Low dose propofol.D,Middle dose propofol.E,High dose propofol.Figure 3 Western blot of PKA,pCREB and bndf protein expression in cerebral cortex of rats in each group
表3 各组大鼠脑皮层神经细胞变性指数及细胞凋亡率比较(,n=6)Table 3 Comparison of degeneration index and apoptosis rate of neurons in cerebral cortex of rats 50 μm in each group
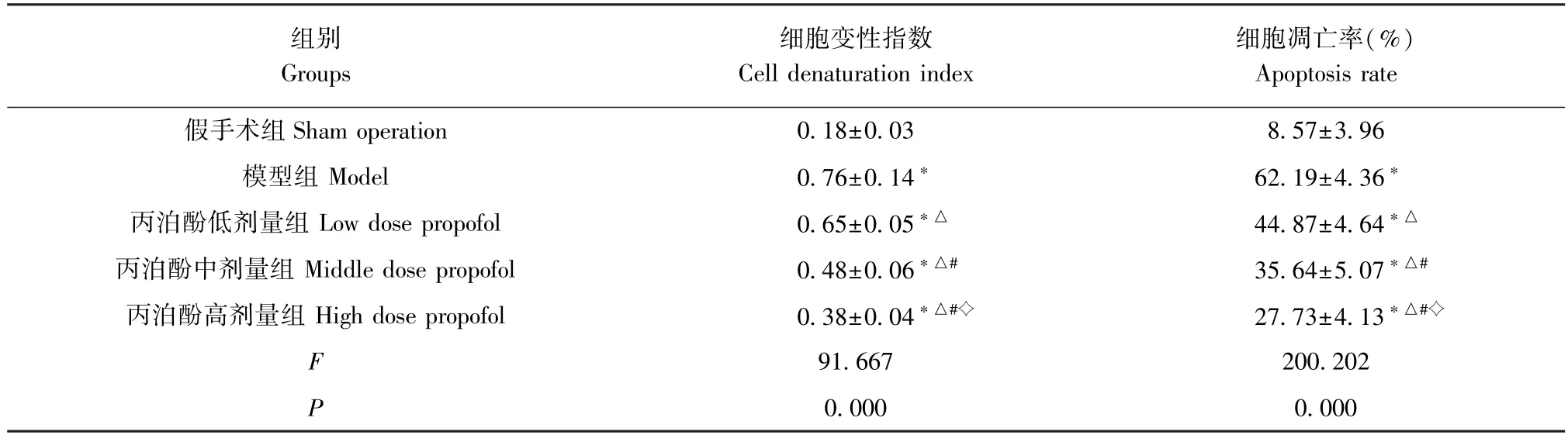
表3 各组大鼠脑皮层神经细胞变性指数及细胞凋亡率比较(,n=6)Table 3 Comparison of degeneration index and apoptosis rate of neurons in cerebral cortex of rats 50 μm in each group
注:与假手术组相比,∗P<0.05;与模型组相比,△P<0.05;与丙泊酚低剂量组相比,#P<0.05;与丙泊酚中剂量组相比,✧P<0.05。Note.Compared with the sham operation group,∗P<0.05.Compared with the model group of propofol,△P<0.05.Compared with the low dose group of propofol,#P<0.05.Compared with the middle dose group of propofol,✧P<0.05.
表4 各组大鼠脑皮层组织PKA、pCREB、BNDF 蛋白表达比较(,n=6)Table 4 Protein expression comparison of PKA,pCREB and BNDF in cerebral cortex of rats in each group

表4 各组大鼠脑皮层组织PKA、pCREB、BNDF 蛋白表达比较(,n=6)Table 4 Protein expression comparison of PKA,pCREB and BNDF in cerebral cortex of rats in each group
注:与假手术组相比,∗P<0.05;与模型组相比,△P<0.05;与丙泊酚低剂量组相比,#P<0.05;与丙泊酚中剂量组相比,✧P<0.05。Note.Compared with the sham operation group,∗P<0.05.Compared with the model group of propofol,△P<0.05.Compared with the low dose group of propofol,#P<0.05.Compared with the middle dose group of propofol,✧P<0.05.
3 讨论
CIRI 过程中,脑缺血后恢复血流供应,神经细胞损伤、凋亡,尼氏小体变性、数量减少甚至消失,导致神经功能损伤。孙亚蒙等[14]发现CIRI 过程,缺血预处理,可导致神经元细胞凋亡和神经功能损伤。本研究采用线栓法制备大鼠CIRI 模型,结果发现与假手术组相比,模型组大鼠神经功能缺损评分及脑梗死体积显著升高,大鼠脑皮层神经元细胞排列紊乱,神经元细胞变性、核溶解、固缩等病理损伤严重,尼氏小体数量变少,且变性细胞指数及脑皮层细胞凋亡率升高,提示模型大鼠脑组织出现病理损伤,神经功功能损伤,与文献[14]脑缺血再灌注损伤动物模型表现一致,表明大鼠CIRI 模型制备成功。
丙泊酚是一种全身静脉麻醉药,具有起效快、苏醒迅速且完全、不良反应少等特点,被广泛应用于多种短小手术的麻醉和镇静。近年研究证实,丙泊酚在呼吸、循环、泌尿等多种系统中发挥器官保护作用,而其对脑保护及中枢神经系统的保护作用,也受到了特别重视和广泛关注[9]。薛青等[15]及赵晶等[16]研究发现丙泊酚可通过抑制脑细胞凋亡、改善血脑屏障来发挥CIRI 脑保护作用;张熙等[17]研究发现丙泊酚可改善CIRI 大鼠海马神经元凋亡及学习认知功能。本研究显示,丙泊酚各剂量组大鼠神经功能缺损评分、脑梗死体积、神经元细胞变性指数及凋亡率低于模型组,尼氏小体数量多于模型组,脑皮层病理损伤轻于模型组,表明丙泊酚可抑制CIRI 大鼠脑损伤,减轻神经元细胞凋亡,有助于提高CIRI 大鼠神经功能。但丙泊酚脑保护作用的机制复杂,可能涉及多通路、多位点,其对神经功能保护途径及分子生物学机制不甚明确,本研究继续探究丙泊酚对CIRI 过程中神经功保护作用的分子机制,以期阐明丙泊酚发挥脑保护的其他分子生物学机制,具有一定的临床意义。
突触是神经元间信息交流的结构基础,神经系统功能的调节有赖于突触结构和功能的完整[18]。而CIRI 过程中,低灌注和缺氧导致的皮层神经元损伤、脑内突触信息传递的完整性和准确性破坏,是导致患者神经功能受损、甚至致残的主要原因[19]。因此提高缺血损伤后神经突触的重塑,是改善神经功能损伤的重要途径之一。PKA 介导的信号通路与突触形成、信号传递及维持起重要作用[20]。PKA可磷酸化下游蛋白CREB,上调突触受体的表达,发挥神经调节作用;活化的CREB 又可调控下游靶蛋白BNDF 表达,进而维持和促进神经元存活、分化,促进突触形成、重塑,并能维持突触的传递效能,从而保护神经[21]。本研究显示,模型组大鼠脑皮层组织PKA、p-CREB、BNDF 蛋白表达低于假手术组,表明模型组大鼠脑皮层组织中PKA/CREB/BNDF 信号通路被抑制,可能与神经元及突触功能受损有关。近年亦有其它研究发现,PKA/CREB/BNDF 信号通路参与脑缺血损伤过程中神经保护的调控作用,Bai 等[7]研究发现脂联素可上调PKA、p-CREB、BNDF 蛋白表达,改善CIRI 中神经功能损伤及脑损伤作用;官俏兵等[22]发现丁苯酞可上调p-CREB、BNDF 蛋白表达,改善小鼠CIRI 认知障碍。而丙泊酚是否影响CIRI 过程中的PKA/CREB/BNDF 信号通路尚未见报道。本研究中丙泊酚各剂量组大鼠脑皮层PKA、p-CREB、BNDF 蛋白呈剂量依赖性增高,且高于模型组,表明丙泊酚可激活CIRI 大鼠脑皮层组织中PKA/CREB/BNDF 通路蛋白表达,可能是其改善神经功能损伤的作用机制。
综上所述,丙泊酚可激活CIRI 大鼠脑皮层PKA/CREB/BNDF 通路蛋白表达,改善神经功能损伤,可能为阐明丙泊酚治疗CIRI 和发挥神经保护作用提供一定参考。但本研究仅对脑CIRI 过程PKA/CREB 通路蛋白表达情况进行研究,未设置通路抑制剂进行验证,且发挥脑保护和神经保护功能的靶点和通路亦具有多样性,丙泊酚发挥神经保护的具体生物学机制仍需继续研究。
