黄芪多糖联合5-FU 对肝癌HepG2 细胞EMT转化的影响
2021-03-19李永臻祁艳娟龙启福
白 芸 李永臻 祁艳娟 龙启福∗
(1.青海省人民医院药学部,西宁 810000;2.青海大学医学院基础医学研究中心,西宁 810016;3.青海大学附属医院放射治疗科,西宁 810000)
肝癌是由肝细胞或肝内胆管上皮细胞发生的恶性肿瘤[1]。目前,临床上肝癌的治疗存在预后差、转移复发等因素使得近5 年肝癌患者的生存率仍然低于20%[2-3]。鉴于此,不同治疗方式的协同治疗将成为降低肝癌死亡率的重要举措之一。近年来,中医药疗法在恶性肿瘤的治疗过程中被广泛应用。研究发现,中医药在减少肝癌转移复发、提高患者存活率方面发挥了一定的积极作用[4]。
5-氟尿嘧啶(5-fluorouracil,5-FU)通过干扰核酸的合成来抑制肿瘤细胞增殖,是具有细胞周期特异性的细胞毒类抗癌药物[5],临床使用非常广泛,但是随着化疗进行,出现严重的副作用,例如胃肠道反应,骨髓抑制等[6]。大量研究表明[1,7-8],5-FU单独用药正在被与其它药物的联合作用所取代,这不仅可以降低药物的副作用,而且还能降低肿瘤对药物的耐药性,相比于单独用药,联合用药具有更加广阔的应用前景。黄芪多糖(astragalus polysaccharides,APS)是我国传统中药黄芪的主要活性成分之一,具有增强免疫,抗应激,抗炎,抗氧化等药理作用[9],可协同增强多种化疗药物对肿瘤的治疗效果[10-11]。研究表明,上皮间质转化(epithelial-mesenchymal transitions,EMT)指机体细胞由上皮表型向间质表型的转变,其与肿瘤的发生、原位侵袭和远处转移密切相关[12]。因此,本研究拟就黄芪多糖联合5-FU 对肝癌细胞株HepG2 EMT 的影响进行研究,以期为黄芪多糖和5-FU 在临床的联合应用提供理论参考。
1 材料和方法
1.1 实验细胞株
人肝癌HepG2 细胞株购买自中国科学院典型培养物保藏中心。
1.2 主要试剂与仪器
5-氟尿嘧啶购自天津金耀氨基酸有限公司(批号:1803091);黄芪多糖冻干粉(纯度96.81%)购自天津赛诺制药有限公司(批号:Z20040086);胎牛血清(FBS)和青/链霉素购自HyClone 公司;MTT 粉剂、DMSO、DMEM 高糖细胞培养液、5×蛋白上样缓冲液、BCA 蛋白定量试剂盒购自北京索莱宝公司;RIPA 裂解液、SDS-PAGE 凝胶试剂盒购自Beyotime公司;Transwell 小室、PVDF 膜、ECL 发光液购自Miliipore 公司;鼠抗人CXCR4 单克隆抗体、兔抗Ecadherin、vimentin 单克隆抗体、羊抗兔辣根过氧化物酶标记(HRP)的二抗均购自Abcam 公司;兔抗GAPDH 购自上海康成生物工程有限公司;Total RNA 提取试剂(RNAiso Plus)、cDNA 反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)购自TaKaRa 公司;荧光定量PCR 试剂盒[HieefTMqPCR SYBR Green Master Mix(Low Rox Plus)]购自翊圣生物公司;实验所用引物由日本TaKaRa 公司合成。
二氧化碳培养箱、超低温冰箱、实时荧光定量PCR 购自美国Thermo 公司(型号:HERAcell 150i、DW-HL528、StepOne Plus);倒置显微镜购自Olympus 公司(型号:MF53);酶标仪购自美国Bio Rad 公司(型号:iMark);电泳仪、转膜仪购自北京六一生物科技公司(型号:DYCZ-25D、DYCZ-40G);水浴锅购自上海况胜有限公司(型号:HH-S1);高速冷冻离心机购自德国Eppendorf 公司(型号:5424R);摇床购自美国Scilogex 公司(型号:SKO180-E);化学发光成像仪购自北京赛智科技有限公司(型号:MiniChemi 610)。
1.3 实验方法
1.3.1 细胞培养
人肝癌HepG2 细胞生长环境为DMEM 高糖培养液(含10%胎牛血清和1%青/链霉素),细胞于37℃、5% CO2的培养箱中培养。采用倒置显微镜观察细胞的生长状况,当细胞数量占培养瓶底部70%~80%时用0.25%的胰酶消化传代,常规每2~3 d 1 次。取对数生长期的细胞进行实验。
1.3.2 实验分组
本研究旨在探讨黄芪多糖联合5-FU 对肝癌HepG2 细胞EMT 的影响,根据研究目的可分为五个实验组,详见表1。
1.3.3 MTT 测定药物对HepG2 细胞生长的抑制效应
对数生长期的HepG2 细胞经胰酶消化后接种至96 孔板(100 μL 细胞悬液/孔,约2×104个细胞),于37℃、5% CO2培养箱过夜培养。待细胞贴壁后弃去原培养基,并用PBS 缓冲液清洗2 遍。在各孔中加入不同浓度药物并做好标记,每组设置3个复孔于原培养环境下继续培养。分别于24 h、48 h 时加入20 μL 12.07 mmol/L 的MTT 溶液,继续培养4 h。弃尽上清液,每孔加入150 μL DMSO 溶液,37℃避光孵育10 min。使用酶标仪测定各孔细胞的吸光度OD 值,波长为490 nm,计算药物对HepG2细胞生长抑制率=(1-处理组OD 均值/空白组OD均值)×100%。
1.3.4 Transwell 检测HepG2 细胞侵袭能力
对数生长期的HepG2 细胞经胰酶消化后接种到6 孔板(100 μL 细胞悬液/孔,约2×104个细胞),常规培养,待细胞贴壁后在相应孔中加入所需药物,每组设3 个复孔。24 h 后,将Matrigel 溶液加入到Transwell 小室以覆盖聚碳酸酯膜,37℃干燥30 min。在Transwell 小室下层加入培养基(含10%FBS)作为趋化因子,小室上层孔中加入含1×105个细胞的无血清培养基。常规培养24 h 后用棉签拭去未迁移细胞,无水乙醇固定20 min,结晶紫染色30 min,PBS 缓冲液冲洗2 次。高倍显微镜下统计穿膜细胞数。
1.3.5 实时荧光定量检测HepG2 细胞EMT 相关基因的表达
对数生长期的HepG2 细胞经胰酶消化后接种至12 孔板,常规培养,待贴壁细胞数量占培养瓶底部90%时按分组给药,每组设3 个复孔。常规培养24 h 后弃去培养基,收集细胞,按照RNAiso Plus(TRIzol)试剂说明书提取细胞总RNA,并利用分光光度仪测定样品纯度和浓度。以1 μg RNA 为模板,按照cDNA 反转录试剂盒说明书进行反转录合成cDNA。按照荧光定量PCR 试剂盒说明书检测细胞中E-cadherin、vimentin mRNA、CXCR4 mRNA 的相对表达量。引物序列见表2。
1.3.6 Western blot 检测HepG2 细胞EMT 相关蛋白的表达
对数生长期的HepG2 细胞经胰酶消化后接种至12 孔板,常规培养,待贴壁细胞数量占培养瓶底部90%时按分组给药。常规培养24 h 后弃去上清,收集细胞,用RIPA 裂解液(含1 mmol/L PMSF)提取总蛋白,采用BCA 蛋白定量法测定所提蛋白的浓度。向待测样品中加入5×上样缓冲液煮沸10 min。上样,10% SDS-PAGE 电泳分离蛋白,400 mA 转膜1.5 h。转膜后将PVDF 膜置于5%脱脂牛奶中,室温封闭1.5 h,按1 ∶1000 封闭液中加入E-cadherin、vimentin、CXCR4、GAPDH(内参)一抗于4℃孵育过夜,TBST 洗涤后加入二抗(1 ∶5000),并于室温孵育1.5 h。ECL 试剂盒显色,化学发光成像仪上显影并采集图片,用Image pro plus 软件分析E-cadherin、vimentin、CXCR4 蛋白表达量。
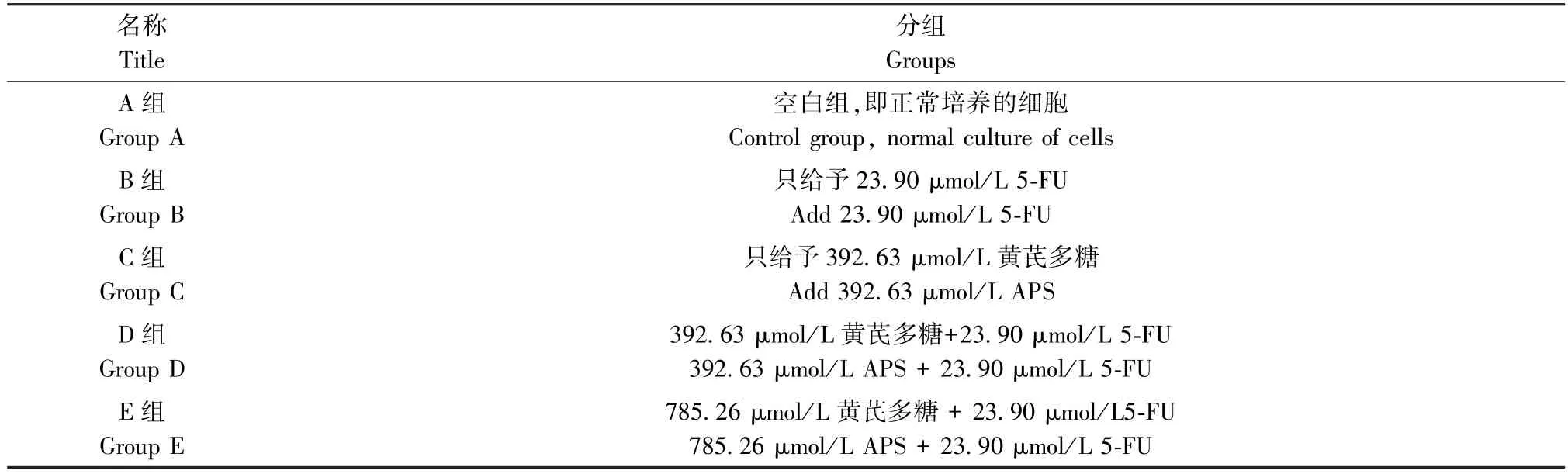
表1 实验的分组信息Table 1 Grouping information for the experiment

表2 EMT 相关基因实时荧光定量PCR 引物序列Table 2 Real time PCR primer sequence of EMT related genes
1.4 统计学方法
采用SPSS 18.0 软件进行数据分析,数据资料以平均数±标准差()表示,多组间的比较采用方差分析,组间两两比较采用LSD 法,P≤0.05 为差异具有统计学意义。并用软件Origin 9.0 对所得实验数据进行作图。
2 结果
2.1 黄芪多糖联合5-FU 对HepG2 细胞的生长抑制效应
给药后24 h,A 组(空白组)HepG2 细胞的生长抑制率为0,B 组(5-FU 组),C 组(黄芪多糖组),D组(392.63 μmol/L 黄芪多糖+23.90 μmol/L 5-FU)及E 组(785.26 μmol/L 黄芪多糖+23.90 μmol/L 5-FU)的生长抑制率分别是(11.56±2.18)%,(21.32±1.59)%,(39.75±1.85)%,(57.19 ±2.02)%,抑制率逐渐增高,且差异具有统计学意义,详见表3;给药48 h 后,从A 组到E 组的抑制率分别是:0%,(18.54 ± 2.13)%,(30.28 ± 1.8)%,(45.82 ±1.46)%,(63.97±1.75)%,抑制率逐渐增高,且差异具有统计学意义,详见表3。从以上数据可以得出,与空白组相比,其余各组作用于HepG2 细胞时,对其生长均有抑制作用,且随着药物作用时间的延长抑制效应增强;黄芪多糖或5-FU 单独处理组与联合用药组相比较,联合用药组的抑制效应显著强于单独处理组,且随着黄芪多糖浓度的增加抑制作用增强。
2.2 黄芪多糖联合5-FU 对HepG2 细胞侵袭能力的影响
Transwell 实验结果显示(图1),HepG2 细胞经结晶紫染色后呈现紫色,形状为不规则梭型,从A组(空白组)到E 组(785.26 μmol/L 黄芪多糖+23.90 μmol/L 5-FU),穿膜细胞的数量逐渐减少,说明细胞侵袭能力下降,具体穿膜数量详见表4。与空白组相比,5-FU 组、黄芪多糖组及黄芪多糖联合5-FU 组HepG2 细胞的侵袭能力显著下降(P≤0.01);与5-FU 组相比较,黄芪多糖联合5-FU 组HepG2 细胞的侵袭能力显著下降(P≤0.01),且随着黄芪多糖剂量的增加,侵袭能力逐渐下降。
表3 黄芪多糖联合5-FU 对HepG2 细胞增殖的抑制作用()Table 3 Inhibitory effect of astragalus polysaccharide combined with 5-FU on proliferation of HepG2 cells
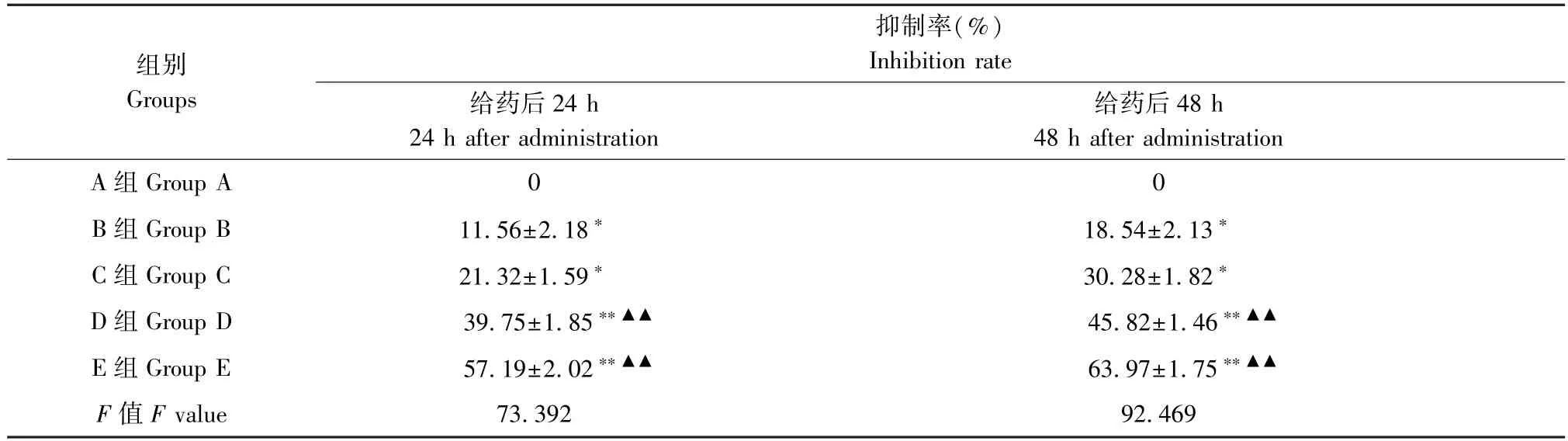
表3 黄芪多糖联合5-FU 对HepG2 细胞增殖的抑制作用()Table 3 Inhibitory effect of astragalus polysaccharide combined with 5-FU on proliferation of HepG2 cells
注:与A 组相比较,∗P≤0.05,∗∗P≤0.01;与B 组相比,▲▲P≤0.01。Note.Compared with group A,∗P ≤0.05,∗∗P ≤0.01.Compared with group B,▲▲P ≤0.01.
表4 黄芪多糖联合5-FU 对HepG2 细胞侵袭力的影响()Table 4 Effect of astragalus polysaccharide combined with 5-FU on the invasiveness of HepG2 cells

表4 黄芪多糖联合5-FU 对HepG2 细胞侵袭力的影响()Table 4 Effect of astragalus polysaccharide combined with 5-FU on the invasiveness of HepG2 cells
2.3 黄芪多糖联合5-FU 对HepG2 细胞EMT 相关基因mRNA 表达的影响
由图2 可知,与空白对照组相比,黄芪多糖组、5-FU 组和黄芪多糖联合5-FU 组HepG2 细胞E-cadherin mRNA 表达量增加、vimentin mRNA 和CXCR4 mRNA表达量下降,差异均具有统计学意义(P≤0.05;P≤0.01);与5-FU 组相比较,联合作用组HepG2 细胞Ecadherin mRNA 表达量均增加、vimentin mRNA 和CXCR4 mRNA 表达量均下降(P≤0.05;P≤0.01)。
2.4 黄芪多糖联合5-FU 对HepG2 细胞EMT 相关蛋白表达的影响
由图3 和表5 可知,与空白对照组相比,黄芪多糖组、5-FU 组和黄芪多糖联合5-FU 组HepG2 细胞E-cadherin 蛋白表达量上调、vimentin 蛋白、CXCR4 蛋白表达量下降,差异具有统计学意义(P≤0.01);与5-FU 组相比较,联合组HepG2 细胞E-cadherin 蛋白表达量均增加、vimentin 蛋白和CXCR4 蛋白表达量均下降,差异具有统计学意义(P≤0.05;P≤0.01)。
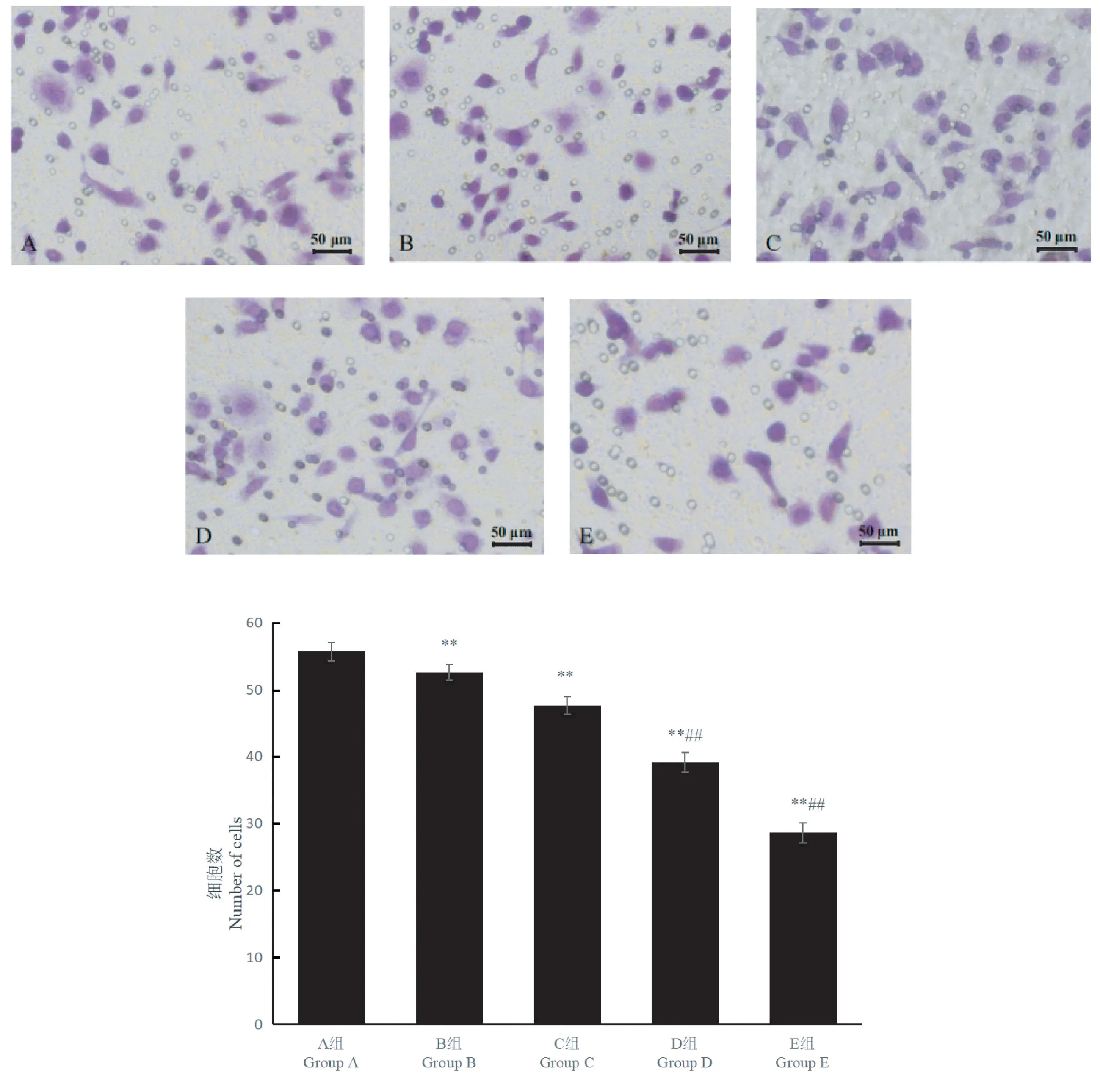
图1 黄芪多糖联合5-FU 对HepG2 细胞侵袭力的影响Note.Compared with group A,∗∗P ≤0.01.Compared with group B,##P ≤0.01.Figure 1 Effect of astragalus polysaccharide combined with 5-FU on the invasiveness of HepG2 cells
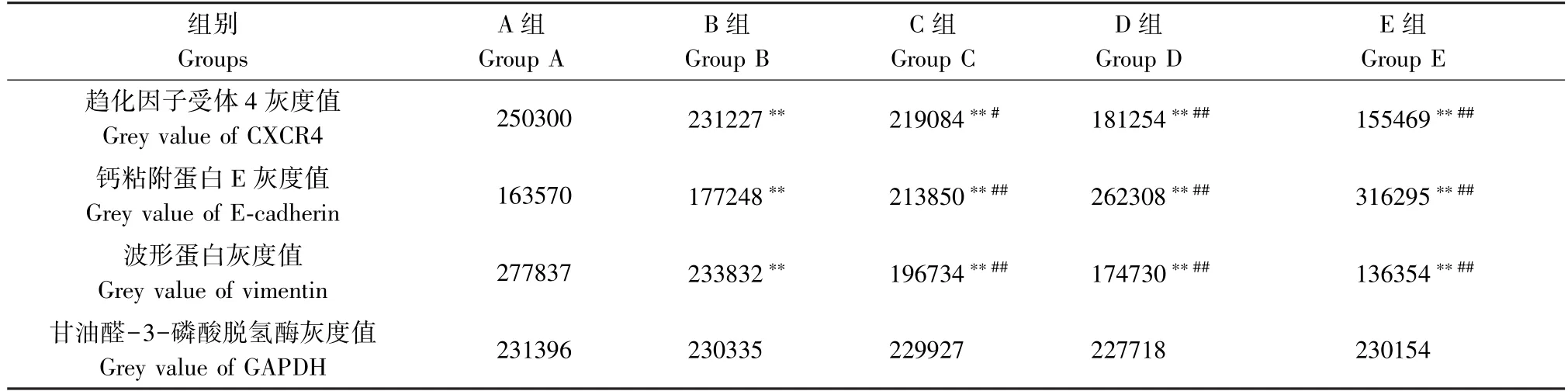
表5 黄芪多糖联合5-FU 对HepG2 细胞EMT 相关蛋白表达的影响Table 5 Effect of astragalus polysaccharide combined with 5-FU on the expression of EMT-related proteins in HepG2 cells
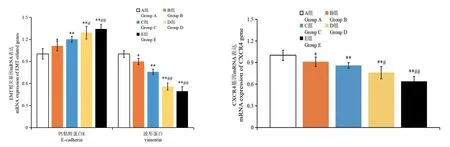
图2 黄芪多糖联合5-FU 对HepG2 细胞EMT 相关基因mRNA 表达的影响Note.Compared with group A,∗P <0.05,∗∗P <0.01.Compared with group B,#P <0.05,##P <0.01.Figure 2 Effect of Astragalus polysaccharide combined with 5-FU on mRNA expression of EMT-related genes in HepG2 cells
3 讨论
肝癌治疗难度大,预后差,一直是临床上面临的重大难题和挑战,其主要因素是肝癌细胞的侵袭和转移能力,而EMT 是癌细胞获取迁移和侵袭能力的重要机制[12]。临床上对癌症患者进行放化疗治疗时,会不同程度的影响其免疫系统,且随着肿瘤耐药及药物敏感性降低等情况的出现,临床上常出现治疗失败的情况,因此采用中药及其活性成分与化疗药物联合使用,以达到调节免疫力进而增敏增效和减毒的作用。黄芪多糖是黄芪中最重要的天然活性成分,毒性较小,可以具有抗肿瘤的作用[13]。因此,在本研究中,我们采用HepG2 细胞体外培养的方法,研究了黄芪多糖联合5-FU 对HepG2 细胞EMT 转化影响,研究结果显示黄芪多糖和5-FU 联用时,可明显抑制HepG2 细胞的生长,抑制效应具有剂量和时间依赖性,进一步研究发现,黄芪多糖和5-FU 联用可以显著降低肝癌细胞的侵袭能力,且随着黄芪多糖浓度的增加侵袭能力越弱。
中药黄芪的药用历史在我国已经有两千多年,是中医补气的常用药,主要药效成分黄芪多糖,是一种良好的免疫调节剂[14],可以促进树突状细胞成熟增强机体的免疫功能参与抗肿瘤的作用,研究显示,其在体外可以抑制人胃癌细胞株的增殖,并能诱发人胃癌细胞凋亡的作用[15]。魏佳等[16]研究显示黄芪多糖与吉非替尼联用促进肺腺癌细胞中Ecadherin 表达水平降低,Vimentin 表达水平升高,抑制EMT 的进程,显著抑制癌细胞的增殖。Ecadherin 和Vimentin 在EMT 过程中发挥着重要作用,E-cadherin 表达减少或缺失是肿瘤转移和侵袭的促进因子之一[17],而抑制Vimentin 的完整性可抑制间充质细胞迁移[18]。邱艳丽等[19]研究发现,黄芪多糖对子宫内膜癌组织中E-cadherin 基因和蛋白的表达具有促进作用,对β-catenin 基因和蛋白的表达具有抑制作用,表明黄芪多糖可以通过调节EMT相关蛋白为发挥抗肿瘤作用。汪一帆等[20]研究显示抑肺饮(党参、黄芪、川芎、蜈蚣等)联合顺铂对肺癌移植瘤生长和Vimentin 蛋白表达具有明显抑制作用,并且可上调E-cadherin 的表达,这表明抑肺饮的作用机制可能与肿瘤细胞EMT 相关。本研究结果显示,黄芪多糖联合5-FU 可显著增加HepG2 细胞中E-cadherin mRNA 和蛋白的表达,显著降低HepG2 细胞中vimentin mRNA 和蛋白的表达,而且,两种药物的联合效果也显著优于各自单独使用时的效果,说明黄芪多糖可以通过调节肝癌细胞HepG2 的EMT 进程增强5-FU 的治疗效果。
CXCR4 可以通过SDF-1/CXCR4 生物轴,调控肿瘤细胞的EMT 过程,进而增强肿瘤细胞增殖和侵袭等行为[21]。研究显示,在肝癌、肺癌、乳腺癌等细胞中CXCR4 均存在高表达,而在正常组织中低表达或者不表达[20,22-23]。Kaemmerer 等[24]研究发现CXCR4 在肝癌中的表达率约50%,这种高表达预示着不良预后。CXCR4 还参与了机体免疫应答及肿瘤耐药性[25],因此,CXCR4 可能作为一个疾病进展的标志物。本研究中显示,黄芪多糖联合5-FU 可显著降低HepG2 细胞中CXCR4 mRNA 和蛋白的表达,与单使用5-FU 治疗组相比,黄芪多糖联合5-FU组效果更为显著,说明黄芪多糖增强了细胞对5-FU的敏感性,从而有效起到抑制肝癌细胞HepG2 增殖和侵袭的行为。
综上所述,黄芪多糖可以增强5-FU 抗肿瘤作用;黄芪多糖和5-FU 联合使用可抑制肝癌细胞的转移作用,可能与抑制肝癌EMT 有关。这为黄芪多糖对肝癌临床辅助治疗提供了重要支持。
