Fe3+和Al3+分步沉淀pH曲线的测定与分析
2021-03-18熊宗齐
熊宗齐

摘要: 运用pH传感器,测定NaOH溶液分别滴定FeCl3溶液、Al2(SO4)3溶液以及两者混合溶液的pH曲线。结合理论计算和实验图像分析Fe3+、 Al3+开始沉淀的pH及沉淀完全的pH,通过“宏观-微观-符号-曲线”四重表征分析pH曲线变化,探讨Fe3+、 Al3+分步沉淀的可行性及最佳pH范围。
关键词: pH传感器; Fe3+和Al3+分步沉淀; pH曲线; 实验探究
文章编号: 1005-6629(2021)02-0070-06
中图分类号: G633.8
文献标识码: B
1 问题提出
分离溶液中的金属离子时,常通过加入强碱调节pH,使金属离子形成相应的氢氧化物沉淀,使其脱离出溶液体系,是工业除杂的常见操作之一。这种通过加强碱调节溶液pH的方式逐一沉淀某些金属离子的操作,称为分步沉淀或选择性沉淀[1]。其基本原理是第一种金属离子完全沉淀时,第二种离子尚未开始沉淀,满足这个条件,就可以通过分步沉淀的方法分离金属离子。由于高中教材没有设计相关实验,高考试题又常常涉及,学生对这类问题往往缺乏深入的理解。以Fe3+、Al3+为例,2020年全国Ⅰ卷第26题和全国Ⅲ卷第27题均有考查。试题相关部分信息如表1所示。
通过对比发现,2020年全国Ⅰ卷第26题和2020年全国Ⅲ卷第27题都涉及Fe3+、Al3+的沉淀问题,但前者并未给出金属离子的初始浓度,而后者给出开始沉淀时金属离子的浓度。由于金属离子沉淀的pH与金属离
子的初始浓度密切相关,显然后者提供的信息更加规范。同时,按照全国Ⅰ卷第26题的信息,当Fe3+尚未完全沉淀时(如pH在3.0~3.2)Al3+开始沉淀了,Fe3+、Al3+不能实现分步沉淀。而按照全国Ⅲ卷第27题的信息,两者又是可以分步沉淀的。为了解决这个矛盾,同时帮助学生深入理解分步沉淀,拟设计NaOH溶液滴定FeCl3溶液、Al2(SO4)3溶液以及两者混合溶液的实验,借助手持技术认识滴定过程中的pH曲线变化特征。通过理论计算和实验验证,培养学生逻辑思辨与分析问题能力。借助“宏-微-符-曲”四重表征深入理解曲线变化的原因,最終能够建立简单模型去分析和解决这一类问题。
2 理论计算
依据难溶物沉淀溶解平衡原理,金属离子与其氢氧化物沉淀存在如下平衡[2]:
M(OH)n(s) Mn+(aq)+nOH-(aq)
查化学《兰氏化学手册》第15版[3]知: 25℃时,Ksp[Fe(OH)3]=2.79×10-39, Ksp[Al(OH)3]=1.30×10-33。
理论上,若c0(Fe3+)=0.025mol·L-1时,当Qc≥Ksp[Fe(OH)3]时,Fe3+开始沉淀,此时求得理论pH=1.68。当溶液中c(Fe3+)≤1.0×10-5mol·L-1时,认为已完全沉淀,求得此时的pH=2.81。同理,若c0(Al3+)=0.025mol·L-1时,可以求得Al3+开始沉淀的pH为3.57,完全沉淀的pH为4.71。故理论上认为,当控制溶液的pH在2.81~3.57之间,可以实现先沉淀分离出Fe3+,再调节pH至4.71,沉淀分离出Al3+,实现离子的分步沉淀。
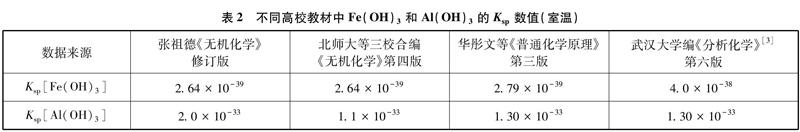
对于难溶物的溶度积常数,不同的高校教材中给出的数据也有差别(见表2)。
=
对比上表中数据发现,Ksp[Fe(OH)3]的数值武大《分析化学》与其余三种教材差别较大,按照4.0×10-38来计算c0(Fe3+)=0.025mol·L-1时开始沉淀的pH=2.07,这与前面Ksp[Fe(OH)3]=2.79×10-39时开始沉淀的pH=1.68还是有较大差别的。同样,Ksp[Al(OH)3]的值也有差异。因此,由Ksp数据带来的误差是需要考虑的。
3 实验设计
3.1 实验方案
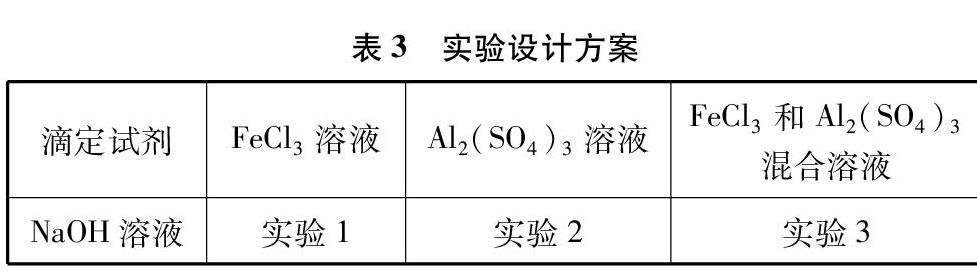
实验设计方案如表3所示。
3.2 实验仪器及药品
实验仪器: 威尼尔pH传感器(0~14)、滴数传感器、数据采集器、磁力搅拌器,台秤、100mL烧杯、50mL量筒、100mL容量瓶、10mL移液管、吸耳球、玻璃棒、药匙、称量纸等
实验药品: 0.10mol·L-1 FeCl3溶液、0.050mol·L-1 Al2(SO4)3溶液、0.11mol·L-1 NaOH溶液(邻苯二甲酸氢钾已标定)、稀盐酸、稀硫酸、KSCN溶液、铝试剂、蒸馏水
3.3 实验内容
3.3.1 溶液配制
分别取50mL浓度为0.10mol·L-1 FeCl3溶液和0.050mol·L-1 Al2(SO4)3溶液于烧杯中,用盐酸调节FeCl3溶液pH为1.5左右,用硫酸调节Al2(SO4)3溶液pH为3.3左右,以防止Fe3+和Al3+水解,备用。
3.3.2 实验步骤
实验装置如图1所示,传感器与数据采集器相连,采集器与电脑相接,配合软件使用。
[实验1]0.11mol·L-1 NaOH溶液滴定0.025mol·L-1 FeCl3溶液。
具体实验步骤如下:
(1) 用移液管取10mL 0.10mol·L-1 FeCl3溶液于100mL烧杯中,加入蒸馏水稀释至40mL,放入磁子,插入pH传感器,备用。
(2) 用已标定的0.11mol·L-1 NaOH溶液润洗滴数传感器的滴定管,加入碱液,排除气泡。
(3) 按图1连接仪器,打开电脑软件,开启磁力搅拌器。等pH数值稳定后开始采集数据,逐滴加入0.11mol·L-1 NaOH溶液,通过滴数传感器记录NaOH溶液的体积,观察实验进行情况。
(4) 实验完毕,保存数据,拆除装置,清洗仪器。
[实验2]0.11mol·L-1 NaOH溶液滴定0.0125mol·L-1 Al2(SO4)3溶液。实验步骤同实验1。
[实验3]0.11mol·L-1 NaOH溶液滴定40mL 0.025mol·L-1 FeCl3和0.0125mol·L-1 Al2(SO4)3混合溶液。用移液管各取10mL 0.10mol·L-1 FeCl3溶液和10mL 0.050mol·L-1 Al2(SO4)3溶液于100mL烧杯,加入蒸馏水稀释至40mL。其余实验步骤同实验1。
4 实验结果与数据分析
为保证实验的准确性,每个实验重复3次以上,取其平均值后进行数据处理。分析过程中兼顾pH理论计算值和实验现象,初步判定离子分步沉淀的pH实验值。
4.1 NaOH溶液滴定FeCl3溶液pH曲线及分析
实验1是用0.11mol·L-1 NaOH溶液滴定0.025mol·L-1 FeCl3溶液,pH曲线变化如图2所示(实验时环境温度为24℃,下同)。
因初始阶段的FeCl3溶液加入盐酸抑制水解,溶液呈强酸性,故开始并没有沉淀。A点时可观察到溶液颜色加深,变得不透明,激光束照射后,丁达尔效应明显,
此时pH为2.44。B点后滴入NaOH溶液不再有明显的沉淀产生,此时可认为Fe3+沉淀完全,溶液pH发生突变,B点pH为3.68,到了C点,溶液pH就接近NaOH溶液的pH了,故滴定过程中Fe3+沉淀的pH范围为2.44~3.68。这与理论计算的范围1.68~2.81有一定的出入,主要原因可能是溶液初始浓度不同、沉淀过程中碱式盐的生成、难溶弱碱的诸多配离子、氢氧化铁聚合以及仪器实验操作等因素造成的。如《普通化学原理》给出的0.01mol·L-1Fe3+实际沉淀的pH范围为2.2~4.0[4],与实验1结果比较吻合。
4.2 NaOH溶液滴定Al2(SO4)3溶液pH曲线及分析
实验2是用0.11mol·L-1 NaOH溶液滴定0.0125mol·L-1 Al2(SO4)3溶液,pH曲線变化如图3所示。
因初始阶段的Al2(SO4)3溶液加入硫酸抑制水解,溶液呈强酸性,故开始并没有沉淀。D点时可观察到溶液出现轻微白色浑浊,即开始生成Al(OH)3,此时pH为4.28,激光束照射后,有丁达尔效应。E点后滴入
NaOH溶液不再有明显沉淀产生,此时可认为Al3+沉淀完全,溶液pH发生突变,E点pH为5.20,故滴定过程中Al3+沉淀的pH范围为4.28~5.20。这与理论计算的范围3.57~4.71也有一些偏差,原因应该与Fe3+类似,但实验与理论值的偏差比Fe3+的要小。由于Al(OH)3
为两性氢氧化物,故继续滴加NaOH溶液到F点,Al(OH)3开始溶解,曲线上升变缓,F点pH为10.24。到G点pH为11.27时,曲线又突然快速上升,说明Al(OH)3已完全溶解,因此,Al(OH)3开始溶解和完全溶解的pH范围为10.24~11.27。
实验测定的Al3+沉淀和Al(OH)3溶解的pH范围,能够帮助学生更加准确地理解Al(OH)3具有两性性质。高中教学经常这样描述Al(OH)3的两性: Al(OH)3既能溶于强酸,也能溶于强碱,但不能溶于弱酸和弱碱。从实验数据看,Al(OH)3开始溶解和完全溶解的pH范围为10.24~11.27,氨水溶液最大浓度接近15mol·L-1,理论计算pH约11.9,因此可以溶解沉淀。相关学者[5]的研究也显示此浓度氨水可以部分溶解Al(OH)3。学生实验一般使用低浓度的氨水,常不能溶解Al(OH)3。同理,实验证实1.0mol·L-1醋酸溶液也可以溶解Al(OH)3。因此,只泛泛地说Al(OH)3不能溶于弱酸和弱碱是不严谨的,要让学生认识到,Al(OH)3的溶解性本质上与溶液中的c(H+)或c(OH-)有关,当c(H+)或c(OH-)达到一定值,无论是强酸强碱还是弱酸弱碱,Al(OH)3均会溶解。
4.3 NaOH溶液滴定FeCl3和Al2(SO4)3混合溶液pH曲线及分析
实验3是最为关键的,用0.11mol·L-1 NaOH溶液滴定40mL 0.0125mol·L-1 Al2(SO4)3和0.025mol·L-1 FeCl3混合溶液,pH曲线变化如图4所示。
由图4数据分析可得,实验3中Fe3+沉淀的pH范围为3.18(a点)~3.68(b点),Al3+沉淀的pH范围为4.31(c点)~5.19(d点)。因此,可以通过调节pH的方法分步沉淀Fe3+和Al3+。与实验1和2对比发现,实验3中Fe3+开始沉淀的pH变大了(延迟沉淀),Al3+开始沉淀的pH也变大了些,但两者沉淀完全的pH基本没变。这可能是由混合溶液中金属离子的水解、滴定过程中的共沉淀等因素导致的,有待进一步研究。Al(OH)3开始溶解和完全溶解的pH范围为10.18(e点)~11.12(f点),与实验2中的值略有差别,相对保持稳定。
为了更清晰地理解上述问题,通过“宏观-微观-符号-曲线”四重表征来描述实验3滴定的每个阶段的曲线变化情况,见表4。
在pH为4.04时,取少量样品溶液,过滤,得无色滤液,向其中滴加2滴KSCN溶液,溶液未出现红色,说明Fe3+完全沉淀。将滤出Fe(OH)3沉淀洗涤后放于试管中,滴加少量稀盐酸部分溶解,静置,取上层清液滴入铝试剂,溶液出现很浅玫红色,说明溶液中含Al3+。同样,在pH为8.41之间,取少量样品溶液过滤,向滤液中滴加铝试剂,溶液未出现玫红色,说明溶液中不含Al3+。综合以上实验结果,说明NaOH溶液滴定Al2(SO4)3和FeCl3混合溶液的过程中,共沉淀现象较弱,可以通过控制溶液pH来实现Fe3+和Al3+的分步沉淀,还可以通过再沉淀来减少共沉淀的影响,即将已得到的Fe(OH)3沉淀过滤洗涤后溶解,再进行第二次沉淀。
5 实验结果与探讨
实验测定了NaOH溶液滴定單一的FeCl3溶液、Al2(SO4)3溶液以及两者的混合溶液的pH变化,初步得出以下结论。
(1) pH曲线的主要特征为: 当金属离子与OH-结合形成沉淀时,曲线变得很平缓,而当沉淀完全时,曲线会急剧上升。通过这两个拐点的变化规律,可以帮助学生很好地理解金属离子开始沉淀和完全沉淀的pH范围。对于Al(OH)3而言,还存在一个沉淀开始溶解和完全溶解的pH,可以帮助学生从定量的角度准确理解两性氢氧化物的酸碱性。
(2) 金属离子开始沉淀和完全沉淀的pH范围主要受金属离子初始浓度、氢氧化物溶度积常数的影响,另外沉淀过程中碱式盐的生成、难溶弱碱的诸多配离子、氢氧化物聚合、共沉淀以及仪器、实验操作等因素也会有一定影响,导致理论计算值与实验测量值有一定的偏差。
(3) 在本实验的条件下,可以通过调节溶液pH实现Fe3+和Al3+的分步沉淀,但可调控的pH范围较窄(3.68~4.31),较难控制,工业上大多还是利用Al(OH)3的两性,加入过量碱只沉淀Fe3+来更好地实现分离。如2020年全国Ⅰ卷第26题制取NH4VO3,先调pH>13来除去Fe(OH)3,再调pH=8.5使[Al(OH)4]-转化为Al(OH)3沉淀除去。全国Ⅲ卷第27题制取硫酸镍晶体,则是先加足量NaOH溶液,溶解Al2O3,过滤得滤渣(Ni、Fe的氧化物),用硫酸溶解滤渣,加H2O2溶液将Fe2+转化为Fe3+,之后调pH沉淀除去Fe3+。
诚然,实验中还有一些问题有待进一步研究。如混合液滴定时,离子沉淀的pH范围的变化原因;为何开始沉淀时pH变化程度大,而完全沉淀的pH受影响较小;在图3的FG段和图4的ef段均出现一个较为平缓的阶段是何原因等。
6 实验的教学意义
(1) 借助手持技术,精准清晰地让学生感受到滴定过程中pH曲线的变化,可以提升学生实验综合能力,激发学生探究欲望。
(2) 利用理论计算过程可以训练学生平衡计算的能力,结合实验真实数据,进一步培养学生在陌生情境下运用所学知识分析和解决问题的能力,从而提升化学学科核心素养。
(3) 通过“宏观-微观-符号-曲线”四重表征模型分析实验过程,学会将所学知识应用、迁移到一类问题中去,提升学生模型认知及运用模型的能力。
(4) 通过实验过程中不断遇到的新问题,发展学生思维,积极主动地解决问题,既体现探究实验的不确定性,又能感知化学实验的魅力所在。
参考文献:
[1]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学·上册(第四版)[M].北京: 高等教育出版社,2002.
[2]J.A.迪安.兰氏化学手册(第二版)[M].北京: 科学出版社,2003.
[3]武汉大学.分析化学(第6版)[M].北京: 高等教育出版社,2016.
[4][5]华彤文,陈景祖等.普通化学原理(第3版)[M].北京: 北京大学出版社,2005.
