趋化因子CXCL13及其受体CXCR5在1型糖尿病DPNP中的作用机制
2021-03-18周泽麟李巧云李雅汪雯赵忠球梅之南
周泽麟?李巧云?李雅?汪雯?赵忠球?梅之南

【摘要】目的 探討趋化因子CXCL13及其受体CXCR5在1型糖尿病引发的糖尿病性周围神经病理性疼痛(DPNP)中的作用机制。方法 将36只C57BL/6小鼠随机分为C57BL/6空白对照组和C57BL/6模型组(每组18只)。C57BL/6模型组采用腹腔注射链脲佐菌素(60 mg/kg)构建1型糖尿病模型。每周观测小鼠的体质量、血糖、机械痛和热痛阈值。于第15周检测2组脊髓中趋化因子、趋化因子受体和促炎因子水平的变化以及血清中炎症因子的变化。在上述试验基础上,再分别取12只C57BL/6小鼠和12只CXCR5-/-小鼠按前述方法分别设立对照组和模型组(每组6只),于第4周检测各组机械痛敏、第6周检测热痛敏。结果 C57BL/6模型组小鼠的脊髓中CXCL13和CXCR5等趋化因子及其受体的mRNA明显上调(P均< 0.05)。C57BL/6模型组小鼠血糖升高、体质量减少,第4周的机械痛阈值降低、第6周的热痛阈值降低(P均< 0.05),但CXCR5-/-模型组小鼠机械痛和热痛阈值无变化。与C57BL/6空白对照组比较,C57BL/6模型组小鼠的星形胶质细胞标志物胶质纤维酸性蛋白、小型胶质细胞标志物离子钙结合衔接分子1以及炎症因子标志物环氧化酶-2、IL-1β以及磷酸化的丝裂原活化蛋白激酶(ERK)和信号转导和转录激活因子3(STAT3)的水平升高(P均< 0.05);血清中炎症因子IL-6、TNF-α和IL-1β蛋白水平升高(P均< 0.01)。结论 趋化因子CXCL13及其受体CXCR5的激活或可促使1型糖尿病DPNP的发生,相关机制可能是通过激活胶质细胞与磷酸化的ERK、STAT3和炎症因子表达实现的。
【关键词】CXCL13;CXCR5;1型糖尿病;糖尿病性周围神经病理性疼痛;胶质细胞
Role and mechanism of chemokine CXCL13 and its receptor CXCR5 in type 1 diabetic neuropathic pain Zhou Zelin, Li Qiaoyun, Li Ya, Wang Wen, Zhao Zhongqiu, Mei Zhinan. School of Pharmacy, South-Central University for Nationalities, Wuhan 430074, China
Corresponding author, Mei Zhinan, E-mail: meizhinan@ 163. com
【Abstract】Objective To explore the role of chemokine CXCL13 and its receptor CXCR5 in diabetic peripheral neuropathic pain (DPNP) induced by type 1 diabetes. Methods Thirty six C57BL/6 mice were randomly divided into the C57BL/6 blank control group (n = 18) and C57BL/6 model group (n = 18). The animals in the model group were intraperitoneally injected with streptozotocin (60 mg/kg) for consecutive 4 days to induce DPNP. The body weight, blood glucose level and pain threshold were observed every week in two groups. After 15 weeks, the expression changes of chemokine CXCL13, chemokine receptor Cxcr5 and pro-inflammatory factors at the mRNA and protein levels in the spinal cord tissue were detected in two groups. Twelve C57BL/6 mice and 12 CXCR5-/- mice were randomly divided into the blank control group (both n = 6) and model group (both n = 6). The experimental procedures and detection indexes were the same as those of 36 C57BL/6 mice. Results The expression levels of CXCL13 and its receptor CXCR5 mRNA in the C57BL/6 model group were significantly higher than those in the C57BL/6 blank control group (both P < 0.05). Compared with the C57BL/6 blank control group, the blood glucose level was significantly higher and the body mass was remarkably less in the C57BL/6 model group (both P < 0.05). In the C57BL/6 model group, threshold of mechanical abnormal pain decreased at the 4th week, and threshold hot pain was decreased at the 6th week. CXCR5-/- mice did not show significant changes in pain sensitivity. In the C57BL/6 model group, astrocyte-specific glial fibrillary acidic protein (GFAP) and microglia marker ionized calcium binding adapter molecule 1 (IBA1) in the spinal cord tissues were activated. Compared with the C57BL/6 blank control group, the expression levels of COX-2, IL-1β, phosphorylated extracellular signal-regulated kinase (pERK), phosphorylated protein kinase B (pAKT) and phosphorylated signal transducer and activator of transcription 3 (pSTAT3) were remarkably up-regulated, and the serum levels of IL-6、 TNF-α and IL-1β were significantly increased (all P < 0.05). Conclusions CXCL13 and CXCR5 can induce DPNP of type 1 diabetic, probably by activating the glial cells, pERK, pSTAT3 and inflammatory factors.
【Key words】CXCL13;CXCR5;Type 1 diabetes;Diabetic peripheral neuropathic pain;Glial cells
糖尿病是一种常见的代谢性疾病,可引发许多相關并发症。糖尿病性周围神经病理性疼痛(DPNP)是一种慢性疼痛综合征,机械痛和热痛觉过敏是其主要临床表现[1-2]。糖尿病神经病变的发病机制十分复杂,目前认为,趋化因子通过脊髓中不同形式的神经元-胶质细胞相互作用来引发DPNP[3]。最近有研究表明,趋化因子参与2型糖尿病DPNP的发病过程[4]。在外周组织炎症和神经损伤引起的慢性疼痛的病理过程中,趋化因子CXCL13及其受体CXCR5(CXCL13/CXCR5)参与了三叉神经痛和脊髓神经结扎(SNL)诱发的神经病理性疼痛[5]。本课题组的前期研究表明,在db/db小鼠模型中,CXCL13/CXCR5有引发2型糖尿病DPNP的作用[6]。但是,1型糖尿病引起的DPNP与CXCL13 /CXCR5的关系我们尚未见报道。鉴于此,本课题组通过链脲佐菌素(STZ)构建1型糖尿病小鼠模型,探讨CXCL13/CXCR5在1型糖尿病DPNP中的作用机制。
材料与方法
一、材 料
1.实验动物
雄性7周龄无特定病原体级的健康清洁C57BL/6小鼠48只,体质量(22±2)g,购自北京维通利华动物科技有限公司,实验动物生产许可证:SYXK (Beijing) 2016-0006,实验单位使用许可证号:SYXK (E) 2016-0089。CXCR5-/-小鼠[B6.129S2 (Cg)-CXCR5tm1Lipp/J]12只,购自美国Jackson Laboratory。饲养环境:温度(22±2)℃,湿度(55±15)%,光照间隔12 h。小鼠在整个实验过程中自由饮水摄食。实验操作严格遵循中南民族大学实验动物中心的管理指南和行为规范,所有操作均符合实验动物伦理要求。对小鼠的分组均采用随机数字表法。
2.试 剂
STZ购自美国Sigma。蛋白激酶B(AKT)抗体
(#4685)、磷酸化的AKT(pAKT,Ser473,#4060)、信号转导和转录激活因子3(STAT3,#12640)、磷酸化的STAT3(pSTAT3,Tyr705,#52075)、丝裂原活化蛋白激酶1/2抗体p44/42 MAPK (ERK, #4695)、p-p44/42 MAPK(ERK, Thr202/Tyr204, #4370)购自美国 Cell Signaling Technology。CXCL13 (orb 101825) 购自英国Biorbyt。CXCR5 (EPR8837)购自美国Abcam。内参蛋白甘油醛-3-磷酸脱氢酶(GAPDH,#6176106)购自美国Affinity。小鼠IL-6、TNF-α和IL-1β ELISA检测试剂盒、定量逆转录PCR试剂盒购自美国Thermo。Trizol购自日本Takara。引物由北京擎科生物公司合成。
二、方 法
1. 1型糖尿病小鼠模型的构建
使用柠檬酸缓冲溶液(pH = 4.5)溶解STZ,C57BL/6模型组小鼠(18只)连续4 d接受腹腔注射STZ,剂量为60 mg/kg;C57BL/6空白对照组(18只)注射等剂量的柠檬酸缓冲溶液。C57BL/6模型组注射STZ 1周后,随机血糖平均水平> 16.7 mmol/L,即造模成功。注射STZ 8周后,C57BL/6模型组小鼠表现出DPNP。在此实验基础上,另取CXCR5-/-小鼠(6只)和同周龄的C57BL/6小鼠(6只)注射STZ以构建1型糖尿病模型;再取CXCR5-/-小鼠(6只)和同周龄的C57BL/6小鼠(6只)设为对应的空白对照组,注射等剂量的柠檬酸缓冲液。
2.行为学测试
于每周同一日8:00 ~ 9:00测量所有小鼠的体质量和空腹血糖,并于注射STZ后第4周检测小鼠机械痛敏,第6周检测热痛敏。机械痛敏测试:使用von Frey细丝(0.16、0.4、0.6、1.0、1.4和2.0 g),以升序均速刺激小鼠后爪,直到小鼠后爪有明显的缩回动作算作有效刺激。在此阈值上下各刺激5次,用中位数法计算50%的反应阈值。热痛敏测试:采用热源从底部玻璃透射到小鼠后爪,从开始投射热源至小鼠缩回后爪的时间定义为后爪缩回潜伏时间(截止时间15 s),每只小鼠在热刺激强度相同情况下测定5次热痛敏,取平均值为有效阈值。
3.定量逆转录PCR实验检测趋化因子及趋化因子受体的mRNA
注射STZ 15周后用异氟烷麻醉C57BL/6小鼠并取出其脊髓,用Trizol法提取脊髓RNA,按照试剂盒说明将其逆转录成互补DNA,反应体系为 20 μl,反应条件为42℃ 60 min,70℃ 5 min。根据定量逆转录PCR试剂盒说明,检测30种趋化因子及13种趋化因子受体mRNA的相对表达量,反应体系为 20 μl,反应条件为:先95℃ 2 min,后95℃ 15 s,60℃ 15 s,72℃ 1 min,共44个循环。
4.蛋白免疫印迹法检测相关蛋白
注射STZ 17周后用异氟烷麻醉处死C57BL/6小鼠,将其脊髓组织放入含有磷酸酶抑制剂和蛋白酶抑制剂的RIPA裂解液中匀浆。使用BCA蛋白测定法对样品进行相关蛋白的定量,包括:星形胶质细胞标志物胶质纤维酸性蛋白(GFAP),小型胶质细胞标志物离子钙结合衔接分子1(IBA1),炎症因子相关蛋白环氧合酶-2(COX-2)、IL-1β以及CXCR5等。接着将蛋白质通过10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转移到PVDF膜上。用5%脱脂牛奶封闭2 h后,结合一抗4℃过夜,然后将PVDF膜用TBST洗涤3次,避光结合二抗孵育2 h。通过BeyoECL Plus (中国,Beyotime,P0018)使蛋白条带成像,并在成像系统上进行光密度分析。
5. ELISA法检测血清炎症因子
注射STZ 17周后用异氟烷麻醉C57BL/6小鼠并通过眼眶取血,将血液室温放置2 h后离心得到血清。使用ELISA试剂盒检测炎症因子IL-6、TNF-α和IL-1β的表达情况。
三、统计学处理
采用GraphPad Prism 5.0分析数据,所有数据均以表示,2组间比较使用独立样本t检验,P < 0.05为差异有统计学意义。
结果
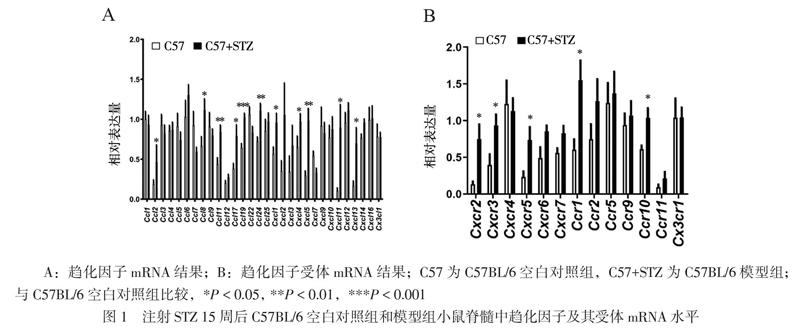
一、趋化因子及其受体在C57BL/6小鼠脊髓中的变化情况
注射STZ 15周后,与C57BL/6空白对照组小鼠相比,C57BL/6模型组小鼠脊髓中的趋化因子CCL2、CCL11、CCL8、CCL17、CCL19、CCL24、CXCL1、CXCL4、CXCL5、CXCL11和CXCL13的mRNA水平(相对表达量、t值及P值依次为0.687±0.439,t = 2.673,P = 0.023;0.844±0.203, t = 3.541,P = 0.005; 1.116±0.343, t = 2.472,P = 0.033;0.793±0.338, t = 2.698,P = 0.022;1.027±0.118,t = 5.970,P < 0.001;1.101±0.241,t = 3.341,P = 0.007;0.960±0.284,t = 2.752,P = 0.020;0.973±0.238,t = 3.111,P = 0.013;0.983±0.372,t = 4.244,P = 0.002;0.898±0.643,t = 2.732,P = 0.026;0.699±0.481,t = 2.586,P = 0.027;每组6只)均升高(图1A)。与C57BL/6空白对照组小鼠相比,C57BL/6模型组小鼠脊髓中的趋化因子受体CXCR2、CXCR3、CXCR5、CCR1和CCR10的mRNA水平(相对表达量、t值及P值依次为0.753±0.483,t = 3.088,P = 0.011;0.936±0.332,t = 2.661,P = 0.031;0.736±0.394,t = 2.792,P = 0.021;1.551±0.655,t = 3.131,P = 0.011;0.959±0.289,t = 2.520,P = 0.036;每组6只)均升高(图1B)。
二、C57BL/6小鼠体质量、血糖、机械痛敏和热痛敏变化情况
注射STZ 2周后,与C57BL/6空白对照组小鼠相比,C57BL/6模型组小鼠体质量减少(图2A)、血糖升高(图2B)。注射STZ后第4周开始,C57BL/6模型组小鼠出现了DPNP,与C57BL/6空白对照组小鼠相比,前者的机械痛阈值降低(图2C),注射STZ后第6周开始,前者的热痛阈值降低(图2D)。
三、CXCR5-/-小鼠痛觉变化情况
为探讨1型糖尿病小鼠痛觉敏感开始发生显著变化与趋化因子受体CXCR5的关系,我们也对CXCR5-/-小鼠进行了STZ诱导,与CXCR5-/-空白对照组小鼠相比,CXCR5-/--模型组小鼠注射STZ后第4周机械痛阈值(图3A)和第6周的热痛阈值(图3B)未出现显著变化;而相较于C57BL/6空白对照组小鼠,C57BL/6模型组小鼠的机械痛和热痛阈值降低(图3A、B)。
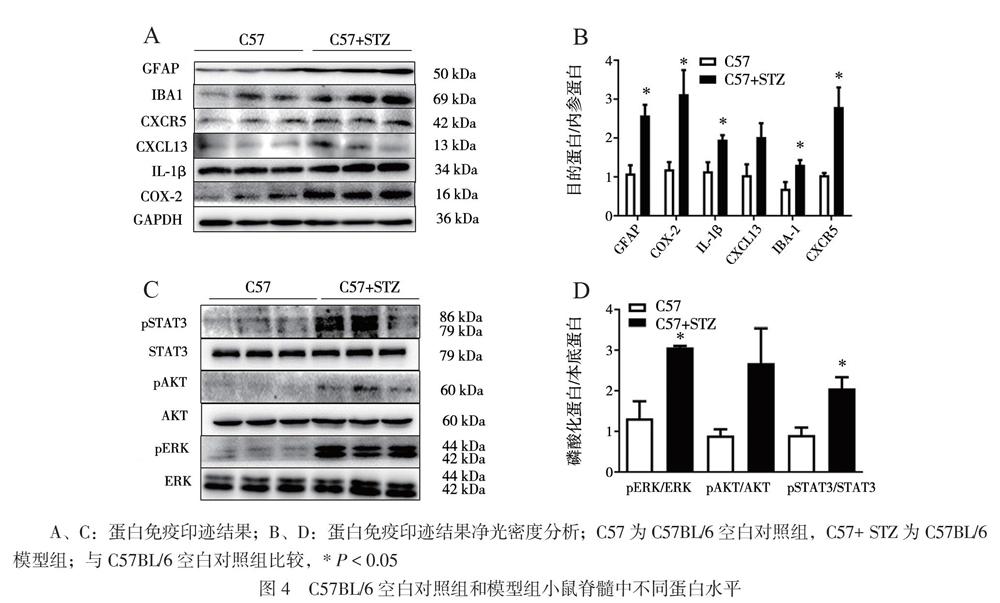
四、C57BL/6小鼠脊髓蛋白变化情况
与C57BL/6空白对照组小鼠相比,C57BL/6模型组小鼠的脊髓中,星形胶质细胞标志物GFAP(2.581±0.477,t = 4.286,P = 0.013;每组3只)和小型胶质细胞标志物IBA1(1.312±0.214,t = 2.880,P = 0.045;每组3只)被激活,炎症因子相关蛋白COX-2、IL-1β(3.127±1.074,t = 2.982,P = 0.041;1.958±0.200,t = 3.133,P = 0.035;每组3只)以及趋化因子受体CXCR5(2.798±0.870,t = 3.467,P = 0.026;每组3只) 的蛋白水平均增加,但CXCL13差异不明显(图4A、B)。与C57BL/6空白對照组小鼠相比,C57BL/6模型组pERK/ERK和pSTAT3/STAT3(3.068±0.063,t = 4.141,P = 0.014;2.057±0.482,t = 3.439,P = 0.026;每组3只)升高(图4C、D)。C57BL/6模型组的pERK/ERK和pSTAT3/STAT3与C57BL/6空白对照组比较有差异,而pAKT/AKT(2.013±0.487,t = 2.053,P = 0.109)比较无差异(图4D)。
五、C57BL/6小鼠血清中炎症因子变化情况
与C57BL/6空白对照组小鼠相比,C57BL/6模型组小鼠炎症因子IL-6、TNF-α和IL-1β水平(39.01±4.173,t = 4.990,P = 0.001;85.410± 8.626,t = 4.326,P = 0.001;143.200±8.866,t = 5.898,P < 0.001;每组6只)均升高(图5)。
讨论
DPNP是糖尿病患者神经病变中最常见的一种形式,通常表现为病变部位灼烧感,难以忍受的刺痛、麻木,甚至丧失感觉[7]。目前仍然缺乏预防或治疗DPNP的药物[8]。探讨DPNP的发病机制并开发针对发病机制靶点的药物具有重要意义[9]。
趋化因子最初被认为是外周免疫细胞运输的调节剂,并且表达于中枢神经系统的神经元和神经胶质细胞[3]。STZ是一种亚硝基脲类似物,它通过破坏胰腺分泌胰岛B细胞的DNA而对其产生毒性。经STZ诱导的糖尿病小鼠能够表现出DPNP的行为学特征[10-11]。我们使用定量逆转录PCR对STZ诱导的糖尿病小鼠脊髓中趋化因子及其受体进行了筛选,结果显示,相对于C57BL/6空白对照组小鼠,C57BL/6模型组小鼠部分趋化因子和趋化因子受体上调,CXCR5蛋白水平也有显著变化。
研究显示,向野生型小鼠和CXCR5-/-小鼠鞘内注射CXCL13,前者会出现热痛觉过敏,而CXCR5-/-小鼠无此现象,同时CXCL13也诱发了野生型小鼠强烈的机械痛,但在CXCR5-/-小鼠中的程度有所减轻[12]。与相关的研究类似,我们的研究显示,C57BL/6模型组小鼠出现了血糖升高、体质量减少,随后机械痛(4周) 和热痛(6周)阈值降低。但在经STZ诱导相同周数的CXCR5-/-小鼠中并未出现类似变化[13-14]。这表明,趋化因子CXCL13足以通过其受体CXCR5引起疼痛超敏反应,且在STZ诱导的1型糖尿病DPNP中,CXCL13/CXCR5是产生痛觉过敏的重要分子。
GFAP和IBA1分别是星形胶质细胞和小胶质细胞的标志物[14-15]。本研究蛋白免疫印迹结果表明星形胶质细胞和小胶质细胞标志物在STZ诱导的小鼠脊髓中被激活。在外周神经损伤后,pERK和pSTAT3会积聚在脊髓中,它们均可被CXCL13/CXCR5激活并引起db/db小鼠机械性异常性疼痛[16-18]。本研究显示C57BL/6模型组小鼠脊髓中pERK和pSTAT3均被激活,星形胶质细胞、小胶质细胞标志物蛋白水平增加。尽管本课题组的前期研究显示pAKT和CXCL13在db/db小鼠的脊髓中蛋白含量显著上调,但在本研究中pAKT和CXCL13在C57BL/6模型组小鼠脊髓中的变化不明显,这可能与不同糖尿病模型的作用机制有关[6]。我们还发现C57BL/6模型组IL-6、TNF-α和IL-1β的水平升高,由此推测是激活的CXCR5、胶质细胞和炎症因子导致了1型糖尿病引发的DPNP。
我们的研究表明,CXCL13/CXCR5通过激活脊髓中星型胶质细胞和小胶质细胞刺激pERK和pSTAT3介导的促炎细胞因子的产生,参与了STZ诱导的1型糖尿病引发的机械痛敏和热痛敏改变。因此,靶向脊髓中的CXCL13/CXCR5或可成为治疗DPNP的新方法。
参 考 文 献
[1] 杨文英.中国糖尿病的流行特点及变化趋势.中国科学:生命科学, 2018, 48(8):812-819.
[2] 李永丰, 任维, 刘一辉. CB1受体通过钾离子通道介导外周镇痛作用.中国病理生理杂志, 2019, 35(4):660-666.
[3] Zhang ZJ, Jiang BC, Gao YJ. Chemokines in neuron-glial cell interaction and pathogenesis of neuropathic pain.Cell Mol Life Sci,2017, 74(18):3275-3291.
[4] Jayaraj ND, Bhattacharyya BJ, Belmadani AA, Ren D, Rathwell CA, Hackelberg S, Hopkins BE, Gupta HR, Miller RJ, Menichella DM. Reducing CXCR4-mediated nociceptor hyperexcitability reverses painful diabetic neuropathy. J Clin Invest, 2018, 128(6): 2205-2225.
[5] Zhang Q, Cao DL, Zhang ZJ, Jiang BC, Gao YJ. Chemokine CXCL13 mediates orofacial neuropathic pain via CXCR5/ERK pathway in the trigeminal ganglion of mice. J Neuroinflammation, 2016, 13(1):183.
[6] Liu S, Liu X, Xiong H, Wang W, Liu Y, Yin L, Tu C, Wang H, Xiang X, Xu J, Duan B, Tao A, Zhao Z, Mei Z. CXCL13/CXCR5 signaling contributes to diabetes-induced tactile allodynia via activating pERK, pSTAT3, pAKT pathways and pro-inflammatory cytokines production in the spinal cord of male mice. Brain Behav Immun, 2019,8(80):711-724.
[7] Marín-Pe?alver JJ, Martín-Timón I, Sevillano-Collantes C, Del Ca?izo-Gómez FJ. Update on the treatment of type 2 diabetes mellitus. World J Diabetes, 2016, 7(17): 354-395.
[8] Paisley P, Serpell M. Improving pain control in diabetic neuropathy. Practitioner,2017,261(1802):23-26.
[9] 付寶军, 姜静静, 黄玉琼, 林宗航, 李恒. 脊髓CSF-1诱发小胶质细胞活化在长春新碱诱导神经病理性疼痛大鼠中的作用. 新医学, 2020, 51(7): 522-527.
[10] Johansen NJ, Frugier T, Hunne B, Brock JA. Increased peripherin in sympathetic axons innervating plantar metatarsal arteries in STZ-induced type I diabetic rats. Front Neurosci, 2014, 8: 99.
[11] Gao F, Zheng ZM. Animal models of diabetic neuropathic pain. Exp Clin Endocrinol Diabetes,2014,122(2):100-106.
[12] Jiang BC, Cao DL, Zhang X, Zhang ZJ, He LN, Li CH, Zhang WW, Wu XB, Berta T, Ji RR, Gao YJ. CXCL13 drives spinal astrocyte activation and neuropathic pain via CXCR5. J Clin Invest, 2016, 126(2): 745-761.
[13] Basbaum AI, Bautista DM, Scherrer G, Julius D. Cellular and molecular mechanisms of pain.Cell, 2009, 139(2): 267-284.
[14] Tsuda M, Ueno H, Kataoka A, Tozaki-Saitoh H, Inoue K. Activation of dorsal horn microglia contributes to diabetes-induced tactile allodynia via extracellular signal-regulated protein kinase signaling. Glia, 2008, 56(4): 378-386.
[15] Old EA, Malcangio M. Chemokine mediated neuron-glia communication and aberrant signalling in neuropathic pain states. Curr Opin Pharmacol, 2012, 12(1):67-73.
[16] Kawasaki Y, Zhang L, Cheng JK, Ji RR. Cytokine mechanisms of central sensitization: distinct and overlapping role of interleukin-1beta, interleukin-6, and tumor necrosis factor-alpha in regulating synaptic and neuronal activity in the superficial spinal cord. J Neurosci, 2008,28(20):5189-5194.
[17] Dominguez E, Rivat C, Pommier B, Mauborgne A, Pohl M. JAK/STAT3 pathway is activated in spinal cord microglia after peripheral nerve injury and contributes to neuropathic pain development in rat. J Neurochem, 2008, 107(1): 50-60.
[18] Xu JT, Tu HY, Xin WJ, Liu XG, Zhang GH, Zhai CH. Activation of phosphatidylinositol 3-kinase and protein kinase B/Akt in dorsal root ganglia and spinal cord contributes to the neuropathic pain induced by spinal nerve ligation in rats. Exp Neurol, 2007, 206(2): 269-279.
(收稿日期:2020-08-22)
(本文編辑:洪悦民)
