ACAT1在肝细胞癌中的表达与预后评估价值
2021-03-18周慧李文超黄少卓萧展毅哈睿南熊志勇刘波胡昆鹏
周慧?李文超?黄少卓?萧展毅?哈睿南?熊志勇?刘波?胡昆鹏
【摘要】目的 分析乙酰輔酶A酰基转移酶1(ACAT1)在肝癌中的表达及其临床意义。方法 从癌症基因组图谱(TCGA)数据库中下载371例肝癌患者癌组织和50例癌旁组织基因表达数据及临床信息,使用t检验分析ACAT1在肝癌组织与癌旁组织的表达情况,利用方差分析检验ACAT1与患者肿瘤分期[2017年美国癌症联合委员会(AJCC)分期标准]、病理分级间的关系;根据ACAT1表达量中位值将患者分为ACAT1高、低表达2组,采用Kaplan-Meier法分析ACAT1对肝癌的预后价值;Cox回归分析探讨ACAT1是否为判断肝癌预后的独立危险因素;采用实时定量PCR法验证76例肝癌患者癌组织和癌旁组织ACAT1在转录水平的表达差异,蛋白免疫印迹法验证4例肝癌患者癌组织和癌旁组织ACAT1蛋白水平的表达差异。结果 TCGA数据库分析显示在371例肝癌患者的癌组织中,ACAT1的mRNA表达水平降低(P < 0.001),并随着肿瘤临床分期(StageⅠ ~ Ⅲ期)及病理分级(G1 ~ G4级)的升高而降低(P均< 0.001),ACAT1低表达组肝癌患者的总生存率低于高表达组(P < 0.001),且ACAT1表达可成为判断肝癌预后的独立危险因子(P = 0.029)。经PCR法和蛋白免疫印迹法验证,无论是在mRNA转录水平还是蛋白表达水平上,肝癌组织ACAT1的表达量都低于癌旁组织。结论 ACAT1在肝细胞癌中表达下降,可作为肝癌临床诊断及预后评估的分子标志物。
【关键词】乙酰辅酶A酰基转移酶1;肝癌;诊断;预后
The expression pattern and prognostic value of ACAT1 in hepatocellular carcinoma Zhou Hui, Li Wenchao, Huang Shaozhuo, Xiao Zhanyi, Ha Ruinan, Xiong Zhiyong, Liu Bo, Hu Kunpeng. Department of General Surgery, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Hu Kunpeng, E-mail: hkpdhy918@ 126. com
【Abstract】Objective To evaluate the expression level of acetyl-Coenzyme A acetyltransferase 1 (ACAT1) and its clinical significance in hepatocellular carcinoma (HCC). Methods RNAseq and clinical information of 371 HCC and 50 paracancerous samples were obtained from The Cancer Genome Atlas (TCGA) database. The expression pattern of ACAT1 in the HCC and paracancerous samples was statistically compared by t-test. The relationship among ACAT1, tumor staging (AJCC staging criteria) and pathological grading was analyzed by using ANOVA. All patients were classified into the low-and high-ACAT1 expression groups according to the median value of ACAT1 mRNA expression. The prognostic value of ACAT1 for HCC was assessed by Kaplan-Meier method. Whether ACAT1 could be an independent prognostic factor of HCC patients was evaluated by Coxs regression analysis. The expression profile of ACAT1 mRNA between 76 paired HCC and paracancerous tissues was analyzed by real-time quantitative PCR (qRT-PCR). The expression pattern of ACAT1 protein between 4 paired HCC and paracancerous tissues was analyzed by Western blot. Results TCGA database revealed that the expression levels of ACAT1 were significantly down-regulated in 371 HCC tissues (all P < 0.001), and remarkably decreased along with the higher tumor clinical staging (stage Ⅰ-stage Ⅲ) and pathological grading (G1-G4) (all P < 0.001). The overall survival of HCC patients with low ACAT1 expression was significantly lower compared with that of those with high ACAT1 expression (P < 0.001). The expression of ACAT1 could serve as an independent risk factor for predicting the prognosis of HCC patients (P = 0.029). qRT-PCR and Western blot demonstrated that the expression of ACAT1 in the HCC samples was significantly lower than that in the paracancerous samples at the mRNA and protein levels. Conclusion The expression level of ACAT1 is down-regulated in HCC tissues, which can be a molecular biomarker for clinical diagnosis and prognosis assessment for HCC.
【Key words】Acetyl-coenzyme A acetyltransferase 1;Hepatocellular carcinoma;Diagnosis;Prognosis
肝细胞癌是最常见的原发性肝癌,现已成为全球癌症相关死亡的主要原因之一[1]。肝细胞癌的主要致病因素为慢性乙型肝炎和黄曲霉毒素B1中毒,中国属于肝癌高发地区,随着慢性肝脏疾病的患病率逐年上升,肝细胞癌的发病率也将不断增加,尽管肝细胞癌的预防、检测、诊断和治疗手段取得了很大进步,但由于肝癌复杂的病理机制以及易侵袭、转移的特性,使得患者的预后仍不尽人意[2]。因此,寻找新的分子生物标志物,对肝癌具有重要的临床意义。
乙酰辅酶A酰基转移酶(ACAT),又称乙酰乙酰辅酶A硫解酶、β-酮硫解酶,在哺乳动物中存在2种亚型,分别为ACAT1和ACAT2,ACAT1位于线粒体上,ACAT2位于細胞质里[3]。线粒体ACAT1主要参与体内酮体和异亮氨酸的代谢,催化两分子乙酰辅酶A合成乙酰乙酰辅酶A的可逆过程,在肝内主要参与酮体生成,而在肝外组织主要参与酮体分解。ACAT1缺乏或突变是一种罕见的常染色体隐性遗传病,临床上,轻度患者无明显症状或为呕吐、腹泻、脱水等代谢性酸中毒症状,重度患者则可能出现昏迷、神经系统发育落后甚至死亡[4-6]。近年来,有研究者发现ACAT1在前列腺癌、乳腺癌和结直肠癌中,参与了肿瘤耐药和细胞增殖过程,亦有研究者发现ACAT1的下调可能是肾透明细胞癌的保护因素[7-9]。可见,ACAT1基因与肿瘤的发生、发展及耐药等方面可能存在密切联系,ACAT1有望成为肿瘤治疗潜在的重要分子靶点。然而,ACAT1在肝癌中的研究鲜有报道,因此,我们将分析ACAT1在肝癌中的表达情况,评估其在肝细胞癌中的诊断、预后评估价值。
材料与方法
一、标本来源
研究中使用的76对肝癌组织和癌旁组织标本来源于2003年1月至2019年12月期间在中山大学附属第三医院行肝癌切除术的患者,所有标本术后均经过石蜡包埋、HE染色并有明确病理诊断,其中男50例、女26例。所有患者均签署知情同意书。
二、数据下载
研究中使用的371例肝癌患者(其中有50例包含癌组织和癌旁组织,其余321例仅包括癌组织)ACAT1基因测序信息及临床信息来源于美国肿瘤基因组图谱(TCGA)数据库,本研究分析了上述343例(剔除临床信息不全病例后)肝癌患者肿瘤组织(n = 343)和癌旁组织(n = 50)ACAT1的mRNA表达水平及其与临床病理参数的相关性。最后以ACAT1的mRNA表达量中位值为界,将这343例肝癌患者分为ACAT1高表达组和ACAT1低表达组,分析ACAT1对肝癌患者的预后价值。
三、实时定量PCR
使用Trizol-RNA提取试剂(Sigma)提取76例新鲜冷冻肝癌组织样本及癌旁组织样本的总RNA,并使用Transcriptor cDNA Synth.Kit2逆转录试剂盒(罗氏)将1.0 μg总RNA逆转录成cDNA,以PCR仪(顶部加热型)65℃加热10 min,添加剩余成分后25℃10 min→55℃30 min。最后使用SYBR GREEN I MASTER (罗氏)进行实时荧光定量PCR检测(10 μl反应体系)。β-actin作为内参基因。PCR设置程序为:第一步95℃ 5 min,第二步95℃ 10 s→60℃ 20 s→72℃ 20 s 40个循环,第三步95℃ 5 s→65℃ 1 min→97℃ 5 min→40℃ 10 s。采用Log2-△△Ct (△Ct = CtACAT1-Ctβ-actin)公式算出肝癌组织与癌旁组织间ACAT1的mRNA相对表达量,以ACAT1的mRNA表达量中位值为界,将患者分为ACAT1高表达组和ACAT1低表达组。实验中使用的引物序列如下,ACAT1上游引物序列:5-GAGGTGCTTCTGCCATGCTA-3,ACAT1下游引物序列:5-TGGTCACATAGGGTTGTCTCCT-3,β-Actin上游引物序列:5-ACATCTGCTGGAAGGTGGACA-3,β-Actin下游引物序列:5-TCAAGATCATTGCTCCTCCTGAG-3。
四、蛋白免疫印迹法
使用RIPA裂解液提取4例肝癌患者肿瘤组织和癌旁组织蛋白,BCA法(Thermo scientific)测定蛋白浓度,取50 μg蛋白制备样品;将上述样品上样至10% SDS-PAGE凝胶,恒压60 V电泳30 min将样品压至分离胶,改换恒压120 V至电泳结束;随即恒压100 V下转膜90 min,将蛋白转至0.22 μm PVDF膜上;5%脱脂牛奶封闭2 h,目的条带置于ACAT1一抗稀释液中(1∶1000,Abcam),内参条带置于β-actin一抗稀释液(1∶ 1000,ABclonal)中4℃孵育过夜;室温孵育兔二抗(1∶5000,ABclonal)1 h,最后进行化学发光检测,分析ACAT1蛋白的相对表达量。
五、统计学处理
使用GraphPad Prism 7.0处理数据。计量资料以表示,等级资料以例(%)表示。采用配对t检验分析TCGA数据库中50例肝癌患者癌组织与对应的癌旁组织ACAT1的表达差异,独立样本t检验从整体水平分析TCGA数据库中343例肝癌组织与50例癌旁组织ACAT1的表达差异;配对t检验分析76例肝癌患者癌组织和癌旁组织ACAT1的表达差异;ACAT1表达量与临床分期 [2017年美国癌症联合委员会(AJCC)分期标准]、病理分级间的关系采用方差分析,多重比较采用LSD-t检验;采用受试者工作特征(ROC)曲线评价ACAT1对肝癌的诊断价值;用Kaplan-Meier法绘制生存曲线,组间比较用log-rank 检验;采用单因素与多因素Cox回归分析(进入法)肝癌患者预后的影响因素。P < 0.05为差异有统计学意义。
结果
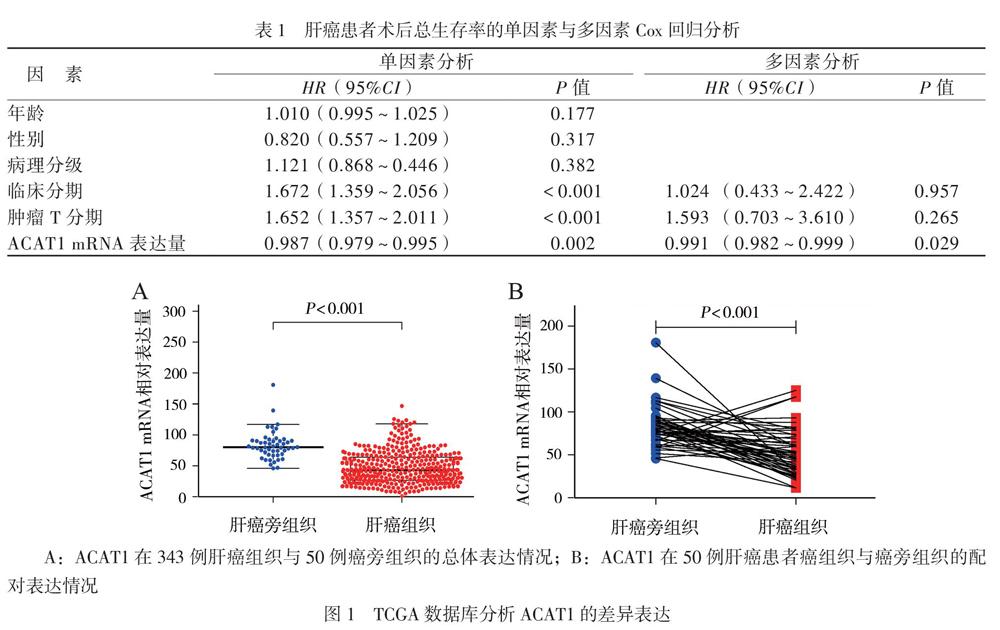
一、ACAT1基因TCGA数据库分析结果
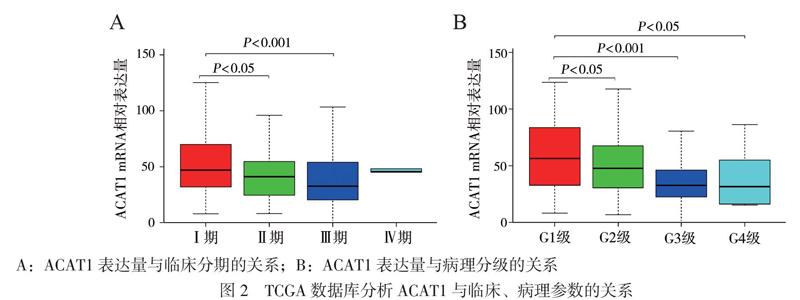
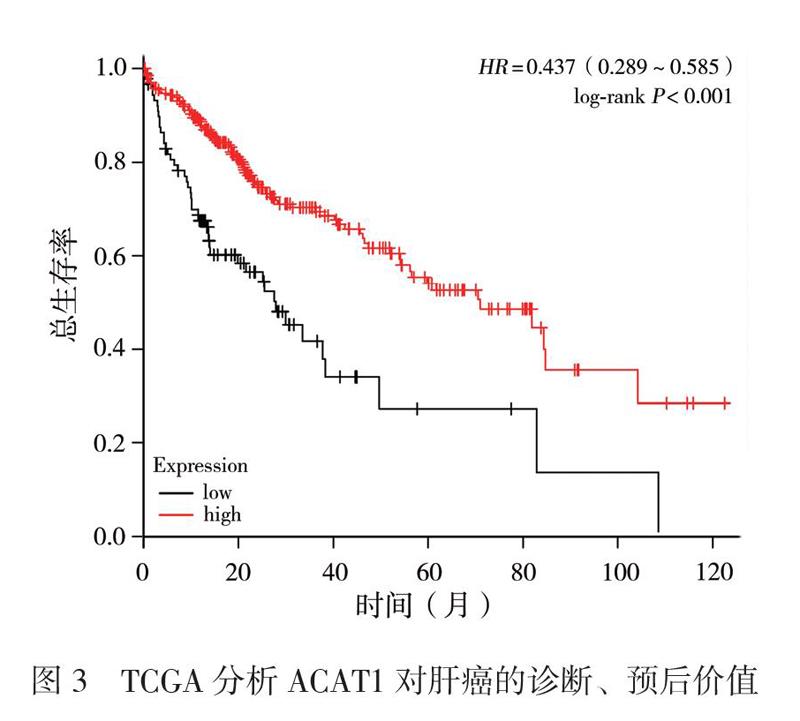
在TCGA数据库所获得的343例肝癌患者中,与50例癌旁组织的正常肝组织相比,ACAT1在肝癌组织中表达下降,且具有统计学意义(P < 0.001),见图1A。TCGA数据库所获得的50例肝癌患者中,与癌旁正常组织相比,ACAT1在肝癌组织中表达下降(P < 0.001),见图1B。随着患者肿瘤临床分期(StageⅠ期 ~ Ⅲ期)及病理分级(G1 ~ G4级)升高,ACAT1的转录水平不断下降(总体P均< 0.001),见图2。以ACAT1 mRNA表达水平的中位值(42.473905)为界,将患者分为ACAT1高表达组和ACAT1低表达组。Kaplan-Meier分析显示,ACAT1高表达组总生存率高于ACAT1低表达组(HR = 0.437, 95% CI= 0.289 ~ 0.585,P < 0.001),见图3。
单因素Cox回归分析显示,肝癌患者术后总生
存率的影响因素包括临床分期(P < 0.001)、肿瘤T分期(P < 0.001)、ACAT1 mRNA表达量(P = 0.002),进一步多因素Cox回归分析显示,ACAT1 mRNA的表达量跟肝癌患者术后总生存率相关,是肝癌患者预后的独立危险因子(HR = 0.991, 95%CI = 0.982 ~ 0.999, P = 0.029),见表1。
二、肝癌组织和癌旁组织mRNA和蛋白分析结果
76例肝癌患者的癌组织与癌旁组织实时荧光定量PCR结果显示,肝癌组织中ACAT1 mRNA相对表达量低于癌旁组织(P < 0.001),见图4A。此外,本中心4对肝癌患者癌组织与癌旁组织蛋白免疫印迹法结果显示,肝癌组织中ACAT1蛋白表达水平低于癌旁组织,见图4B。
讨论
在过去几十年里,全球原发性肝癌的发病率一直在上升,肝细胞癌为肝癌的主要类型[10]。治疗上,早期肝癌患者可采用手术切除或肝癌局部消融治疗;中期肝癌患者可采用局部化学治疗栓塞等;而到了晚期,患者虽可采用索拉非尼、雷格拉非尼等激酶抑制剂治疗,但治疗手段及效果都非常有限。目前,甲胎蛋白是肝癌里应用最广泛的生物标志物,但由于灵敏度不高,其诊断价值有限[11]。由此可见,寻找新的分子生物标志物,提高肝癌的诊断及预后判断能力显得尤为重要。
ACAT1是位于细胞线粒体上的酮体代谢酶,催化酮生成和酮解过程中乙酰辅酶A和两个乙酰辅酶A分子之间的可逆转换。在肝脏的酮生成过程中,ACAT1催化两分子乙酰辅酶A生成乙酰乙酰辅酶A,而在肝外组织的酮分解过程中,ACAT1促进乙酰乙酰辅酶A分解为两分子乙酰辅酶A[12]。有研究者发现,在前列腺癌中,ACAT1的表达量较正常前列腺细胞增加,且ACAT1的上调与前列腺癌的低分化、高侵袭性以及较差的预后相关[13-14]。在乳腺癌中,ACAT1可通过促进细胞增殖、转移来促进肿瘤发展[15]。在子宫癌的阿霉素治疗过程中,ACAT1可通过增加细胞增殖能力、减少细胞凋亡,促进细胞形成对阿霉素耐药性[16]。ACAT1促进了还原型烟酰胺嘌呤二核苷酸磷酸和脂肪的生成,促进了结直肠癌的发生[8]。以上研究结果提示,ACAT1可能作为促癌基因,在肿瘤发生、发展中发挥作用。
本研究通过对TCGA数据库中371例肝癌患者的测序结果进行分析发现,在肝癌组织中,ACAT1的mRNA表达水平明显低于正常肝组织,并且在对76例肝癌患者PCR分析与4例患者的蛋白免疫印迹分析中,我们验证了ACAT1在肝癌中的这种差异表达。TCGA分析还显示,随着肝癌患者肿瘤的临床分期(StageⅠ ~ Ⅲ期)及病理分级(G1 ~ G4级)的升高,ACAT1的转录水平不断下降。由于Stage Ⅳ期的样本量较小(n < 10),与Stage Ⅰ期相比,ACAT1的表达量差异不具有统计学意义。我们还发现,ACAT1对诊断肝癌和非肝癌患者预后有良好的提示作用,在ACAT1表达量低的肝癌患者中,其总生存率远低于ACAT1表达量高的肝癌患者,且ACAT1表达量低是肝癌患者低生存率的一个独立危险因素。综上所述,我们推测ACAT1可能作为一个抑癌基因在肝癌的发生、发展中起作用。与我们的研究结果相似的是有学者发现,在肾透明细胞癌中,ACAT1在癌组织中的表达较癌旁正常组织明显减少且与不良预后相关[9, 17]。
ACAT1在不同肿瘤中的表达情况不尽相同,对肿瘤的发生、发展作用也并未得到一致的结论。由于肝细胞内缺乏分解酮体的反应酶体系,肝内ACAT1主要参与酮體生成,在肝外ACAT1主要参与酮体分解,许多体内外研究表明,酮体能促进肿瘤细胞凋亡、抑制肿瘤细胞生长,生酮饮食能减少小鼠肿瘤体积,增加生存时间[18-19]。我们认为,可能由于ACAT1在肝内外组织中参与的酮体代谢过程的差异,导致ACAT1在肝内外肿瘤中的表达情况与作用不一致。因此,需要更进一步地探索ACAT1在肿瘤尤其是在肝癌发生、发展过程中的机制。
参 考 文 献
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin,2020,70(1):7-30.
[2] Yang JD, Hainaut P, Gores GJ, Amadou A, Plymoth A, Roberts LR. A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nat Rev Gastroenterol Hepatol,2019,16(10):589-604.
[3] Antonenkov VD, Croes K, Waelkens E, Van Veldhoven PP, Mannaerts GP. Identification, purification and characterization of an acetoacetyl-CoA thiolase from rat liver peroxisomes. Eur J Biochem,2000,267(10):2981-2990.
[4] K?l??-Y?ld?r?m G, Durmu?-Aydo?du S, Ceylaner S, Sass JO. Beta-ketothiolase deficiency: an unusual cause of recurrent ketoacidosis. Turk J Pediatr,2017,59(4):471-474.
[5] Sundaram S, Nair M, Namboodhiri S, Menon RN. Mitochondrial acetoacetyl-CoA thiolase enzyme deficiency in a 9-month old boy: atypical urinary metabolic profile with a novel homozygous mutation in ACAT1 gene. Neurol India,2018,66(6):1802-1804.
[6] Abdelkreem E, Harijan RK, Yamaguchi S, Wierenga RK, Fukao T. Mutation update on ACAT1 variants associated with mitochondrial acetoacetyl-CoA thiolase (T2) deficiency. Hum Mutat,2019,40(10):1641-1663.
[7] Fan J, Lin R, Xia S, Chen D, Elf SE, Liu S, Pan Y, Xu H, Qian Z, Wang M, Shan C, Zhou L, Lei QY, Li Y, Mao H, Lee BH, Sudderth J, DeBerardinis RJ, Zhang G, Owonikoko T, Gaddh M, Arellano ML, Khoury HJ, Khuri FR, Kang S, Doetsch PW, Lonial S, Boggon TJ, Curran WJ, Chen J. Tetrameric acetyl-CoA acetyltransferase 1 is important for tumor growth. Mol Cell,2016,64(5):859-874.
[8] Zhu Y, Gu L, Lin X, Liu C, Lu B, Cui K, Zhou F, Zhao Q, Prochownik EV, Fan C, Li Y. Dynamic regulation of ME1 phosphorylation and acetylation affects lipid metabolism and colorectal tumorigenesis. Mol Cell,2020,77(1):138-149.e5.
[9] Zhao Z, Liu Y, Liu Q, Wu F, Liu X, Qu H, Yuan Y, Ge J, Xu Y, Wang H. The mRNA expression signature and prognostic analysis of multiple fatty acid metabolic enzymes in clear cell renal cell carcinoma. J Cancer,2019,10(26):6599-6607.
[10] Villanueva A. Hepatocellular Carcinoma. N Engl J Med, 2019,380(15):1450-1462.
[11] Luo P, Wu S, Yu Y, Ming X, Li S, Zuo X, Tu J. Current status and perspective biomarkers in AFP negative HCC: towards screening for and diagnosing hepatocellular carcinoma at an earlier stage. Pathol Oncol Res,2020,26(2):599-603.
[12] Fukao T, Song XQ, Mitchell GA, Yamaguchi S, Sukegawa K, Orii T, Kondo N. Enzymes of ketone body utilization in human tissues: protein and messenger RNA levels of succinyl-coenzyme A (CoA):3-ketoacid CoA transferase and mitochondrial and cytosolic acetoacetyl-CoA thiolases. Pediatr Res,1997,42(4):498-502.
[13] Saraon P, Cretu D, Musrap N, Karagiannis GS, Batruch I, Drabovich AP, van der Kwast T, Mizokami A, Morrissey C, Jarvi K, Diamandis EP. Quantitative proteomics reveals that enzymes of the ketogenic pathway are associated with prostate cancer progression. Mol Cell Proteomics, 2013, 12(6):1589-1601.
[14] Saraon P, Trudel D, Kron K, Dmitromanolakis A, Trachtenberg J, Bapat B, van der Kwast T, Jarvi KA, Diamandis EP. Evalua-tion and prognostic significance of ACAT1 as a marker of prostate cancer progression. Prostate, 2014, 74(4):372-380.
[15] Martinez-Outschoorn UE, Lin Z, Whitaker-Menezes D, Howell A, Sotgia F, Lisanti MP. Ketone body utilization drives tumor growth and metastasis. Cell Cycle,2012,11(21):3964-3971.
[16] Lo YW, Lin ST, Chang SJ, Chan CH, Lyu KW, Chang JF, May EW, Lin DY, Chou HC, Chan HL. Mitochondrial proteomics with siRNA knockdown to reveal ACAT1 and MDH2 in the development of doxorubicin-resistant uterine cancer. J Cell Mol Med,2015,19(4):744-759.
[17] Chen L, Peng T, Luo Y, Zhou F, Wang G, Qian K, Xiao Y, Wang X. ACAT1 and metabolism-related pathways are essential for the progression of clear cell renal cell carcinoma (ccRCC), as determined by co-expression network analysis. Front Oncol,2019,9:957.
[18] Skinner R, Trujillo A, Ma X, Beierle EA. Ketone bodies inhibit the viability of human neuroblastoma cells. J Pediatr Surg,2009,44(1):212-216.
[19] Vidali S, Aminzadeh S, Lambert B, Rutherford T, Sperl W, Kofler B, Feichtinger RG. Mitochondria: the ketogenic diet——a metabolism-based therapy. Int J Biochem Cell Biol,2015,63:55-59.
(收稿日期:2020-10-10)
(本文編辑:杨江瑜)
