Li2TiO3包覆提高LiNi0.5Mn0.5O2的电化学性能
2021-03-18唐发满
唐发满
(五矿盐湖有限公司,青海西宁 810003)
LiNi0.5Mn0.5O2具有与LiCoO2相同的层状结构,成本低、比容量高且对环境友好,在充放电过程中的体积变化小,吸引了研究者们的注意。在该材料中,镍(Ni)处于+2价态,是具有化学活性的元素,而锰(Mn)处于+4价态,在充放电状态下维持结构的稳定[1]。LiNi0.5Mn0.5O2存在的缺点,影响了进一步的应用:Ni2+在充电状态下被氧化为Ni4+,而Ni4+经常与电解液发生副反应,使结构崩塌,导致材料的循环性能差[1];Li+的半径(0.076 nm)与Ni2+的半径(0.069 nm)接近,Ni2+可能占据Li+位点,造成锂镍混排,导致材料充放电速度减慢[2];LiNi0.5Mn0.5O2正极材料在充放电过程中还有电压下降快、极化严重等问题。
元素掺杂和纳米化是提高正极材料电化学性能的有效方法。引入外来离子(如Mg2+、Al3+、Ti3+和Ca2+)的掺杂方法可缓解循环过程中的电压降[2],但没有明确的证据表明金属掺杂能改善Li+在结构中的扩散动力学。纳米化也有明显的弱点,如副反应多和体积膨胀等。在表面包覆MgO、Al2O3、ZrO2、SiO2和CeO2等惰性氧化物,也可以提高正极材料的电化学性能[3],原理是减少正极材料和电解质之间的副反应。形成的包覆层会延长Li+扩散路径;这些包覆层作为Li+导电的绝缘体,不能促进界面电荷的转移。与上述包覆层材料相比,Li2TiO3具有稳定的结构,可作为保护层来阻止电解液与正极材料间的副反应,是一种理想的包覆材料。Li2TiO3还具有有利于Li+扩散的三维路径,可提高Li+迁移速率[3]。
本文作者将Li2TiO3包覆在LiNi0.5Mn0.5O2正极材料的表面,讨论Li2TiO3包覆对LiNi0.5Mn0.5O2正极材料的结构与性能的影响,并总结材料结构与电化学性能之间的联系。
1 实验
1.1 材料制备
1.1.1 共沉淀法合成前驱体Ni0.5Mn0.5CO3·xH2O
按化学计量比准确称量乙酸镍[Ni(CH3COO)2·4H2O,天津产,AR]、乙酸锰[Mn(CH3COO)2·4H2O,天津产,AR]、碳酸钠(Na2CO3,上海产,AR)和氢氧化锂(LiOH·H2O,上海产,AR)。 将 Mn(CH3COO)2·4H2O、Ni(CH3COO)2·4H2O 溶于60ml去离子水中,得到混盐溶液;Na2CO3溶于30 ml去离子水中。将Na2CO3溶液缓慢滴入搅拌(1 000 r/min)中的混合盐溶液中,搅拌12 h后过滤,用无水乙醇(上海产,AR)洗涤,在80℃下干燥12 h,得到前驱体。
1.1.2 溶剂热法制备zTiO2@Ni0.5Mn0.5CO3·yH2O
将前驱体及相应物质的量的Ti(OC4H9)4(上海产,AR)均匀分散在30ml无水乙醇中。将不同物质的量比的溶液转移到高温反应釜放置在高温箱内,在180℃下维持6h,Ni0.5Mn0.5C2O4·xH2O会失去部分结晶水,变成 Ni0.5Mn0.5C2O4·yH2O,而 Ti(OC4H9)4会在 Ni0.5Mn0.5C2O4·yH2O 样品表面水解,形成TiO2包覆层。将所得产物用无水乙醇洗涤3次,离心收集得到zTiO2@Ni0.5Mn0.5CO3·yH2O材料。
1.1.3 制备zLi2TiO3@LiNi0.5Mn0.5O2
按n(Li)∶n(Mn+Ni) ∶n(Ti)=3.05∶1.05∶2.00 计算LiOH·H2O的用量,多加5%的锂是补充高温下煅烧过程中锂的烧损。将得到的zTiO2@Ni0.5Mn0.5CO3·yH2O与LiOH·H2O研磨均匀后,在空气中以5℃/min的速率升温至500℃并煅烧5 h,再以5℃/min的速率升温至850℃并煅烧12 h,得到目标产物zLi2TiO3@LiNi0.5Mn0.5O2正极材料。
1.2 材料结构分析
用X’Pert ProX射线衍射仪(荷兰产)分析合成材料的晶体结构,CuKα,λ=0.154 18nm,管压40kV、管流30mA,步长为0.016 7°,扫描速度为 5(°)/min。 用 JSM-5600LV 扫描电子显微镜(日本产)观察合成材料的形貌。用TECNAI G2透射电子显微镜(TEM,美国产)分析 0.03Li2TiO3@LiNi0.5Mn0.5O2的形貌、元素分布和包覆情况。
1.3 电池组装
将导电炭黑(Timcal公司,电池级)、正极活性物质和聚偏二氟乙烯(Arkema公司,电池级)按质量比8∶1∶1混合均匀,加入适量的N-甲基吡咯烷酮(河南产,99.9%)制成浆料,然后均匀涂覆在约20μm厚的铝箔(广州产,99.5%)上,在鼓风干燥箱中、80℃下干燥50 min,120℃下真空(30 Pa)干燥12 h。以金属锂箔(深圳产,99.5%)为负极,1 mol/L LiPF6/EC+DMC(体积比1∶1,苏州产)为电解液,氩气保护的手套箱中组装CR2025型扣式电池。
1.4 电化学性能测试
用CT2001A型电池测试系统(武汉产)测试充放电性能,电流为0.2C(1C=200 mA/g),电压为2.5~4.2 V。用MC1000电化学工作站(美国产)进行阻抗测试,频率为0.1~105Hz,交流振幅为5 mV。
2 结果与讨论
2.1 材料的结构和形貌
zLi2TiO3@LiNi0.5Mn0.5O2正极材料的XRD图见图1。
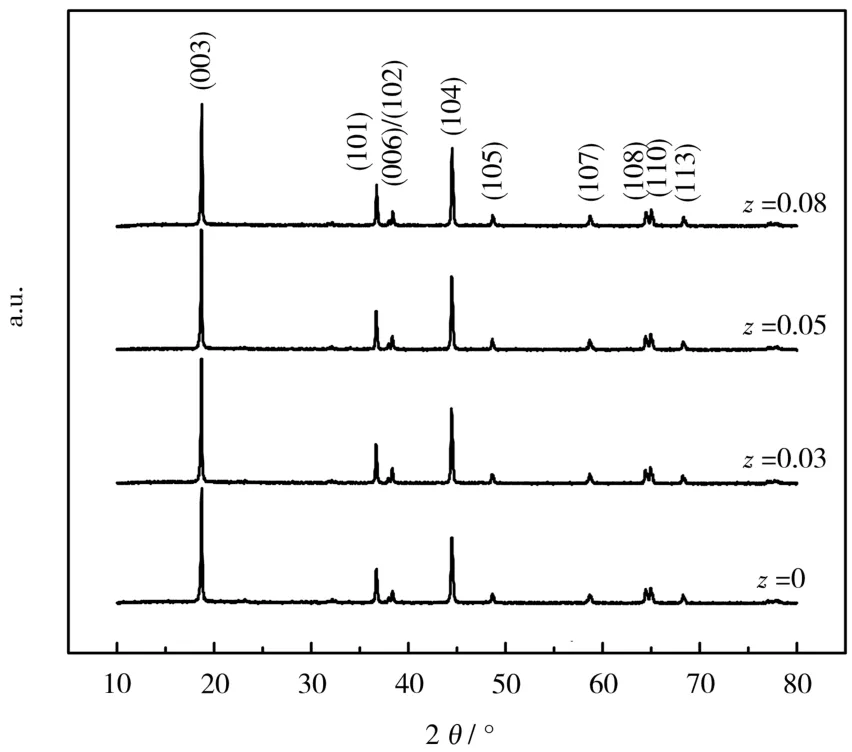
图1 zLi2TiO3@LiNi0.5Mn0.5O2正极材料的XRD图Fig.1 XRD patterns ofzLi2TiO3@LiNi0.5Mn0.5O2cathode materials
从图1可知,合成的材料符合空间群R-3m的情况,衍射峰都能很好地对应α-NaFeO2(PDF:89-3601)的结构。没有杂质峰,表明合成的材料纯度高。合成材料均呈现出清晰的(003)、(101)和(104)峰,证实材料均具有 Mn(Ni)-O-Mn(Ni)基本单元,这些单元组成层状结构。清晰的分裂峰(006)/(102)和(108)/(110)显示出有序的层状结构。Li2TiO3没有额外对应的衍射峰,最可能的原因之一是包覆的Li2TiO3量少。此外,文献[4]发现,当衍射特征峰在小角度时,对应较大的晶面间距。图1中,随着包覆Li2TiO3量的增加,(003)峰逐渐向低角度方向移动,原因是部分Ti4+掺入了LiNi0.5Mn0.5O2正极材料中。对比合成材料(003)峰强度[I(003)]与(104)峰强度[I(104)]之比可知,随着包覆量的增加,I(003)/I(104)逐渐增大,原因是Ti4+掺杂进材料内部,降低了材料的锂镍混排程度,有利于Li+的迁移。
图2为LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2材料的SEM图。

图2 LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2材料的SEM图Fig.2 SEM photographs of LiNi0.5Mn0.5O2and 0.03Li2TiO3@LiNi0.5Mn0.5O2materials
从图2(a)、(c)可知,未包覆材料的团聚现象严重,而包覆材料的团聚较少。这是由于在高温煅烧过程中,未包覆材料结构相似,容易团聚;而包覆层Li2TiO3在此过程中可阻止颗粒之间的聚集,降低材料的团聚程度。从图2(b)、(d)可知,合成材料均由大小基本相同的球形小颗粒组成,包覆Li2TiO3未改变单个正极材料的大小和形貌。
图3为0.03Li2TiO3@LiNi0.5Mn0.5O2材料的高倍透射电镜图。

图3 0.03Li2TiO3@LiNi0.5Mn0.5O2材料的高倍透射图Fig.3 High resolution transmission electron microscopy(TEM)of 0.03Li2TiO3@LiNi0.5Mn0.5O2materials
图3中清晰的晶格条纹,表明合成的正极材料具有良好的结晶性;图中有两种晶格条纹,其中包覆层上晶面间距为0.24 nm、0.47 nm的晶格条纹对应的分别是包覆材料Li2TiO3[3]和LiNi0.5Mn0.5O2[5]。
0.03Li2TiO3@LiNi0.5Mn0.5O2材料的元素线性扫描路径及元素分布分别见图4、图5。

图4 0.03Li2TiO3@LiNi0.5Mn0.5O2材料的高倍透射电镜线性扫描路径Fig.4 Line scanning route of 0.03Li2TiO3@LiNi0.5Mn0.5O2material by high resolution transmission electronmicroscopy
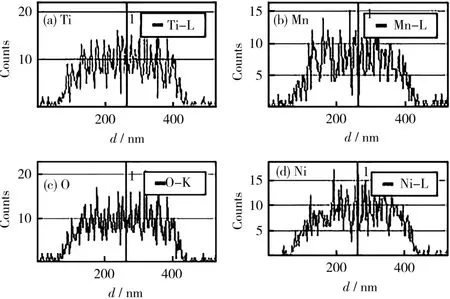
图5 0.03Li2TiO3@LiNi0.5Mn0.5O2材料的元素分布图Fig.5 Element distribution maps of 0.03Li2TiO3@LiNi0.5Mn0.5O2material
从图4可知,LiNi0.5Mn0.5O2材料表面有均匀的包覆层,厚度约为10 nm,按图4中直线所示对Ti、Mn、O和Ni元素进行线性扫描,结果显示:包覆材料所含元素分布均匀,证实了制备的材料Li2TiO3均匀地包覆在LiNi0.5Mn0.5O2材料表面。
2.2 电化学性能分析
zLi2TiO3@LiNi0.5Mn0.5O2电极的循环性能见图6。
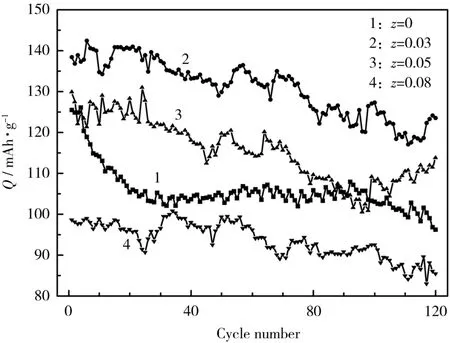
图6 zLi2TiO3@LiNi0.5Mn0.5O2电极的循环性能Fig.6 Cycle performance ofzLi2TiO3@LiNi0.5Mn0.5O2electrodes
从图6可知,LiNi0.5Mn0.5O2电极首次循环的放电比容量为125.44 mAh/g,第120次循环时下降到96.16 mAh/g,容量保持率仅为76.66%;0.03Li2TiO3@LiNi0.5Mn0.5O2电极的电化学性能明显优于其他3种电极,其中,首次放电比容量为138.40 mAh/g,比LiNi0.5Mn0.5O2电极高出10%。Li2TiO3是一种快离子导体,部分Ti4+掺杂进材料的结构降低锂镍混排,有利于 Li+的迁移,进而提高材料的放电比容量。0.03Li2TiO3@LiNi0.5Mn0.5O2电极循环120次的容量保持率为89.23%,比LiNi0.5Mn0.5O2电极约高13%。与0.03Li2TiO3@LiNi0.5Mn0.5O2电极相比,0.05Li2TiO3@LiNi0.5Mn0.5O2电极、0.08Li2TiO3@LiNi0.5Mn0.5O2电极的首次循环放电比容量都有所下降,分别为129.90 mAh/g和98.60 mAh/g,原因是Li2TiO3材料为惰性电极材料,过多的Li2TiO3包覆原材料反而会降低容量。两种电极的容量保持率分别为88.22%和86.71%,包覆Li2TiO3可提高LiNi0.5Mn0.5O2的容量保持率。这是因为Li2TiO3作为镀膜层可提高电解质与正极材料界面的稳定性,阻止材料溶入电解液。此外,部分Ti4+掺杂进入结构后,Ti—O键的解离能大于Mn—O键和Ni—O键,因此Ti4+掺杂能增强材料的结构稳定性,并提高材料的循环性能。
LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2电极的第3次和第120次充放电曲线见图7。
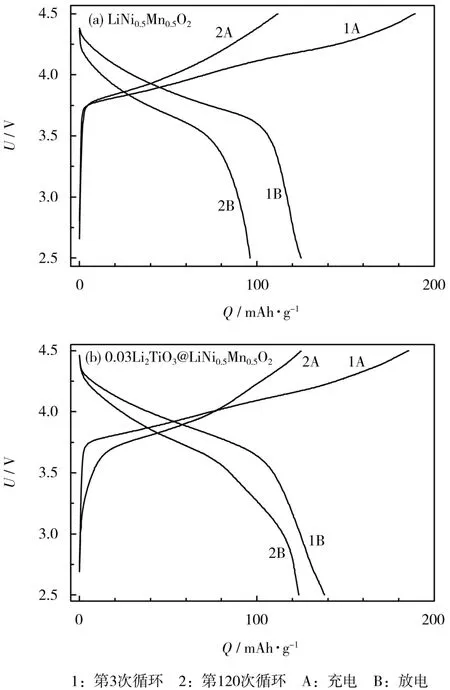
图7 LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2电极的第3次和第120次循环的充放电曲线Fig.7 The charge-discharge curves at the 3rd and 120th cycle of LiNi0.5Mn0.5O2and 0.03Li2TiO3@LiNi0.5Mn0.5O2electrodes
从图7可知,0.03Li2TiO3@LiNi0.5Mn0.5O2电极的曲线间隔更小,说明此电极的极化程度轻。另外,未包覆电极的放电中值电压由第3次的3.796 7 V下降到第120次循环的3.676 1 V;而包覆材料的放电中值电压下降程度相对更小,由第3次的3.796 0 V下降到第120次循环的3.699 2 V。由此说明,包覆Li2TiO3可以抑制电压下降,减缓极化程度,提高材料的循环稳定性。
LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2电极的倍率性能见图8。
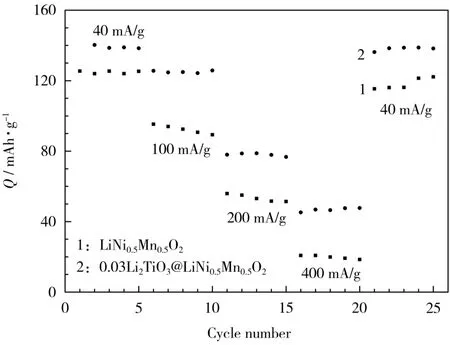
图8 LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2电极的倍率性能Fig.8 Rate capability of LiNi0.5Mn0.5O2and 0.03Li2TiO3@LiNi0.5Mn0.5O2electrodes
从图8可知,0.03Li2TiO3@LiNi0.5Mn0.5O2电极在不同的电流下的放电比容量都更高。0.03Li2TiO3@LiNi0.5Mn0.5O2电极的0.2C、0.5C、1.0C和2.0C平均放电比容量分别为139.00mAh/g、125.00 mAh/g、78.00 mAh/g和47.00 mAh/g,而LiNi0.5Mn0.5O2电极的平均放电比容量分别仅为125.00 mAh/g、92.00mAh/g、53.00mAh/g和20.00mAh/g。
包覆提高倍率性能可归纳为两个原因:①Li2TiO3包覆可阻止电极材料与电解液发生副反应,有利于维持结构的稳定性;②Li2TiO3材料是一种快离子导体,包覆过程中,部分Ti4+掺杂进材料的内部,降低锂镍混排,有利于Li+的迁移。稳定的结构和较快的Li+迁移速度,可提高材料的倍率性能。
对LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2进行阻抗测试,拟合所用的等效电路见图9,结果见图10,其中:Rele代表欧姆阻抗;Rsei代表界面阻抗;Rct代表转移阻抗;W代表扩散元件;Csei代表界面电容;Cdl代表双电层电容。拟合结果汇总于表1。
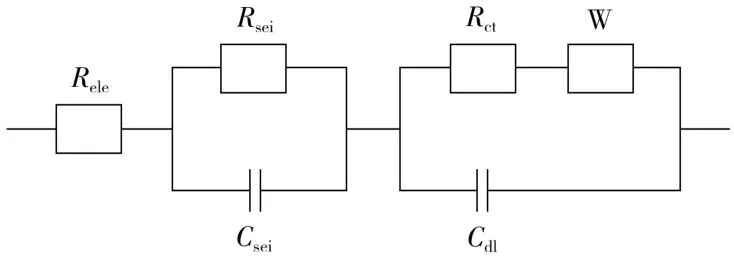
图9 阻抗拟合用的等效电路图Fig.9 Equivalentelectrical circuitdiagram for impedance fitting
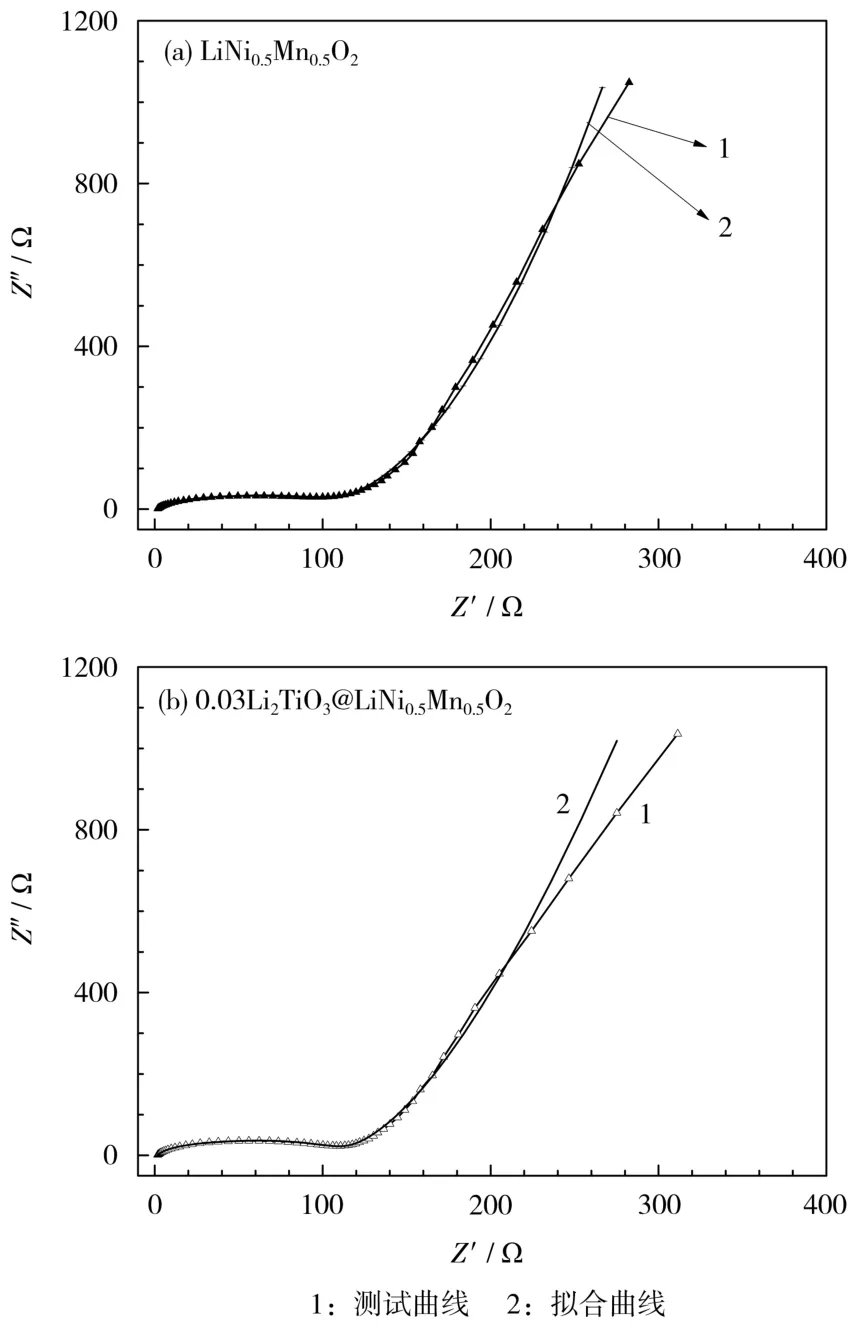
图10 LiNi0.5Mn0.5O2和 0.03Li2TiO3@LiNi0.5Mn0.5O2电极的阻抗谱Fig.10 Impedance plots of LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2electrodes
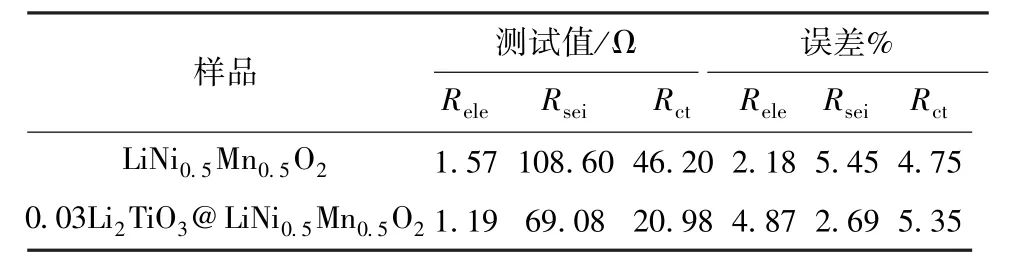
表1 LiNi0.5Mn0.5O2和0.03Li2TiO3@LiNi0.5Mn0.5O2电极的阻抗测试结果Table 1 Impedance test results of LiNi0.5Mn0.5O2and 0.03 Li2TiO3@LiNi0.5Mn0.5O2electrodes
实验结果表明,0.03Li2TiO3@LiNi0.5Mn0.5O2电极的Rsei和Rct都低于LiNi0.5Mn0.5O2电极,包覆电极的Rsei相对较小,说明包覆Li2TiO3可降低正极材料与电解液间的副反应;包覆电极的Rct较小,说明包覆Li2TiO3可加快Li+迁移速率。
3 结论
用共沉淀法、水热法和固相法相结合的方法,合成了zLi2TiO3@LiNi0.5Mn0.5O2(z=0、0.03、0.05 和 0.08)样品。 所合成的材料结晶度高,无杂质并且包覆前后的样品具有相似的颗粒大小,在Li2TiO3被均匀地包覆LiNi0.5Mn0.5O2的同时,部分Ti4+被掺杂到结构中。
0.03Li2TiO3@LiNi0.5Mn0.5O2电极具有最好的电化学性能,如最高的放电比容量(138.40 mAh/g)、最佳的循环稳定性(89.23%)和最好的倍率性能。原因是:包覆0.03Li2TiO3可减少材料与电解液的副反应,使结构更稳定;Li2TiO3具有三维通道且Ti4+掺杂能降低锂镍混排,提高Li+迁移速率。
