植物生长调节剂对‘绿岭’核桃组培苗瓶内生根及内源激素含量的影响
2021-03-18张新超张新宇张雪梅齐国辉
张新超,张新宇,唐 敏,张雪梅,3,4,李 寒,3,4,齐国辉,3,4
(1.河北农业大学 林学院,河北 保定071000; 2.新疆农业大学 现代科学技术学院,新疆 乌鲁木齐 830091;3.河北省核桃工程技术研究中心,河北 临城 054300;4.河北省(邢台)核桃产业技术研究院,河北 临城 054300)
核桃(Julans Regia L.)又称胡桃、羌桃,属胡桃科胡桃属,原产于我国,是栽培历史悠久的重要经济林树种之一[1]。当前核桃普遍采用的育苗方法是方块形芽接嫁接繁育,需2 ~3 年出圃,产苗量低,繁殖系数低;同时核桃嫁接用的砧木一般采用实生繁殖,需要大量的优质核桃种子,因此,相对于其他树种,核桃嫁接育苗成本很高。组织培养育苗具有繁殖系数高、速度快等优点,已经在甜樱桃、软枣猕猴桃[2-3]等经济林树种上应用;且组织培养还可以用于育种、转基因、植物生理代谢等方面的研究。在植物组织培养过程中激素起着重要的调控作用。研究发现,内源激素IAA 对根原基的发育、生长有诱导作用[4]。GA3是通过改变根内皮层细胞分裂和伸长的速度,来影响根中其他细胞的分裂和伸长[5]。ABA 是生长抑制激素,在植物体内起到负调控作用[6]。ZT 促进细胞质的分裂的同时对植物的芽生长、分化有较大影响[7]。组培苗瓶内生根阶段,生根培养基中需添加生长素类植物生长调节剂,多以IBA 为主,其次是K-IBA[8-9],外源生长调节剂通过调控内源激素来诱导外植体形成不定根。因此,研究植物组织培养过程内源激素含量变化,对探究内源激素调控组培苗的不定根形成与分化具有重要意义。现在美国一些实验室已经将组织培养方法获得的优质核桃砧木苗应用于大田生产,国内也逐步提高经济林苗木组织培养技术[10-11],本试验研究了外源生长调节剂 K-IBA 和IBA 处理对‘绿岭’核桃瓶内生根的影响及瓶内生根过程中内源激素的变化,旨在探讨其组培生根机理,为核桃的高效栽培提供无性繁殖理论依据。
1 材料与方法
1.1 试验材料
‘绿岭’核桃继代组培苗(高度为4 ~6 cm)。
1.2 试验方法
1.2.1 生根试验设计 采用随机区组设计,共6 个处理,分别为:处理1(D1),K-IBA 5 mg/L;处理2(D2),K-IBA 10 mg/L;处理3(D3),K-IBA 15 mg/L;处理4(D4),IBA 1 mg/L;处理5(D5),IBA 3 mg/L;处理6(D6),IBA 5 mg/L,基本培养基为1/2 DKW,蔗糖40 g/L,琼脂2.28 g/L。每20 瓶为一小区,每个处理重复 3 次,每瓶接种3 棵组培苗。
1.2.2 培养条件 培养室温度(27±2) ℃,光强度2 000 Lx,光照时间15 h/d。
1.2.3 生根过程观察及取样方法 接种后放入纸箱,进行暗培养,每天进行1 次照光、每次1 h,20 d 后转移到普通日光灯下进行光照培养;每隔10 d 进行1 次生根形态统计,分别记录愈伤组织出现期、不定根出现期和发生的部位以及根系的生长过程;培养50 d 后统计组培苗生根率、根长、根系直径。接种后当天取样1 次,光照培养期间每隔10 d 从各处理中取样1 次,共计5 次。从每个重复中随机抽取5 棵组培苗,迅速用蒸馏水将根部冲洗干净(20 d生根苗的韧皮部和愈伤组织、30 d 愈伤组织和少量根尖、40 d 根尖和少量根样及50 d 根样),滤纸擦干,然后将根系剪碎混匀后用液氮速冻,放于-80 ℃冰箱中保存待测;接种0 d 的采集无根组培苗基部1 cm 的皮层用于测定内源激素。
1.2.4 内源激素测定方法 称取样品1 g,用6 mL 80% 的预冷色谱甲醇研磨成粉于离心管中,4 ℃ 12 000 r/min 离 心10 min,加 入0.03 g 抗 氧 化 剂(PVPP),4 ℃ 8 000 r/min 离心5 min,4 ℃避光浸提12 h。取1 mL 上清液,3 mL 1%冰乙酸(超净水配制),将4 mL 混合液倒入C18 小柱滤出,加5 mL 10%甲醇再滤出,加1 mL(含5 g/L 80%甲醇)混合液并收集,用0.45 μm 的微孔滤膜过滤打入进样瓶用于检测。用流速Waters1525 高效液相色谱仪[12-13]测定IAA、GA3、ABA 和ZT 的含量。
1.3 数据分析
数据统计处理、图表制作运用 Excel 2007。SPSS 22.0 进行方差分析和多重比较。
2 结果与分析
2.1 不同植物生长调节剂对‘绿岭’核桃组培苗瓶内生根的影响
不同植物生长调节剂对‘绿岭’核桃组培苗瓶内生根的影响见表1。从表1 中可看出,随K-IBA浓度的增加,组培苗的生根率先降低后升高,根的长度呈升高趋势,根系直径先升高后降低。随着IBA 浓度的增加,组培苗的生根率和根长先升高后降低,根系直径呈升高趋势。D3 处理生根率、平均根长及根系活力达最高,分别为51.85%、26.87 mm及47.37 μg/g·TTF,极显著高于其他处理(P<0.01)。D5、D6 处理根系直径依次为3.80 和3.94 mm,极显著高于其他处理。由此可见,D3(即K-IBA 浓度为15 mg/L)处理植物生长调节剂对‘绿岭’核桃瓶内生根生长有显著影响,生根情况最好。
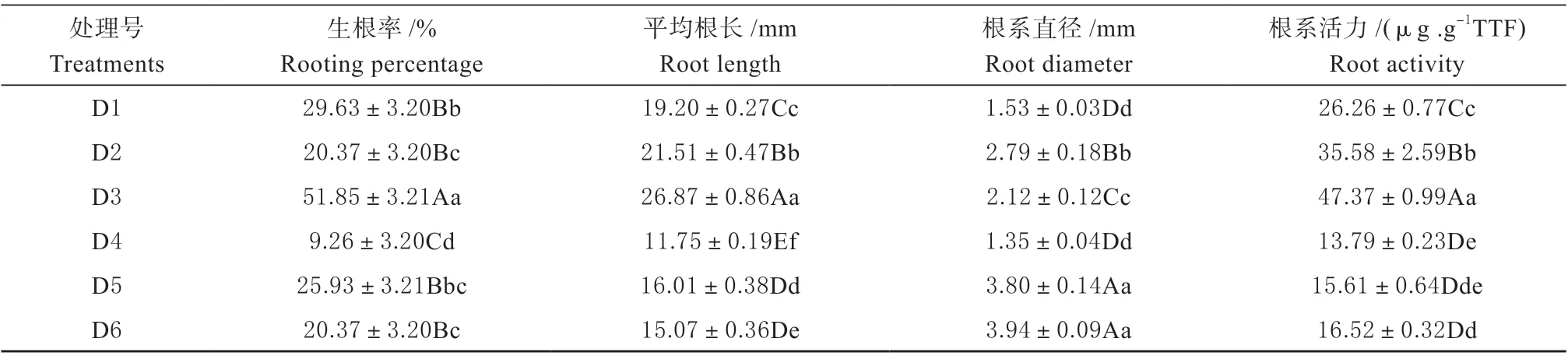
表1 不同植物生长调节剂处理下‘绿岭’核桃瓶内生根及形态情况Table 1 Roots and morphology of the ‘Lvling’ walnut in vitro rooting seedlings under different plant growth regulators
2.2 不同植物生长调节剂对‘绿岭’核桃组培苗瓶内生根进程形态观察
不同植物生长调节剂对‘绿岭’核桃组培苗瓶内生根进程基部形态观察发现,暗培养20 d 后,各处理组培苗基部皮孔膨大外凸、呈开裂迹象,少量愈伤组织开始出现(如图2A、D 所示);到30 d(光照10 d 后)愈伤组织逐渐膨大,愈伤组织基部有白色突起(如图2B 所示);40 d 时D6 处理根长32.51 mm(如图1E 所示),因此在生根培养40 d前已有少量根原基的形成40 d 后不定根逐渐伸长;生根培养50 d 时D6 不定根根长达47.32 mm(如图1F 所示)。观察发现,K-IBA 处理组培苗培养23 d前后开始生根,愈伤组织多;IBA 处理组培苗培养28 d 前后开始生根,根系生长快且根粗。

图1 ‘绿岭’核桃组培苗瓶内生根进程Fig.1 Rooting process of ‘Lvling’ walnut tissue culture seedlings
2.3 不同植物生长调节剂对‘绿岭’核桃组培苗瓶内生根过程内源激素含量的影响
2.3.1 不同植物生长调节剂对IAA 含量变化 不同植物生长调节剂对‘绿岭’核桃瓶内生根过程中IAA 含量变化的影响如图2 所示,随着培养时间的延长,各处理IAA 含量呈现降低—升高—降低的变化趋势。0 d 的IAA 含量为186.49 μg /g·FW。D1、D3、D6 处理的IAA 含量在培养30 d 时达到最高值,D2、D5 处理40 d 时达到最高值。30 d 时D3处理IAA 含量最高,为221.34 μg /g·FW,极显著高于其他处理。40 d 时D2、D3 处理IAA 含量分别为204.80 μg /g·FW、194.89 μg/g·FW,极显著高于其他处理。由此可见,D3(即K-IBA 浓度为15 mg/L)处理对‘绿岭’核桃组培苗内源激素IAA 含量有显著影响,IAA 含量在20 ~30 d 时迅速升高,组培苗开始生根。

图2 ‘绿岭’核桃组培苗瓶内生根过程中IAA 含量变化Fig.2 Changes of IAA content in ‘Lvling’ walnut tissue culture seedlings during in vitro rooting process
2.3.2 不同植物生长调节剂对GA3 含量变化 不同植物生长调节剂对‘绿岭’核桃瓶内生根过程中GA3含量变化的影响如图3 所示,随着培养时间的延长,D1 ~D3、D5、D6 处理GA3含量呈现先升高后降低的变化趋势,D4 处理呈现降低的变化趋势。D1 ~D4 处理GA3含量在培养20 d 时达到最高值,D5、D6 处理30 d 时达到最高值。0 d 的GA3含量为548.84 μg/g·FW。20 d 时D3 处理GA3含量最高,为1 945.55 μg/g·FW,极显著高于其他处理。30 d时D6 处理GA3含量最高,为965.01 μg/g·FW,极显著高于其他处理。由此可见,D3、D6(即K-IBA浓度为15 mg/L、IBA 浓度为5 mg/L)处理植物生长调节剂对‘绿岭’核桃组培苗内源激素GA3含量有显著影响,其中D3 处理GA3含量在培养0 ~20 d 时升高,组培苗愈伤组织迅速生长;D6处理GA3含量在培养20 ~30 d 时升高,组培苗愈伤组织生长。
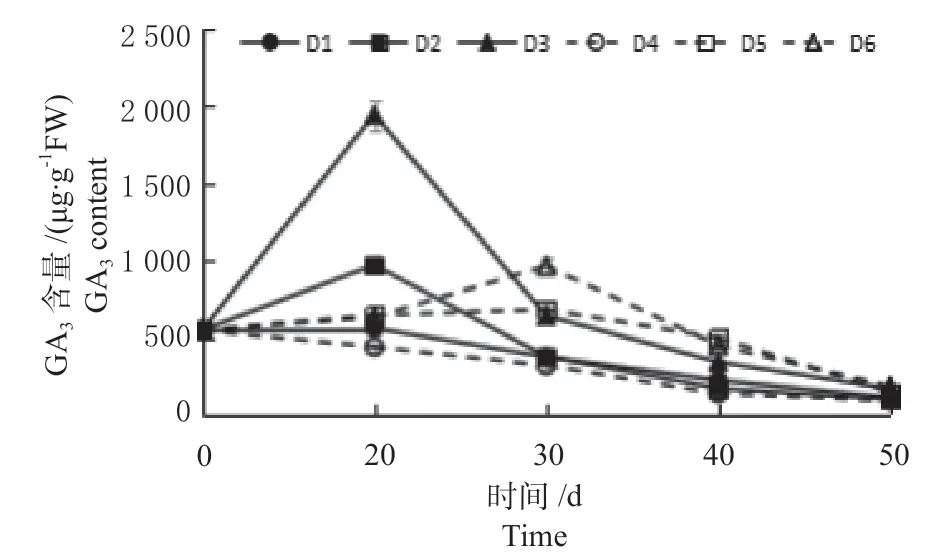
图3 ‘绿岭’核桃组培苗瓶内生根过程中GA3 含量变化Fig.3 Changes of GA3 content of ‘Lvling’ walnut tissue culture seedlings during in vitro rooting process
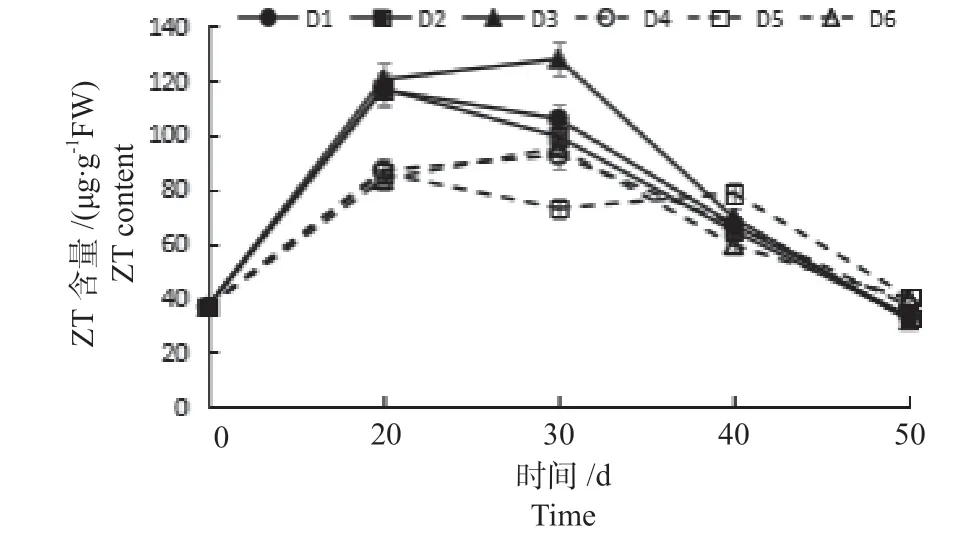
图4 ‘绿岭’核桃组培苗瓶内生根过程中内源激素(ZT)含量的变化Fig.4 The changes of ZT content of ‘Lvling’ walnut tissue culture seedlings during in vitro rooting process
2.3.3 不同植物生长调节剂对ZT 含量变化 不同植物生长调节剂对‘绿岭’核桃瓶内生根过程中ZT含量变化的影响如图4 所示,随着培养时间的增加,D1 ~D4、D6 处理ZT 含量呈现升高后降低的变化趋势,D5 处理呈现降低—升高—降低的变化趋势。0 d 的ZT 含 量 为36.28 μg/g·FW。D1、D2、D5 处理ZT 含量在培养20 d 时达到最高值,D3、D4、D6 处理30 d 时达到最高值。20 d 时D1 ~D3 处理ZT 含量依次为116.76、117.00、120.33 μg/g·FW,极显著高于D4 ~D6 处理。30 d 时D3 处理ZT 含量最高,为127.50 μg/g·FW,极显著高于其他处理。由此可见,D3(即K-IBA 浓度为15 mg/L)处理植物生长调节剂对‘绿岭’核桃组培苗内源激素ZT 含量有显著影响,ZT 含量在培养0 ~30 d时不断升高,组培苗愈伤组织省长且开始生根,生根率最好。2.3.4 不同植物生长调节剂对ABA 含量变化 不同植物生长调节剂对‘绿岭’核桃瓶内生根过程中ABA 含量变化的影响如图5 所示,随着培养时间的延长,D1 ~D3、D5、D6 处理ABA 含量呈现升高后降低的变化趋势,D4 处理呈现降低后升高的变化趋 势。0 d 的ABA 含 量 为8.47 μg/g·FW。D4 处 理ABA 含量在培养40 d 时达到最低值,D1 ~D3、D5、D6 处理50 d 时达到最低值。20、30、40 d 时D4 处理ABA 含量均最低,分别为8.20、5.19 和5.12 μg/g·FW,且极显著低于其他处理。50 d 是D3、D4、D6 处理ABA 含量依次为5.55、6.66 和6.58 μg/g·FW,极显著低于其他处理。由此可见,D4(即IBA 浓度为1 mg/L)处理植物生长调节剂对‘绿岭’核桃组培苗内源激素ABA 含量有显著影响,该处理的ABA 含量在培养期间都很低,组培苗生长情况最好,但是生根效果不好。

图5 ‘绿岭’核桃组培苗瓶内生根过程中ABA 含量变化Fig.5 Changes of ABA content of ‘Lvling’ walnut tissue culture seedlings during in vitro rooting process
2.3.5 不同植物生长调节剂对IAA/ZT 值变化 不同植物生长调节剂对‘绿岭’核桃内生根过程中IAA/ZT 值变化的影响如图6 所示,随着培养时间的增加,D1 ~D3 处理IAA/ZT 比值呈现降低—升高—降低的变化趋势,D4 ~D6 处理呈降低后升高趋势。0 d 的IAA/ZT 比值均为5.14。D1 ~D3 处理IAA/ZT 比值在培养40 d 时达到最高值。30 d 时D2、D3处理IAA/ZT 比值分别为1.72、1.74,极显著高于其他处理。40 d时D2、D3处理IAA/ZT比值分别为3.19、2.85,极显著高于其他处理。在培养30 ~40 d 时,D2、D3 处理组培苗IAA/ZT 比值高,组培苗根系活力高;在培养期间D4 处理IAA/ZT 比值均极显著低于其他处理,组培苗生长情况最好。
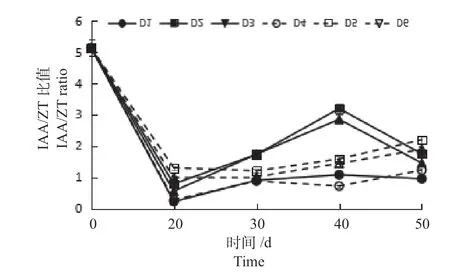
图6 ‘绿岭’核桃瓶内生根过程中内源激素(IAA/ZT)含量的变化Fig.6 The changes of IAA/ZT ratio of ‘Lvling’ walnut tissue culture seedlings during in vitro rooting process
2.3.6 不同植物生长调节剂对IAA/ABA 值变化 不同植物生长调节剂对‘绿岭’核桃瓶内生根过程中IAA/ABA 值变化的影响如图7 所示,随着培养时间的增加,D1 ~D4 处理IAA/ABA 比值呈现降低—升高—降低的变化趋势,D5、D6 处理呈现降低后升高的变化趋势。0 d 的IAA/ABA 比值为22.02。D2 ~D4 处理30 d 时达到最高值,D1 处理40 d 时达到最高值。20 d 时D3、D5、D6 处理IAA/ABA比值依次为6.33、6.96、6.35,极显著高于D1、D2、D4 处 理。30 d、40 d 时D3 处 理IAA/ABA 比值均最高,分别为19.59、14.51,且极显著高于其他处理。D3、D4 处理培养20 ~30 d 时IAA/ABA比值升高,其中D3 处理愈伤组织生长且部分组培苗长出根尖;D4 处理在经过10 d 的暗培养后组培苗生长情况好。

图7 ‘绿岭’核桃瓶内生根过程中内源激素(IAA/ABA)含量的变化Fig.7 The changes of IAA/ABA ratio of ‘Lvling’ walnut tissue culture seedlings during in vitro rooting process
3 讨论
组培苗瓶内生根阶段,生根培养基中添加生长素类植物生长调节剂,随着各处理组培苗生根变化,内源激素含量随之发生变化[14-15]。植物生长调节剂浓度对不同植物种类生根情况的影响存在一定的差异,当添加的植物生长调节剂浓度过高时,会抑制内源激素含量的产生,从而影响到细胞分裂与分化[16-18]。陈凌艳等[19]在研究IBA 对西洋杜鹃组培苗生根处理的影响时发现IBA 对生根有明显的促进作用,即IBA 浓度升高组培苗生根数量也会增加,但过高的IBA浓度会产生一定的抑制作用。李代丽[20]利用IBA 处理白刺组培苗,1.0 mg/L IBA 处理能较好的促进愈伤组织的形成,提高内源激素的含量,进而有利于组培苗的生长及愈伤组织的分化效果。
本研究发现,适宜浓度的K-IBA 与IBA 处理对组培苗的生根率和根长及根系直径都具有显著促进作用。组培苗生根培养后随着K-IBA 浓度升高,生根率、根长及根系活力都明显提高,说明K-IBA 能增强生根苗内细胞的代谢过程,促进根原基的诱导和形成,进而促进生根。‘绿岭’核桃组培苗发根部位为愈伤组织周围,组培苗瓶内生根培养0 ~20 d左右K-IBA 处理和高浓度的IBA 处理生根组培苗愈伤组织不断生长。K-IBA 处理培养20 d 后所有幼苗下端均可形成愈伤组织,培养23 d 左右部分组培苗愈伤组织周围有白色根尖凸出,20 ~30 d 为生根的高峰期,30 ~40 d 期间根不断伸长、加粗,其中15 mg/L K-IBA 处理组培苗生根效果最好;IBA 处理培养25 d 后所有幼苗下端均可形成愈伤组织,培养28 d 左右部分组培苗愈伤组织周围有白色根尖凸出,25 ~35 d 为生根的高峰期,40 d 后不再生根,其中1 mg/L IBA 浓度处理组培苗生长情况最好但是生根效果最不理想。植物生长调节剂通过影响内源激素含量的动态变化,进而调控组培苗不定根的形成,与裴东[21-23]等研究发现一致。 高浓度K-IBA处理生根组培苗内源激素IAA 含量高于IBA 处理,说明适宜浓度的K-IBA 处理有利于IAA 的合成。在组织培养中,赤霉素与生长素共同诱导木质部与韧皮部的分化,但与生长素不同,GA3对生根苗不定根伸长产生了抑制作用[24-25],因此在培养0 ~20 d时10 mg/L K-IBA、15 mg/L K-IBA 处理生根组培苗GA3含量上升,愈伤组织生长;在培养30 ~50 d时各处理生根组培苗GA3含量逐渐下降,不定根逐渐伸长。15 mg/L K-IBA 处理IAA/ABA 比值和IAA/ZT 比值均高,说明适宜浓度植物生长调节剂处理组培苗生根能力强,有利于根系的分化。1 mg/L IBA 处理生根组培苗IAA/ABA 比值高但IAA/ZT 比值低,说明植物生长调节通过影响ABA、ZT 的合成来促进生根组培苗的生长。综上所述,‘绿岭’核桃瓶内生根的最佳植物生长调节剂为K-IBA,适宜的浓度为15 mg/L,经过该处理的生根苗内源激素的动态变化,说明有利于愈伤组织的生长,可以共同调控组培苗不定根的形成。
