耐碳青霉烯类大肠埃希菌对替加环素异质性耐药的机制
2021-03-18刘宇阳蓝锴熊蕊鲁洋蔡依玫向国秀陈茶黄彬
刘宇阳 蓝锴 熊蕊 鲁洋 蔡依玫 向国秀 陈茶 黄彬★
大肠埃希菌(Escherichia coli,E.coli)是条件致病菌,常导致免疫低下人群感染[1]。2019年耐碳青霉烯类大肠埃希菌(carbapenem-resistantEscherichia coli,CREC)的全国平均分离率为1.7%,比2018年上升了0.2%。随着多粘菌素耐药基因mcr-1的检出[2],替加环素(tigecycline,TGC)被认为是治疗CREC 的最后一道防线[3]。不幸的是,已有大量报道显示细菌对TGC 耐药,其主要耐药机制是RND(resistance nodulation division,RND)外排泵系统的上调[4]。研究表明,大肠埃希菌中AcrAB受全局调控因子MarAB 的调控[5],其外膜通透性受主要膜孔蛋白OmpC、OmpF 和OmpX 的调节[6]。异质性耐药(heteroresistance,HR)意指同一克隆菌株中同时存在对某种抗生素耐药和敏感亚群的现象[7]。HR 的难检出性常导致临床治疗失败和感染复发。目前,耐碳青霉烯类阴沟肠杆菌对TGC 异质性耐药已有报道[8],但尚未见CREC-TGC-HR 的报道。本研究对检测异质性耐药的方法进行比较,分析并探讨CREC-TGC-HR的流行情况和耐药机制,为临床治疗和合理应用抗生素提供依据。
1 材料与方法
1.1 菌株来源
收集2017年1月至2019年3月间广州(中山大学附属第一医院17 株、广东省中医院23 株)和宁夏(宁夏医科大学宁夏总医院18 株)两个地区三个中心临床分离的CREC,所有菌株均经Vitek 2 全自动微生物鉴定系统鉴定。质控菌株为大肠埃希菌ATCC 25922,由广东省中医院大学城医院检验科微生物室保存。
1.2 主要仪器与试剂
TGC 粉末购自英国APE-BIO 公司,Mueller-Hinton(M-H)琼脂或M-H 肉汤购自英国Oxoid 公司,Vitek 2 全自动微生物检测系统购自法国生物梅里埃公司,RNA 提取试剂RNAiso Plus、qPCR 试剂盒SYBR Green qPCR Master Mi 和逆转录试剂盒PrimeScript RT 均购自中国大连TaKaRa 公司。ViiA 7 Dx 荧光定量PCR 仪购自美国Applied Biosystems 公司,GBox 全自动凝胶成像仪购自美国Bio-Rad 公司。PCR 引物均由生工生物工程(上海)股份有限公司合成。
1.3 改良E-test
参考Andersson 等的方法[7]:将菌液调至2.0 麦氏浊度后,均匀涂布于M-H 平板,贴相应的E-test试纸条,37℃孵育48 h 后观察结果。
1.4 异质性耐药表型初筛
采用菌群谱型分析微量滴定法(microtitration population analysis profiling,MPAP)[9],配置2-4~24mg/L 共9 个倍比稀释浓度含TGC 的M-H 平板。细菌接种于M-H 肉汤培养基,37℃过夜增菌后,用M-H 肉汤稀释至101~107CFU/mL。取10 μL 菌液滴定于PAP 梯度抗生素平板,每克隆重复两滴,实验重复三次。37℃孵育48 h 后观察细菌生长情况。若最低抑菌浓度(minimum inhibitory concentration,MIC)与最高不抑菌浓度(the highest noninhibitory concentration,HNIC)的比值大于8,初筛为TGC-HR 阳性。对照菌株为非异质性耐药的大肠埃希菌ATCC 25922 和临床分离的泛耐药大肠埃希菌132A5(本实验室分离的菌株)。
1.5 异质性耐药表型确认
采用菌群谱型分析法(population analysis profiling,PAP)[7],配置2-4~24mg/L 共9 个倍比稀释浓度含TGC 的M-H 平板。将HR 阳性菌株接种于M-H 肉汤培养基,37℃过夜增菌,梯度稀释后,取20 μL 菌液均匀涂布于PAP 梯度抗生素平板,重复三次。37℃孵育48 h 后菌落计数,并使用Graph-Pad Prism 软件将菌落数量与TGC 浓度作图,若MIC 与HNIC 比值大于8,确认为HR 阳性。对照菌株为非异质性耐药的大肠埃希菌ATCC 25922和临床分离的泛耐药大肠埃希菌132A5(本实验室分离的菌株)。
1.6 基因表达分析
基于PAP 试验,收集CREC-TGC-HR 母菌和异质性耐药亚群各6 株,接种于M-H 肉汤培养基,37℃过夜增菌。用Trizol 法提取菌株的mRNA。参照逆转录试剂盒PrimeScript RT 逆转录出cDNA。参照SYBR Green 试剂盒进行RT-qPCR,并通过相对定量法(2-ΔΔCt)计算各基因相对表达量。qPCR 反应条件:预变性95℃30 s;变性95℃5 s,退火60℃34 s,共40 个循环;熔解曲线95℃15 s,60℃60 s,95℃15 s。所用的PCR 引物序列见表1。

表1 大肠埃希菌RT-qPCR 引物序列[10]Table 1 RT-qPCR primer sequence of E.coli[10]
1.7 统计学分析
采用SPSS 23.0 软件进行统计分析,计量资料以(±s)表示,并进行两独立样本的t检验。计数资料以n(%)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CREC 临床和流行病学特征
本研究共收集到58 株CREC 中最常见的标本类型是痰液20.7%(17/58)和尿液13.4%(11/58),其次是血液11%(9/58)和引流液9.8%(8/58)。科室分布主要是重症监护室(24.4%,20/58)、内科(23.2%,19/58)和外科(18.8%,15/58)。根据Vitek 2 全自动微生物检测系统的药敏检测结果,58 株CREC 中有两株菌对TGC 耐药,后续实验中剔除这两株菌(中山大学附属第一医院和宁夏总医院各1 株)。
2.2 HR 的初筛
对56株TGC敏感菌株进行HR初筛,改良E-test结果显示,14 株CREC-TGC-HR 阳性(25.0%)。MPAP 结果显示,22 株CREC-TGC-HR 阳性(39.3%),其中31.8%(7/22)来自中山大学附属第一医院,22.7%(5/22)来自宁夏总医院,45.5%(10/22)来自广东省中医院。见图1。
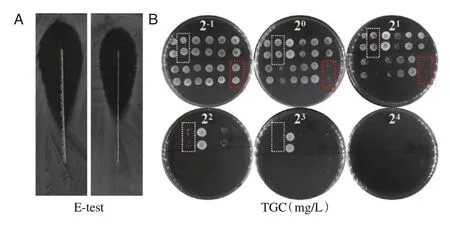
图1 CREC-TGC-HR 的MPAP 结果Figure 1 The results of carbapenem-resistanct E.coli CRECHR to tigecycline by microtitration PAP method
2.3 HR 的确认
56 株TGC 敏感的CREC 中,有21 株表现为替加环素异质性耐药(CREC-TGC-HR),检出率为37.5%(21/56)。中山大学附属第一医院、广东省中医院和宁夏总医院CREC-TGC-HR 的检出率分别是43.8%(7/16)、43.5%(10/23)和23.5%(4/17),两两间比较差异无统计学意义(P>0.05)。从标本种类分布来看,阳性菌株主要来源于痰液(47.6%,10/21)和尿液(19.0%,4/21)等体液标本。从科室分布来看,阳性菌株主要来源于ICU(38.0%,8/21)、内科(28.6%,6/21)和外科(19.0%,4/21)。见图2。
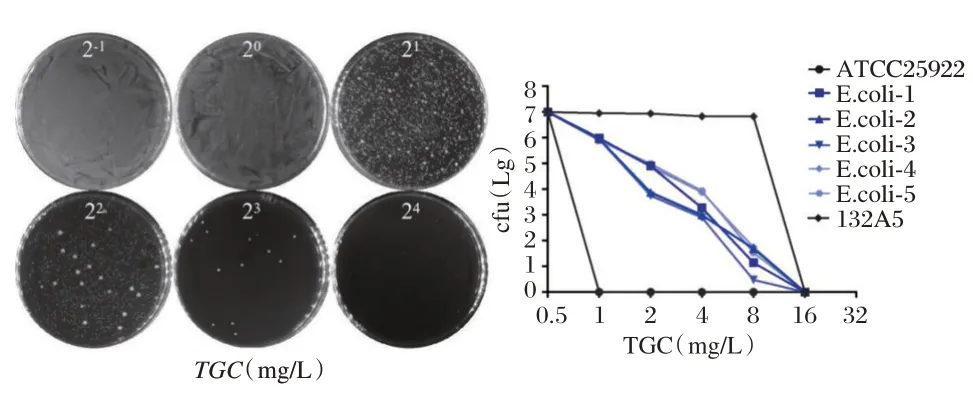
图2 CREC-TGC-HR 的PAP 结果Figure 2 Population analysis profiles(PAP)of TGC-HR in CREC
2.4 异质性耐药机制
与CREC-TGC-HR 原始菌株相比,CREC-TGCHR 耐药亚群外排泵基因acrA、acrB表达上调1.79倍、5.01 倍;其相关调控基因marA、marB分别表达上调5.38 和2.18 倍;膜孔蛋白基因ompC下调2.35倍,差异均有统计学意义(P<0.05)。膜孔蛋白基因ompF和ompX的表达比较差异无统计学意义(P>0.05)。见表2。
表2 CREC-TGC-HR 原始菌株和耐药亚群各基因mRNA相对表达量(±s)Table 2 Relative mRNA level of gene expression of native populations and HR-subpopulations in CREC-TGC-HR(±s)
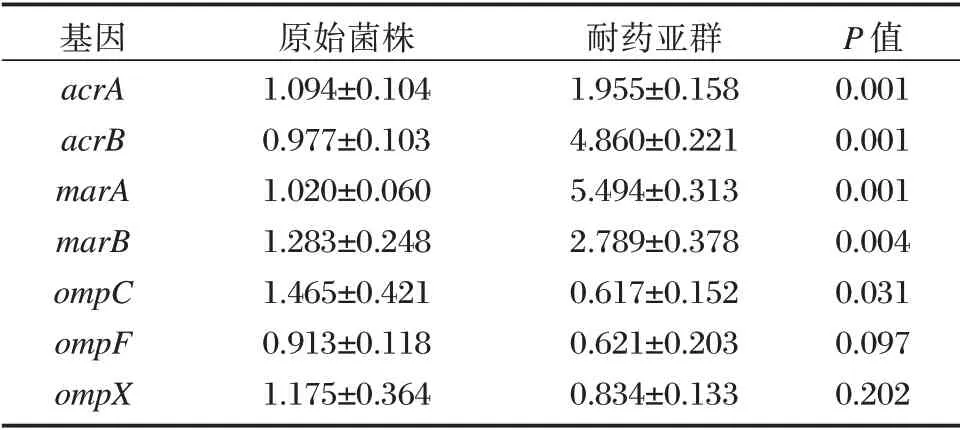
表2 CREC-TGC-HR 原始菌株和耐药亚群各基因mRNA相对表达量(±s)Table 2 Relative mRNA level of gene expression of native populations and HR-subpopulations in CREC-TGC-HR(±s)
基因acrA acrB marA marB ompC ompF ompX原始菌株1.094±0.104 0.977±0.103 1.020±0.060 1.283±0.248 1.465±0.421 0.913±0.118 1.175±0.364耐药亚群1.955±0.158 4.860±0.221 5.494±0.313 2.789±0.378 0.617±0.152 0.621±0.203 0.834±0.133 P 值0.001 0.001 0.001 0.004 0.031 0.097 0.202
3 讨论
自1997年首次报道甲氧西林异质性耐药金黄色葡萄球菌[11]以来,已在一些细菌中发现异质性耐药现象,如肺炎克雷伯菌[12]、肺炎链球菌[13]、结核分枝杆菌[14]、鲍曼不动杆菌[15]、铜绿假单胞菌[16-17]和幽门螺杆菌[18]等临床常见致病菌。目前,国内也有少量关于CRE 异质性耐药的报道[19-20],但其耐药机制不够明确。这些研究大多基于纸片扩散法(Kirby-Bauer,K-B 法)和E-test 法进行HR 初筛。研究发现,K-B 法和E-test 法均存在较高的假阴性率[9],导致HR 的漏检。本研究结果表明,改良E-test 法与PAP 的阳性检出率相比差异具有统计学意义(P<0.05),提示E-test 法筛查CREC-HR 存在较高的假阴性率。MPAP 法阳性检与PAP 相比,差异无统计学意义(P>0.05),提示MPAP 法是目前最接近HR检测金标准PAP 法的检测方法。MPAP 法既比K-B 法和E-test 法有更高的准确度,又比PAP 节约检测成本,操作更简便。但是由于MPAP 采用微量滴定的方法,仍存在一定的假阳性率,仅作为HR 的初筛方法,其实验结果需要用PAP 确认。
有文献报道耐碳青霉烯类阴沟肠杆菌对TGC的异质性耐药率为20.0%(28/140)[21],铜绿假单胞菌对头孢吡肟的异质性耐药率为57.3%(110/223)[17],出现这种差异可能与抗生素种类、细菌种类以及地区差异等因素有关。虽然目前细菌对TGC 的耐药率还处于较低水平,鉴于本研究中发现CREC 对TGC 较高水平的异质性耐药率,应该高度重视关注这个问题。
据报道,大肠埃希菌TGC耐药机制与RND家族AcrAB-TolC 有关,AcrAB 同时受外排泵调节网络中MarAB的调节;marA位点直接或间接增加了micF的表达,导致ompF的表达减少[22]。本研究结果提示RND 外排泵上调与替加环素异质性耐药显著相关。
本研究中大部分CREC 分离自ICU,这部分患者大多数合并多种基础性疾病,且病情复杂,免疫能力相对低下,加上用药情况复杂,更容易感染CREC。大部分CREC 标本来自痰液和尿液,可能与呼吸道和尿道感染有关。但由于本研究存在局限性,CREC 临床标本相对较少,因此,若要进行下一步危险因素分析,仍需扩大样本量。
综上所述,CREC 对TGC 有较高的异质性耐药率。CREC-TGC-HR 与RND 外排泵系统上调有关。采用有效的方法及时检测HR 菌株,有助于临床合理用药,避免HR 菌株发展为耐药菌,可缩短治疗时间和减轻患者负担。
