基因突变筛查对急性髓性白血病患者临床诊疗的获益对比分析
2021-03-18张阳王芳房建成王明宇刘洪徐雯陈雪曹泮翔虞亚菲马小丽李绵洋刘红星
张阳 王芳 房建成 王明宇 刘洪 徐雯 陈雪 曹泮翔 虞亚菲 马小丽 李绵洋 刘红星,3,4★
近年来,基因测序技术和肿瘤分子生物学研究飞速发展,很多的分子病因被鉴定,其中对临床诊断/分类、预后分层及治疗具有重要意义的基因异常已经越来越多地被加入到血液肿瘤诊疗指南中[1-4],分子指标所占的比重越来越大。2018 版二代测序(Next generation sequencing,NGS)血液肿瘤应用中国专家共识中,AML 中必要检测的突变基因有17 种,建议检测的突变基因有21 种[5]。2016年版世界卫生组织(World Health Organization,WHO)造血和淋巴组织肿瘤分类标准中所涉及的血液肿瘤相关体细胞突变基因就有100 多种[1]。因此,血液肿瘤的基因突变分析已不再局限于仅检测少数几个分子指标,而是强调进行“突变组”分析。但随着检测基因数目的增加,新加入基因的突变阳性率也在减低,基因突变筛查项目中所涵盖的检测基因数目及其可提供的临床意义也存在争议。本研究拟对比分析三种包含不同基因数目基因突变筛查的应用,以评估其对急性髓性白血病(Acute myeloid leukemia,AML)患者临床诊疗获益的情况。
1 资料与方法
1.1 一般资料
选取2015年6月至2019年5月期间就诊于本院的721例AML 患者为研究对象,其中男409例,女312例,年龄1~75 岁,平均(25.44±18.68)岁。纳入标准:①AML 的诊断符合世界卫生组织2016年版造血和淋巴组织肿瘤分类标准[1];②初诊未经治疗的患者。排除标准:治疗相关AML 和继发AML患者。本研究经河北燕达陆道培医院伦理委员会批准,患者或家属均已签署知情同意书。
1.2 基因组DNA 制备
收集患者初诊时的骨髓或骨髓涂片标本,新鲜骨髓标本裂解红细胞后进行细胞计数,取1.0×107个有核细胞提取基因组DNA。骨髓涂片细胞用移液器和纯水反复吹洗,用得到的细胞悬液提取基因组DNA.参照TGuide S32 血液基因组DNA 提取试剂盒(北京天根生化科技有限公司,货号:No.DP601-T5C)说明书采用磁珠法提取基因组DNA。
1.3 基因突变检测和分析
采用靶向扩增子高通量基因测序方法(Ion Torrent PGM 测序仪,Thermo Fisher Scientific),分别检测9 种、16 种和58 种突变基因,分析范围包括基因编码区全长或突变热点区域。9 种筛查包括在AML 中具有明确诊断、预后或治疗意义的9 种基因,即I 类突变[6]:ASXL1、CEBPA、FLT3、IDH1、IDH2、KIT、NPM1、RUNX1和TP53.16 种筛查在上述9 种突变基因的基础上,增加7 种突变率较低但具有临床意义的基因,包括DNMT3A、ETV6、KRAS、NRAS、PTPN11、PHF6和TET2.58 种筛查在上述16 种突变基因的基础上,增加42 种突变率较低但在血液系统肿瘤中具有潜在临床意义的基因[7]。变异过滤、识别及注释分析流程参照河北燕达陆道培医院既往的研究报道[7]。
1.4 基因突变分类
依据WHO、美国综合癌症网络(National Comprehensive Cancer Network,NCCN)和欧洲白血病网络(European Leukemia Net,ELN)发布的AML诊疗指南、专家共识及近年来权威的研究报道[1-3,5],将基因突变根据临床意义进行分类:①诊断/鉴别诊断意义:CEBPA双突变(double-mutatedCEBPA,CEBPAdm)、NPM1、JAK2 V617F、CALR、MPL、CSF3R、CBL、SETBP1、SF3B1、SRSF2、U2AF1和ZRSR2。②预后分层意义:CEBPAdm、NPM1、KIT、RUNX1、FLT3-ITD、WT1、ASXL1和TP53。③靶向/潜在靶向治疗意义:FLT3-ITD/TKD、KIT、CSF3R、JAK1、JAK2、JAK3、IDH1、IDH2和BRAF。④化疗/非靶向治疗意义:DNMT3A、TET2、EZH2、KRAS、NRAS和PTPN11。
1.5 统计学处理
采用SPSS 22.0 软件进行统计分析,计数资料以n(%)表示,行χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 基因突变阳性率
检测9 种、16 种和58 种基因时,分别有66.2%、79.6%和86.4%的患者突变阳性(图1),23.2%、39.4%和56.3%的患者携带两种及以上基因突变。检测58 种基因的突变阳性率显著高于9 种(χ2=81.71,P<0.001)和16 种(χ2=12.25,P<0.001),差异有统计学意义。检测9 种基因时,突变率最高的三种基因为FLT3-ITD(20.9%)、CEBPA(16.5%)和KIT(14.0%)。检测16 种和58 种基因时,突变率最高的三种基因均为FLT3-ITD(20.9%)、NRAS(17.3%)和CEBPA(16.5%)。
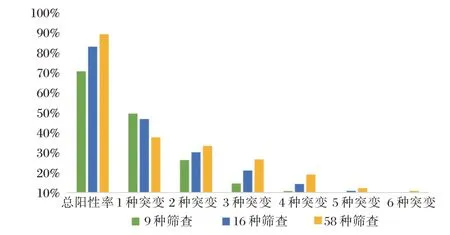
图1 9 种,16 种和58 种基因的突变阳性率Figure 1 The positive rates of 9,16,and 58 mutated genes were tested
2.2 基因突变个数
检测9 种基因时,最多检测到有患者同时携带4 种基因突变,突变阳性的患者中携带1 种和多种(≥2 种)基因突变患者的比例分别为65.0%和35.0%(图2A)。检测16 种基因时,最多检测到有患者同时携带6 种基因突变,携带1 种和多种(≥2种)基因突变患者的比例分别为50.4%和49.6%。(图2B)检测58 种基因时,最多检测到有患者同时携带6 种突变,携带1 种和多种(≥2 种)基因突变患者的比例分别为34.8%和65.2%(图2C)。检测58 种基因时,只携带1 种基因突变患者的比例显著低于检测9 种(χ2=98.46,P<0.001)和16 种基因(χ2=29.78,P<0.001),差异有统计学意义。而携带多种(≥2 种)基因突变患者的比例显著高于检测9种(χ2=98.46,P<0.001)和16 种(χ2=29.78,P<0.001)基因,尤其是携带3 种、4 种或5 种基因突变的患者,差异有统计学意义。

图2 携带不同突变个数患者的比例Figure 2 The proportion of patients with a different number of mutations
2.3 基因突变组合
检测9 种、16 种和58 种基因时,分别检出66种、186 种和329 种不同的突变组合,所揭示的肿瘤克隆异质性显著增加(图3)。单种基因突变中突变率最高的基因均为KIT(9 种:10.1%;16 种:8.3%;58 种:5.7%);最常见的2 种基因突变的组合为分别为NPM1+FLT3-ITD(9 种:2.9%)、CEBPAdm+NRAS(16 种:1.7%)和CEBPAdm+GATA2(58 种:1.4%);最常见的3 种基因突变的组合均为NPM1+IDH1/IDH2+FLT3-ITD(9 种:2.1%;16 种:1.7%;58 种:1.2%)。

图3 检测9 种,16 种和58 种突变基因患者的克隆异质性Figure 3 The clonal heterogeneity of patients in the testing of 9,16,and 58 genes
2.4 基因突变的临床获益分析
检测9 种、16 种和58 种基因,能分别为25.9%、25.9%和35.9%的患者提供辅助诊断/疾病分类相关的信息;为59.5%、60.6%和64.2%的患者提供预后分层相关的信息;为44.1%、44.7%和50.2%的患者提供靶向/潜在靶向治疗相关的信息;为0.0%、35.1%和38.1%的患者提供化疗/非靶向治疗相关的信息;为39.4%、35.5%、34.1%的患者同时提供两种临床指导信息;为12.8%、23.2%、31.3%的患者同时提供至少三种临床指导信息。
在9 种基因的基础上增加检测7 种基因,可为39.6%(97/244)的9 种基因突变阴性的患者提供诊疗辅助信息,为36.9%(176/477)的9 种基因突变阳性的患者提供更多的诊疗辅助信息。而在16 种基因的基础上增加检测42 种基因,可为33.3%(49/147)的16 种基因突变阴性的患者提供诊疗辅助信息,为39.0%(224/574)的16 种基因突变阳性的患者提供更多的诊疗辅助信息。相比于只检测9种、16 种基因指标,检测58 种基因总体上能为总计62.4%(450/721)、37.9%(273/721)的患者提供临床诊疗和预后信息。见图4。
3 讨论
肿瘤分子生物学的快速进展和测序技术的广泛应用,为血液肿瘤患者筛查更多突变基因提供了知识基础和技术条件。目前对单个或多个突变基因临床及生物学意义探讨的研究报道有很多,但对于基因突变检测的医学经济学问题缺乏相关的数据和讨论。
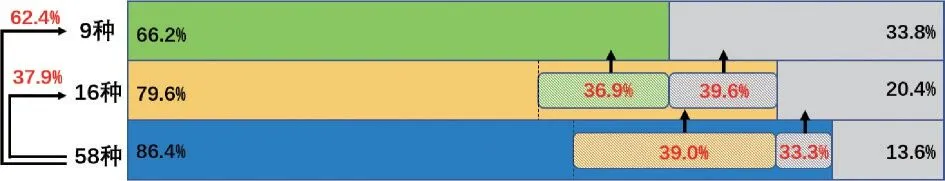
图4 检测9 种,16 种和58 种突变基因患者的临床获益情况Figure 4 The clinical benefits for patients in the testing of 9,16,and 58 genes
本研究基于高通量基因测序技术,对比分析了分别检测9 种、16 种和58 种基因时的突变和临床获益情况。结果表明,随着检测基因指标的增加,总的突变阳性率、平均患者携带突变的数目及组合均显著增加,仅检测58 种基因就能为86.4%的患者提供有效的突变信息。Papaemmanuil E 等报道,当增加到检测111 种时,96%的AML 患者突变阳性[7]。因此,进行全面的基因突变筛查,有助于更加深入和全面的评估病情。但是,在转化为临床检测时,并非所有的突变基因都具有临床意义或方便检测,检测成本也是必须要考虑的因素。因此,最终分析目标基因的选择必然是综合考量的结果。
AML 是一组高度克隆异质性的疾病,虽然目前根据遗传学危险度分层总体上分为预后良好、中等和差[3],但仍是较为粗略和笼统的划分。本研究对721例患者仅检测58 种基因,就有多达329种突变组合,平均每2 个人的突变组合都不相同。不同患者间显著的克隆异质性,可能是临床治疗及预后存在差异的重要因素。对基因突变的全面和深入分析,才能帮助做到真正意义上的精确分层和个体化治疗。
不同的基因突变可具有单方面或多方面的临床意义,如NPM1同时具有诊断分型和预后判断的意义,FLT3-ITD突变同时具有预后判断和靶向治疗的意义。近些年,随着FLT3激酶抑制剂[8]、IDH1/2抑制剂等靶向治疗研究的快速进展,为携带这些基因突变的患者提供了更多的治疗选择。其次,基因突变对特定化疗药物的反应也具有提示意义,如伴RAS突变的AML 患者常会获益于缓解后大剂量阿糖胞苷治疗[9],DNMT3A突变会通过影响核小体重塑而促使AML 患者对蒽环类药物耐药[10]。此外,不同的突变组合也具有一定的临床意义,如DNMT3A、NPM1和FLT3-ITD突变同时伴随出现提示预后很差[11-12]。全面了解突变组合的规律,未来能帮助更加深入的理解其致病机制及辅助临床诊疗。
基于检测成本的考虑,部分突变发生率较低(<5%)基因的检测价值常常受到质疑。事实上,在AML 及很多其他恶性肿瘤中,基因突变的发生呈现长尾现象[11-13],即一些少见基因的突变率较低,但种类多,累加起来的总体阳性率并不低。Maxson JE 等和本院前期的研究,发现约4%~5%的初诊AML 患者携带CSF3R突变[6,14],约5%的ALL 患者携带FLT3突变[15]。这些结果的发现得益于全面的基因突变筛查,而不是只检测少数几种基因指标。因此,全面的筛查有助于发现这些少见突变基因的致病规律,并提供潜在的治疗靶点。
就目前来说,受限于检测成本和分析能力,进行几十种或上百种突变基因的检测是最为有效的筛查方式。但随着基因组检测成本和周期的快速下降、数据分析能力的提高,在不久的将来,全外显子组测序、全基因组测序、全转录组测序将是更加全面的筛查方式,将为医学检验带来从“目标检测”到“目标分析”的革新性进展[16],更进一步提高我们对疾病的认知,从而更好地辅助临床诊疗。
