一株不产“透明圈”解磷菌的初筛及其溶磷能力的初步测定
2017-04-12叶劲松卫新来郭梦瑶江雅琪戴佳秀
叶劲松+卫新来+郭梦瑶+江雅琪+戴佳秀
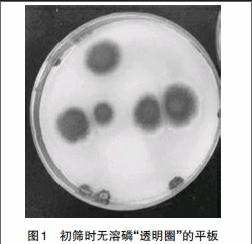
摘 要:该文以Ca3(PO4)2为唯一磷源,以固体平板上是否出现溶磷“透明圈”为指标来初筛解磷菌时,发现一株霉菌,平板上长势良好,未产生明显“透明圈”;经液体摇瓶培养,发现其具有较强的解磷能力,上清液中有效磷在第6天达到极值10.66mg/L,pH值从起始7.21下降到4.52。以“透明圈”作为解磷菌的初筛标准,可能会丢失部分解磷菌。
关键词:不产透明圈;解磷菌;初筛;溶磷能力
中图分类号 S154 文献标识码 A 文章编号 1007-7731(2016)23-0038-02
解磷菌是一类能够溶解土壤中难溶态磷素,释放出能够被植物吸收的有效磷的微生物[1]。和传统的化学磷肥相比,它具有改善土壤质量和结构,提高土壤中磷的有效利用率,节肥增产,对保持生态环境平衡具有重要意义等优点[2-4],日益受到学者们的关注[5-8]。在初筛此类微生物时,常以磷酸钙为唯一磷源的选择性培养基,以在固体平板上是否出现透明的溶磷圈为指标,来判断其是否为解磷菌[7,9]。若有明显的透明圈,则初步认为是解磷菌,否则被丢弃。本研究小组在筛选过程中,发现有的菌株在固体平板上不产溶磷透明圈,但液体培养显示具有一定溶磷能力,研究结果对于解磷菌初筛方法的改进完善具有重要意义。
1 材料与方法
1.1 材料 菌种:昆明山区土壤。初筛固体培养基和液体摇床发酵培养基:见文献[10]
1.2 方法 初筛方法:稀释涂布方法,28℃培养,3~5d。逐日观察,以平板上是否有溶磷圈出现,来初步判断其溶磷能力。液体发酵测定解磷能力方法:1mL霉菌孢子菌悬液(108个/mL),接入100mL液体培养基,另取灭活的霉菌孢子菌悬液作为对照。28℃,转速150r/min,培养10d。每48h取出,5 000r/min离心10min,取上清液测定有效磷含量和pH值。有效磷测定方法:钼锑抗比色法[11];pH测定方法:pH酸度计。
3 结果与分析
一般来说,“透明圈”是初步判断一菌株是否具有溶磷能力的标准方法[12-13]。一直以来,本研究小组都是按照这个方法进行筛选的。在初筛平板上,会经常出现不产“透明圈”的菌落,多数菌落小,但是有一株霉菌,不产透明圈,却长势很旺。对于这看似奇特的现象,决定进一步研究,故纯化后进行液体摇床继续培养。
3.1 初筛 如图1所示,该青绿色霉菌在平板上长势旺盛。既然在磷酸钙为唯一磷源的培养基上长势良好,那么该菌肯定能从外界中摄取磷源满足自身生长需要,也就是说它应该具有溶磷能力,只是没显示出“透明圈”,于是继续对其研究。
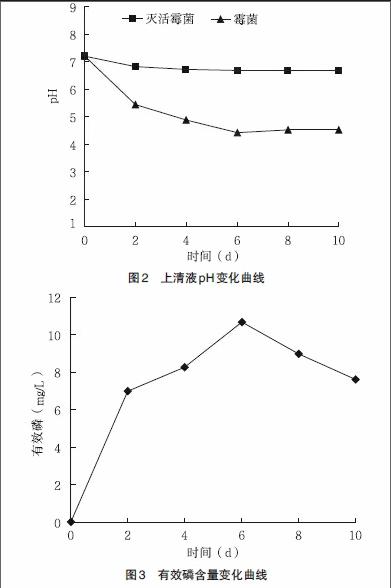
3.2 无“透明圈”解磷圈的上清液pH变化 图2显示,初始日,霉菌和灭活霉菌的液体培养基pH在7.21左右。2d后两者pH值都开始下降,但霉菌pH值下降更快速,且接种霉菌的上清液的pH值在第6天下降到最低点4.52,这说明此株霉菌确实产酸;而与此同时灭活霉菌的上清液pH值,始终在6.8左右。
3.3 无“透明圈”溶磷圈上清液中有效磷变化 从图3可以看出,上清液中有效磷一直在快速上升,并在第6天达到最高点10.66mg/L。说明此霉菌确有溶磷能力,能将难溶磷酸三钙溶解,使得溶液中有效磷含量上升。本实验只是测定了上清液中的有效磷,若加上菌体内的磷素,实际总共溶解的有效磷将更可观[14-15]。在第6天之后有效磷含量下降,可能是随着时间推移,营养物质不断被消耗,使得其溶磷能力下降或部分溶磷菌死亡。前6d,有效磷变化趋势和pH变化趋势呈现负相关,即pH下降,有效磷上升。似乎是由于产酸,导致不溶磷酸钙溶解,释放出有效磷,这也和多数学者报道的溶磷机制相同[14,16]。此株溶磷霉菌,之所以在平板上没有明显的“透明圈”,原因可能是因为该菌产酸酸性不够强,导致溶磷透明圈不明显,或是由于生长旺盛的气生菌丝将很小的溶磷圈覆盖了,也可能尚存在其他原因。
4 结论与讨论
以“透明圈”判断菌落是否为解磷菌,可能会丢失部分解磷菌。平板“透明圈”方法只是进行溶磷微生物筛选的较为初步的方法,它并不能作为评判某微生物是否具有溶磷能力的绝对标准方法,测定液体有效磷才是准确测定其溶磷能力的可靠方法,因为不产“透明圈”的溶磷菌也极可能有较强的溶磷能力。如对平板上的所有微生物都进行液体摇床有效磷测定,工作量太大,而“透明圈”法简单快捷,却不完全可靠。如何解决这一对矛盾,今后仍需要作进一步的探讨研究。
参考文献
[1]郝晶,洪坚平,谢英荷,等.石灰性土壤磷细菌的分离、筛选及解磷效果[J].山西农业科学,2005(04):56-59.
[2]王义,贺春萍,郑肖兰,等.土壤解磷微生物研究进展[J].安徽农学通报,2009,15(9):60-64.
[3]Sudana M,Susanta Wirya I G N A,Raka G N.Utilization of Phosphate Solubilizing Rhizobacterium Derived from Leguminosae Plants to Stimulating Plant Growth and Induce Systemic Resistance of Soybean (Glycine max l.Merrill)to Mosaic Diseases[J].International Journal of Current Microbiology and Applied Sciences,2016,5(9):600-610.
[4]Prabha A S.Potential Use of Azotobacter and Phosphate Solubilizing Bacteria as Biofertilizer[J].International Journal of Current Microbiology and Applied Sciences,2016,5(10):79-90.
[5]梁曉辉,龙小军,赵丰,等.解磷巨大芽孢杆菌JL-1发酵条件的初步优化[J].安徽农学通报,2014,20(24):27-29.
[6]祝凌云,马忠友,唐欣昀,等.水稻根际高效解磷菌菌株的筛选[J].安徽农学通报,2008,14(15):43-44.
[7]王义,余贤美,郑服丛.热带土壤解磷细菌PSB26的筛选鉴定及拮抗初探[J].安徽农学通报(上半月刊),2009,15(07):59-62.
[8]叶国平,梁锦锋.解磷细菌(PSB)解磷机理及应用研究进展[J].安徽农学通报,2007,13(09):53-54.
[9]黄敏,吴金水,黄巧云,等.土壤磷素微生物作用的研究进展[J].生态环境,2003,12(3):366-370.
[10]叶劲松,吴克,俞志敏.1株无机磷细菌筛选及溶磷能力的测定[J].江苏农业科学,2013,41(6):333-335.
[11]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.
[12]唐勇,陆玲,杨启银,等.解磷微生物及其应用的研究进展[J].天津农业科学,2001(2):1-5.
[13]金术超,杜春梅,平文祥,等.解磷微生物的研究进展[J].微生物学杂志,2006(2):73-78.
[14]赵小蓉,林启美,孙焱鑫,等.细菌解磷能力测定方法的研究[J].微生物学通报,2001(01):1-4.
[15]Beever R E,Burns D J W.Phosphorus Uptake,Storage and Utilization by Fungi[M].Advances in Botanical Research,H.W W,Academic Press,1981.8,127-219.
[16]马春浩.解磷微生物及其应用研究综述[J].安徽农学通报,2007,13(04):34-36.
(责编:张宏民)
