常规抗结核化疗对肺结核患者痰液菌群的影响
2021-03-17董文雅魏文静谭卫国张晨晨徐华丽余美玲江振友周琳陈亮
董文雅 魏文静 谭卫国 张晨晨 徐华丽 余美玲江振友 周琳, 陈亮
1暨南大学基础医学院(广州510632);2广东省结核病控制中心(广州510630);3深圳市慢性病防治中心(广东深圳518020)
结核病是由结核分枝杆菌(Mtb)引起的一种慢性传染病,已成为威胁人类健康的全球公共卫生问题。自2007年以来结核病一直位居单一传染性疾病死因之首,其中2019年我国结核病死亡数约为3.1 万,死亡率为2.2/10 万[1]。近年来,有研究表明结核病可能主要是由于复杂的微生物群落相互作用导致的,而不仅仅是由Mtb 引起的[2]。呼吸道菌群与人体呼吸道局部的黏膜免疫系统相互作用,保持了呼吸系统的免疫稳定与平衡,在多种呼吸道疾病的发生和发展中起重要作用[3]。相对于肺部组织和支气管肺泡灌洗液,痰液无侵入性损伤且易获取,常作为研究肺部微生态的指标之一。然而很少有研究探讨痰液菌群与结核病之间的关系,尤其是抗结核化疗对结核患者痰液菌群产生的影响。目前,只有两项研究比较了结核病患者和健康人的痰液菌群[4-5]。此外,CHEUNG 等[6]比较了结核患者和具有类似结核病咳嗽症状但Mtb 培养阴性的对照人群痰液菌群之间的差异。
WHO 推广使用的针对药物敏感型结核病的标准短程化疗方案为连续服用利福平(RIF,R)、异烟肼(INH,H)、乙胺丁醇(EMB,E)和吡嗪酰胺(PZA,Z)2 个月,然后持续服用RIF 和INH 至少4个月。在这些药物中,INH、PZA 和EMB 是针对分枝杆菌的特异性药物,而RIF 则是通过抑制RNA聚合酶来对抗多种细菌的广谱抗生素。多种抗生素长期联合治疗,可能会改变结核患者微生态的多样性和结构,进而影响治疗结果。这一推测最近分别在小鼠[7]和结核患者[8-10]肠道菌群中得到验证,研究者发现常规抗结核化疗可以导致肠道菌群高度失调。至今仅有一项对结核患者痰液菌群的研究涉及抗结核治疗,该研究比较了新发、治愈、复发和治疗失败病例以及健康人群的痰液菌群之间的差异,结果显示与健康对照组相比,新发、复发和治疗失败病例痰菌中普雷沃菌属减少,链球菌属、Gramulicatella和假单胞菌属增多,而且在治疗失败和复发病例中,假单胞菌属明显高于其他患者[11]。本研究利用16S rRNA 高通量测序,比较抗结核化疗期间不同时间点,HRZE 四联抗生素治疗引起结核患者痰液微生物群的变化以及常规抗结核治疗对结核患者痰液菌群的影响,为抗结核药物的合理使用及疗效评价提供参考。
1 资料与方法
1.1 一般资料该研究为病例对照研究,研究人群为依据肺结核诊断标准(WS288-2008),经过临床、实验室及影像学检查确诊为肺结核的患者。选取2017年6-12月[8]深圳市慢性病防治中心初诊为结核病且未进行治疗的患者为T0 组(54 例),仅经过一线药物联合治疗2 个月的初诊结核患者为T2 组(32 例),经过一线药物联合治疗6 个月治愈的初诊结核患者为T6组(17例)。三组人群在年龄、性别比例上差异均无统计学意义(P>0.05),具有可比性,见表1。所有受试者均符合以下纳入标准:(1)深圳本地人口,作息、饮食规律,不酗酒嗜烟;(2)无合并其他如心、肝、肺、肾功能不全等重大疾病;(3)无糖尿病、恶性肿瘤、HIV 等疾病;(4)入组前2 个月未使用抗生素、微生态制剂。本研究已通过深圳市慢性病防治中心医学伦理专家委员会认可,所有受试者均已签署知情同意书。
表1 不同组别受试者的基本情况Tab.1 Characteristics of the participants in different groups±s
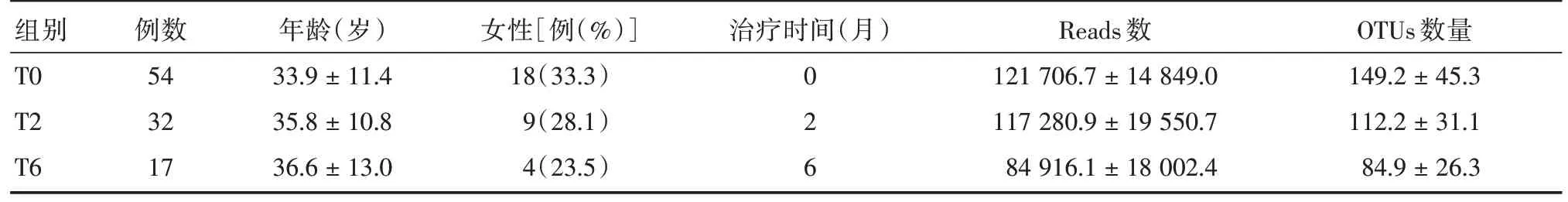
表1 不同组别受试者的基本情况Tab.1 Characteristics of the participants in different groups±s
) 女性[例(%)] 治疗时间(月)Reads 数OTUs 数量组别T0 T2 T6例数54 32 17年龄(岁33.9±11.4 35.8±10.8 36.6±13.0 18(33.3)9(28.1)4(23.5)0 2 6 121 706.7±14 849.0 117 280.9±19 550.7 84 916.1±18 002.4 149.2±45.3 112.2±31.1 84.9±26.3
1.2 疗效判定标准(1)影像学评价指标见2005年中华医学会编著的《临床诊疗指南:结核病分册》;(2)细菌学检测结果评价参见《耐药结核病化学治疗指南》制定的标准。其中治愈指涂阳培阳肺结核患者完成规定的疗程,连续3 次涂片结果阴性,并且至少一次痰培养阴转,在治疗末痰涂片阴性。
1.3 痰液采集、保存及微生物DNA提取收取晨痰后,挑取有效痰组织冷藏于-80 ℃冰箱。使用粪便DNA 微型试剂盒(MP Biomedicals)提取来自痰液样品的DNA。
1.4 16S rRNA 深度测序用正向引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和反向引物907R(5′-CCGTCAATTCMTTTRAGTTT-3′)对V4-V5 可变区进行PCR 扩增,将样品特异性的7-bp barcodes纳入引物中进行多重测序。扩增程序为:98 ℃预变性2 min,25 个循环(98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸5 min。使用Agencourt AMPure Beads 试剂盒(Beckman Coulter,Indianapolis,IN)对PCR 扩增子进行纯化后,用PicoGreen dsDNA 检测试剂盒(Invitrogen,Carlsbad,CA,USA)对其进行定量分析。取等量纯化后产物送派森诺测序公司进行Illlumina MiSeq 平台高通量测序。
1.5 DNA 测序和数据处理使用微生物生态学软件(QIIME2 V.2019.10)对细菌16S rRNA 扩增子数据进行生物信息学分析。使用FastQC v.0.11.2和Trimmomatic v.0.32 对序列进行质量控制和过滤,然后使用QIIME2 内带的DADA2 软件对序列reads 进行过滤,构建特征表。采用q2-feature-classifier(QIIME2 V.2019.10)对每个16S rRNA 基因序列进行分类。
1.6 生物信息学分析和统计学方法本文主要使用QIIME2、Python(v3.7)和R 包(v3.6.3)进行序列数据分析。采用q2-diversity(QIIME2 V.2019.10)进行Alpha 和Beta 多样性分析。Alpha 多样性反映的是单个样品物种丰度及物种多样性,本文采取多种衡量指标:Chao1、Shannon、Simpson、Pielou_e 指数和Observed OTUs。Beta 多样性比较不同样品在物种多样性方面的相似程度,反映肠道菌群的整体差异程度,使用Bray-Curtis 距离指标进行Beta 多样性分析,并通过主成分分析(PCoA)可视化来研究样本间微生物群落的结构变化。组间两两比较的Bray-Curtis 距离差异采用非参数置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)。本研究先用Kruskal-WallisH检验比较各分类水平各物种的相对丰度以描述菌群组成结构的差异,进一步通过线性判别分析效应量(LEfSe)找出三组在各分类水平有显著性差异的菌,用线性判别分析(LDA)评估各组间各分类水平差异菌的效应大小。本研究设定显著差异的LDA值为2,以寻找两组间具有显著性差异的物种,最终取相对丰度>1%的菌种用柱形图和热图进行可视化展示。本文采用GraphPad Prism7 软件进行制图,采用SPSS 23.0 进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 测序数据本研究对收集痰液样本的16S rRNA V4-V5 可变区进行深度测序以评估HRZE 四联抗结核治疗对肺部微生态的影响。通过对103个样品测序,共获得11 768 724 对序列,经双端序列拼接、过滤后共产生9 803 728条优化序列,每个样品至少产生58 874条优化序列,平均产生95 181条优化序列,见表1。所有样品文库的覆盖率达99%以上,说明每个样品的测序量均已达到饱和。
2.2 α多样性分析本研究利用α多样性分析法对不同组别间的菌群丰富度和均衡度进行分析,基于OUT种类和丰度计算Shannon、Chao1、Simpson、Pielou_e 和Observed_OTUs 指数。与T0 组结核患者相比,经过常规抗结核化疗的患者(T2和T6组),其Shannon、Chao1 和Observed_OTUs指数均显著下降(均P<0.05),表明结核患者经化疗后体内微生物的丰富度明显降低。而且随着治疗时间的延长,物种丰富度降低也越明显,本文的分析结果显示,与T2组相比,T6组的Shannon、Chao1和Observed_OTUs指数均显著下降(图1)。而Pielou_e 指数显示各组间的菌群均匀度差异无统计学意义,这说明常规抗结核化疗可以影响痰液菌群的丰富度,但是对菌群均匀度影响不大。
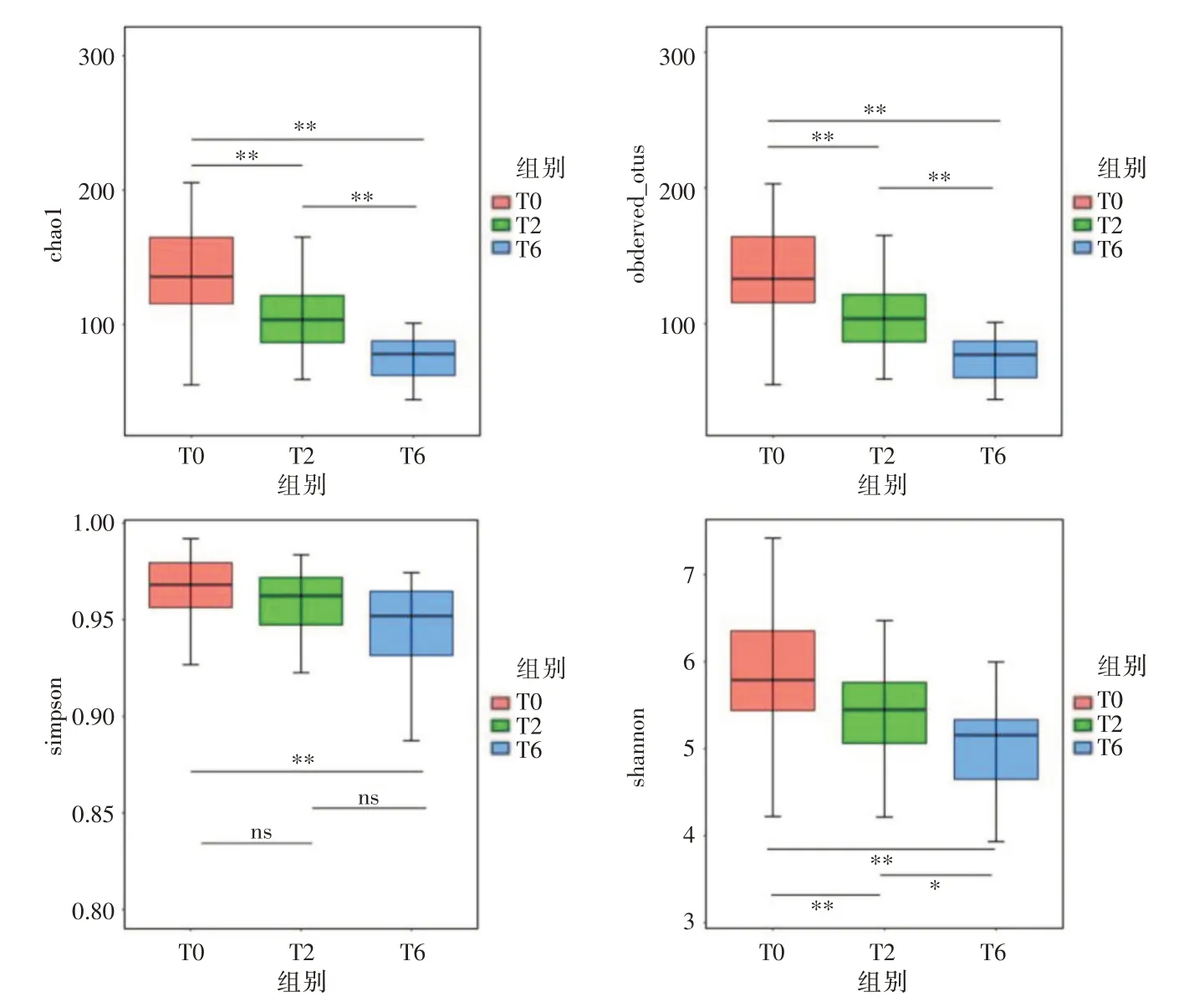
图1 组间痰液菌群α多样性分析Fig.1 α-diversity analysis of sputum flora performed in T0,T2 and T6 groups
2.3 菌群结构分析基于Bray-Curtis 距离指标,本研究使用主成分分析法(PCoA)进一步分析抗结核化疗对各组痰液菌群结构多样性的影响。如图2所示,PCoA分析发现T0组与T2组、T6组相比较,存在明显的菌群结构差异(P=0.012)。
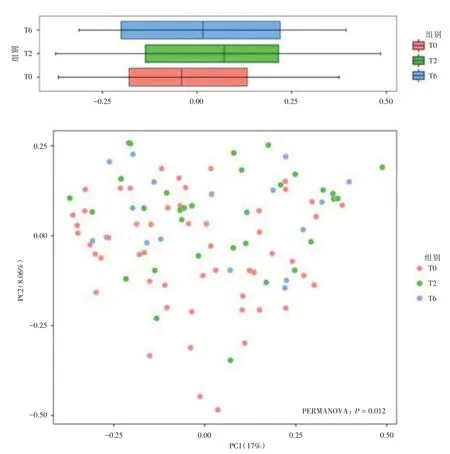
图2 组间痰液菌群PCoA 分析Fig.2 PCoA analysis of sputum flora among groups
随后本研究比较了各组从门到属水平上菌群的构成差异(图3)。在门水平上,T0、T2 和T6 组中占主导地位的菌群主要包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)和放线菌门(Actinobacteria);其中T2 组厚壁菌门(Firmicutes)的相对丰度高于T0 组,放线菌门(Actinobacteria)较T0和T6 组也相对增多。在纲水平上占主导地位的菌群包括拟杆菌纲(Bacteroidia)、β-变形菌纲(Betaproteobacteria)、梭菌纲(Clostridia)、芽孢杆菌纲(Bacilli)和γ-变形菌纲(Gammaproteobacteria)。其中T0 组γ-变性菌纲的相对丰度高于T2 和T6 组,而梭菌纲则显著减少(P<0.05)。在目、科、属水平上T0 组的优势物种与T2 组、T6 组均有不同。
2.4 差异菌群分析为进一步确定哪些菌群受抗结核化疗显著影响,本研究对样本中平均相对丰度大于1%的物种进行Kruskal-WallisH检验分析,在各水平上寻找变化差异较大的菌种。如图4所示,T2 和T6 组中的产黑色素普雷沃菌(prevotella melaninogenica)、梭菌目(Clostridiales,属于梭菌纲)、韦荣氏球菌科(Veillonellaceae,属于梭菌目)、韦荣氏球菌属(Veillonella,属于韦荣氏球菌科)及其亚种殊异韦荣菌(veillonella dispar)较T0 组均显著增加,而伯克氏菌目(Burkholderiales)、紫单胞菌科(Porphyromonadaceae)、黄杆菌目(Flavobacteriales)的相对丰度连续下降。毛螺菌科(Lachnospiraceae)在T6 组较T0、T2 组显著减少。
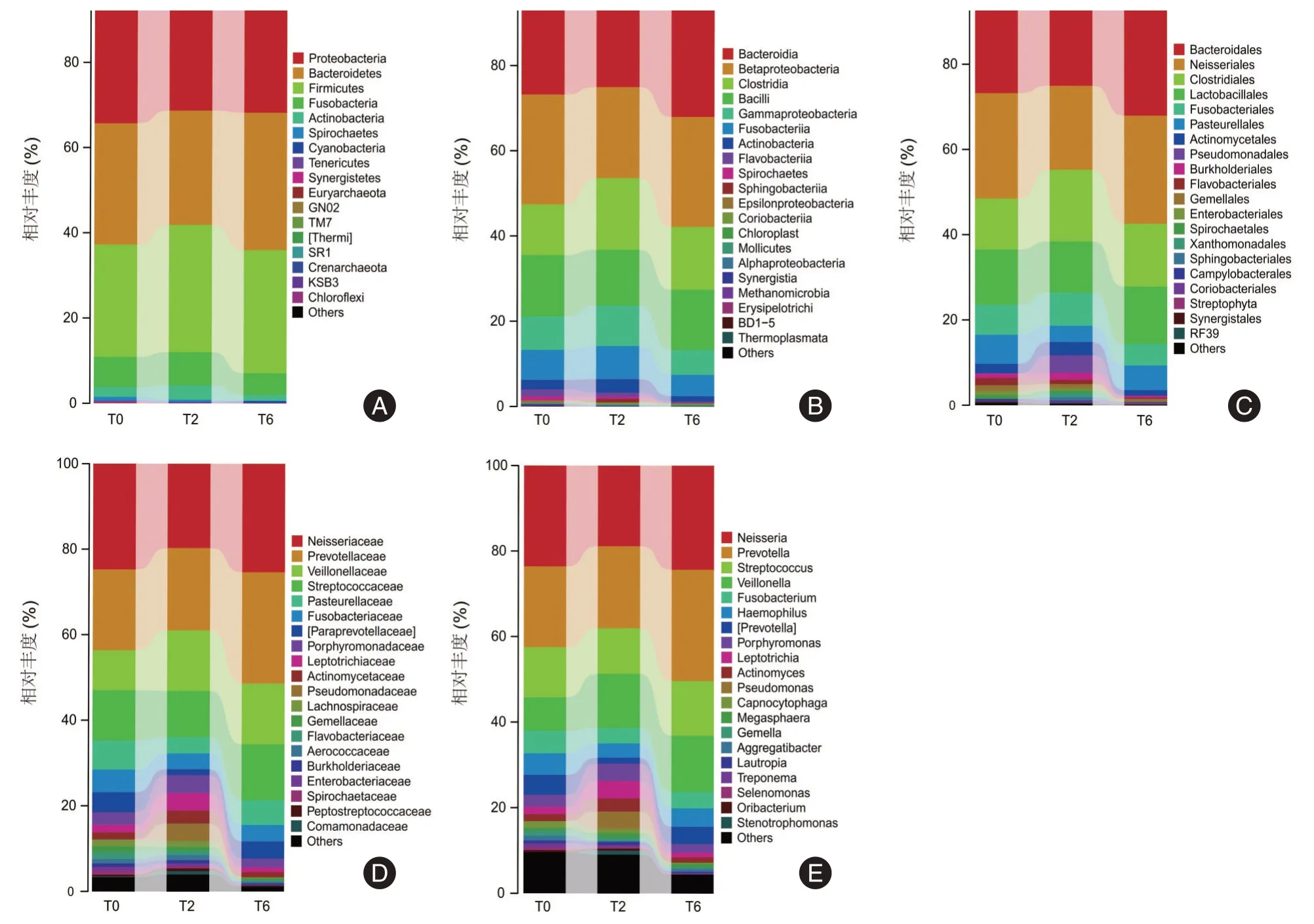
图3 组间不同分类学水平的菌群构成Fig.3 The composition of different taxonomic levels of sputum microbiota among groups
2.5 PICRUSt 功能预测分析PICRUSt 分析结果显示相较于初诊未治患者T0 组,抗结核治疗后的患者痰液微生物群中某些功能途径发生变化,其中最显著的变化是结核患者菌群中双组份信号转导系统、脂肪酸代谢、丁酸代谢、丙酮酸代谢、细菌迁移和趋药性显著降低(图5,均P<0.05)。这些结果进一步证实,抗结核治疗广泛扰乱了痰液菌群的分类和功能结构,可能导致代谢紊乱。
3 讨论
本文通过16S rRNA 高通量测序研究了常规HRZE 抗结核化疗对结核患者痰液微生物群的影响。抗生素治疗可影响肺部和肠道菌群的类型和多样性,导致菌群紊乱,并常常伴有副作用[12-13]。虽然大多数抗结核药物(HZE)属于窄谱,但了解它们对微生物群的影响也有重要意义。本研究结果显示,HRZE 抗结核化疗可影响结核患者痰液菌群整体的多样性和菌群结构。
最值得关注的是T6 组中韦荣氏球菌属及其亚种殊异韦荣菌相对丰度经抗结核治疗后明显增加。另外,产黑色素普雷沃菌在治疗后也显著增加。HRZE 引起的痰液菌群紊乱的后果目前还不清楚,但其中一些显著变化的菌种与结核病的免疫有关。韦荣氏球菌属是存在于口腔、上呼吸道、小肠和阴道的正常厌氧菌群的一部分,通常被认为是低毒力的[14]。一项对老年肺炎患者上呼吸道菌群的研究表明较高丰度的产黑色素普雷沃菌、韦荣氏球菌属和纤毛菌属与健康呈正相关(P<0.05)[15]。NOJOOMI 等[16]指出韦荣氏球菌属可以消化乳酸产生丙酸、产生NO、具有抗炎作用,而且它还能产生生物素、钴胺、叶酸、泛酸、吡哆醇和核黄素,属于益生菌。产黑色素普雷沃菌能够减少树突状细胞(DC)中由流感嗜血杆菌诱导产生的IL-12p70,而对IL-23 和IL-10 的产生没有影响,这表明产黑色素普雷沃菌能够调节对特定病原细菌的免疫反应[17]。另有一项研究发现肠道菌群中富含毛螺菌科和梭菌科的恒河猴更易感染结核菌[18]。本研究结果显示经过6个月抗结核治疗毛螺菌科的相对丰度显著减少。NAMASIVAYAM 等[7]发现感染结核菌的小鼠在HRZE 抗结核治疗过程中,其肠道菌群中梭菌目的相对丰度下降,而紫单胞菌科的相对丰度在治疗后显著上升,而在结核患者痰液菌群中得到相反的结果。综上所述,可以推测HRZE 引起的肺部菌群紊乱可能会显著影响宿主的免疫反应,从而影响抗结核化疗的疗效。
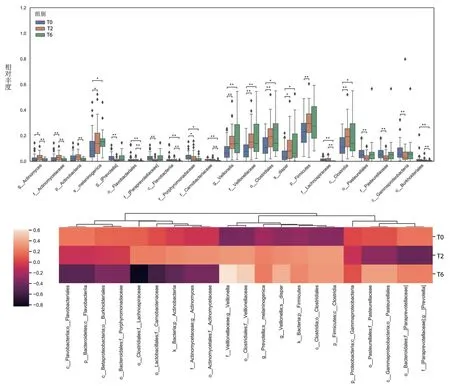
图4 组间各分类学水平上的差异菌群Fig.4 The different microbiota at each taxonomic level from T0,T2 and T6 subjects

图5 PICRUSt 功能预测分析Fig.5 Function prediction analysis by PICRUSt
宿主与其菌群之间的交流,部分是通过代谢产物的分泌进行的[19],代谢产物对宿主的生理功能有着重要的影响。免疫系统可以通过不断的扫描肺部微环境,获得有关菌群代谢状态和定植状态的信息[20]。最近的研究发现,微生物的代谢物在调节免疫系统中起着重要的作用。肠道菌群可通过改变丁酸和丙酸的产生,导致结核病患者免疫功能受损[9,21]。NEGATU 等[22]发现肠道微生物的代谢物吲哚丙酸可作用于色氨酸,从而干扰Mtb的生物合成。本研究通过PICRUSt 分析,发现HRZE 抗结核化疗后的结核患者痰液微生物群丁酸代谢和丙酮酸代谢显著降低。
综上所述,HRZE 抗结核化疗可引起结核病患者的痰液微生物群紊乱。某些菌种经治疗后被消耗或富集,功能分析表明功能通路的组成也发生了变化,为评估抗结核治疗效果提供了潜在的生物标志物。这些发现在某种程度上,提供了直接证据验证抗结核化疗引起结核患者肺部菌群失调的假说,并且有利于了解结核病和肺部菌群之间的关系。然而,这一初步的临床研究结果存在一定的局限性,由于本研究纳入的研究对象具有相似的背景和特点,且每一组的研究对象数量较少,因此本研究还需要进一步完善并扩大样本量,以更大规模的结核患者队列研究进行验证。
