NEK2在肝细胞癌中的表达及对增殖转移能力的影响
2021-03-17陶雪梅阮浩宇左乔竹庞智周春立
陶雪梅 阮浩宇 左乔竹 庞智 周春立
1南京医科大学附属苏州医院消化内科(江苏苏州215000);2江苏省人民医院检验科(南京210029);3上海交通大学医学院附属仁济医院上海市肿瘤研究所(上海200120)
肝癌是人类最常见的第六位恶性肿瘤,根据最新全球癌症统计,2018年新增病例841 000 例,死亡病例782 000 例,是一种严重威胁人类生命健康的疾病[1]。由于肝癌复发转移率高,预后仍较差,深入研究肝癌发病的分子机制,一直是肝癌研究领域的重点和难点,也是本文拟探讨的方向。NEK2 为丝/苏氨酸激酶NIMA 相关激酶2,是细胞周期有丝分裂关键原件-中心体相关蛋白激酶,可诱导有丝分裂中心体过早分裂,导致染色体不稳定和多倍体的产生,进而导致肿瘤增殖、转移恶化以及耐药产生等不良后果[2]。研究报道NEK2 在多种恶性肿瘤中异常表达,包括乳腺癌、结直肠癌、宫颈癌和胆囊癌等,并与临床不良预后相关[3]。近年关于NEK2 在肝癌中的作用研究也越来越多[4]。LI 等[5]通过对63 对肝癌组织及其配对癌旁组织进行免疫组化,分析显示NEK2 在肝癌中的表达显著高于其癌旁组织,与肝癌生存预后密切相关,是潜在的肿瘤治疗靶目标。然而FU 等[6]的一项研究表明在NEK2 高表达的肝癌患者中有更好的生存率。因此,关于NEK2 在肝癌中的表达及与肝癌生存预后的关系存在争议,还需要继续研究。本文进一步探讨了NEK2 在肝癌组织和肝癌细胞系中的表达和功能,为肝癌的诊断和判定预后提供理论依据。
1 材料与方法
1.1 组织样本收集第二军医大学附属东方肝胆外科医院2001-2012年接受外科手术切除的患者的肝癌组织及其配对的癌旁组织作为研究材料。临床病例资料及随访资料完全可靠。所有标本的获取均取得医院伦理委员会的同意,并取得了患者本人签署的知情同意书。
1.2 细胞系和质粒(1)人肝癌细胞系SK-Hep1、Hep3B、HepG2、SMMC7721、人胎盘细胞系PLC 和正常肝细胞系L02 购于ATCC 和中国科学院细胞库。(2)MHCC97L、MHCC97H 和HCCLM3 由复旦大学中山医院提供。(3)Huh7 购于日本理化研究所细胞库(RIKEN BRC)。(4)慢病毒过表达载体pCDF1、对照载体Vector 以及包装质粒psPAX2、pMDG2 来自于Addgene。慢病毒干扰载体pGreen-PuroTMshRNA、对照载体pGreenPuroTM-shControl 以及干扰包装质粒pVSV-G、pGAG 和pREV 购于美国System Biosciences 公司。
1.3 方法
1.3.1 qRT-PCR采用TRIzol(美国Invitrogen Life Technologies 公司)提取总RNA 后,反转录试剂盒(日本TAKARA 公司)反转录获得cDNA,引物序列由上海生工科技有限公司合成,NEK2 上游引物:5′-GAAGTTTCGCAGACCTGACAT-3′,下游引物:5′-GTATGCACCATTCAACTCCTCG-3′;上样完成后,用封板膜封好,简单离心,放入ABI 7500 PCR 仪器中反应。两步法PCR 程序扩增:第一步:95 ℃预变性30 s,95 ℃5 s,60 ℃34 s,40 cycles;融解曲线反应条件:95 ℃15 s,60 ℃1 min,95 ℃15 s。以PCR循环数对△Rn 做扩增曲线确定Ct 值。以β-actin表达量作为内参。β-actin 上游引物:5′-GTTGCGTTACACCCTTTCTTG-3′,下游引物:5′-GCTGTCACCTTCACCGTTCC-3′。采用2-△△Ct的方法,计算目的基因的相对表达量。
1.3.2 Western blot收集细胞加入裂解液及蛋白酶抑制剂,提取总蛋白,用BCA 法测定蛋白质浓度(BCA试剂盒购于上海碧云天公司)。取50 μg 蛋白行常规蛋白质印迹分析,最后用ECL 化学发光法显影(显影液购于美国Millipore 公司)。NEK2抗体(稀释比例为1∶1 000)及辣根过氧化物酶标记二抗(1∶5 000)购自美国CST 公司,β-actin 抗体(1∶10 000)购自美国Sigma 公司。
1.3.3 构建NEK2 稳转过表达和干扰质粒将人肝癌细胞系SK-Hep1、HCCLM3 以及SMMC7721 接种于含10% FBS 的DMEM 培养液,37 ℃5% CO2培养箱中培养,按照1∶3 传代后在6 孔细胞培养板中培养SK-Hep1 细胞长至50%,换无血清培养液,按3×106TU/mL浓度分别加入NEK2过表达慢病毒质粒、Vector以及增敏剂,构建过表达细胞系。同理在HCCLM3 和SMMC7721 细 胞 系中加入shNEK2、shControl 以及增敏剂后,构建干扰细胞系。约8 h换液,待其生长至90%后逐步扩增,通过qRT-PCR和Western blot 检测NEK2 过表达和干扰效率。
1.3.4 细胞增殖活性检测按照CCK-8 试剂盒(美国BBI Life Sciences 公司)说明进行操作。
1.3.5 细胞迁移和侵袭实验细胞迁移实验:(1)取对数期生长的肝癌细胞,用无血清的DMEM 培养基重悬计数。小室上室各加入5 × 104细胞,体积均为400 μL,小室下室加800 μL 含10%FBS 的DMEM 培养基。每组均设置3 个复孔。(2)根据不同细胞的迁移特性,在合适的时间(如18、24、48 h)取出小室,吸去培养液,放入含0.1%结晶紫中染色15 min。(3)用PBS 漂洗染色小室,棉签小心擦除上室残余细胞,室温晾干,显微镜下拍照。统计迁移到膜外侧的细胞个数,200×显微镜下随机计数6 个视野。 细胞侵袭实验:(1)将Matrigel基质胶在4 ℃解冻,用预冷的DMEM 按1∶8 稀释,取50 μL 稀释的Matrigel 加入小室上室,均匀覆盖,37 ℃孵育3 h,待其充分聚合后进行侵袭实验。(2)余步骤同上述细胞迁移试验,该实验重复3次。
1.4 统计学方法运用GraphPad Prism 5.0 统计软件进行实验数据的整理和分析。成对的计量资料间的差异比较采用配对t检验配对,两组独立计量资料间的比较采用独立样本t检验。采用Keplan-Meier 法作生存分析。P<0.05 为差异有统计学意义。
2 结果
2.1 全基因组表达谱芯片分析NEK2表达水平本实验室利用AffymetrixU133 plus 2.0 全基因组表达谱芯片(GEO Submission:GSE84402)数据,分析14对肝癌及癌旁组织的基因表达情况。通过将NEK2在肝癌组织中信号值与癌旁组织中的信号值相比,计算Log2(T/N)(T:Tumor;N:Nontumor)值,其中14 对的对数值仅有1 例<0,提示NEK2 在肝癌组织中高表达(图1)。
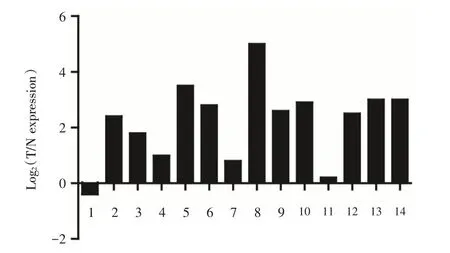
图1 全基因组表达谱芯片分析肝癌与癌旁组织中NEK2的表达情况Fig.1 Expression of NEK2 in both HCC and corresponding nontumorous liver tissues was analyzed by transcriptomic microarray
2.2 Oncomine 数据库分析NEK2 表达情况Oncomine 数据库分析显示在Roessler Liver 2 数据中,与正常肝组织(n= 220)比较,NEK2 在肝癌(n=225)中显著高表达(P<0.001);在TCGA 数据中,与正常肝组织(n= 115 例)比较,NEK2 在肝癌(n=97例)中显著高表达(P<0.001,图2)。以上分析数据说明,NEK2 在肝癌组织中高表达。
2.3 NEK2 在肝癌组织样本中的表达情况及临床意义在90 对肝癌和癌旁组织的临床样本中,采用qRT-PCR检测发现NEK2在肝癌组织中的mRNA表达水平显著高于其癌旁组织(P<0.000 1),见图3A、B。且在肝癌组织中,高表达NEK2 的病例数高达88.9%(80/90),低表达NEK2 的病例数仅占4.4%(4/90),见图3C。随机选取8 对人肝癌与癌旁的蛋白组织样品,采用Western blot 检测发现NEK2 的蛋白表达水平在肝癌组织也明显高于癌旁组织,NEK2 在肝癌组织中上调的病例数高达75%(6/8),见图3D。综上所述,NEK2 在肝癌组织中无论在mRNA 水平还是在蛋白水平上均呈现相对高表达,提示NEK2 有可能在肝癌的发生中发挥一定的作用。
通过GEPIA 数据库(http://gepia.cancer-pku.cn)获取364 例肝癌患者NEK2 的RNASeq 数据,定义cut-off 值为50%,采用Kaplan-Meier 分析NEK2 与临床预后的关系。结果显示高表达NEK2 的肝癌患者OS(log-rank test,P= 0.000 28)与DFS(logrank test,P= 0.000 64)较相对低表达NEK2 的患者差(图4)。表明NEK2 的高表达与肝癌不良预后相关。
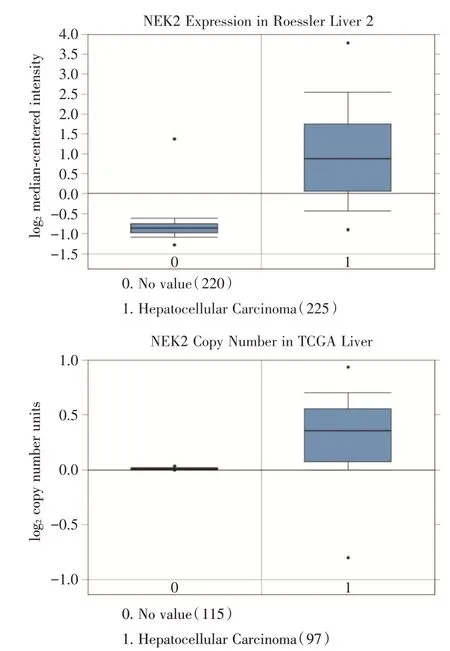
图2 Oncomine 数据分析发现NEK2 在肝癌组织中高表达Fig.2 Expression of NEK2 was increased in HCC as revealed by Oncomine data-mining analysis
2.4 NEK2 在人肝癌细胞系中的表达及其对肝癌细胞的影响采用qRT-PCR检测NEK2在人肝癌细胞系Hep3B、HepG2、SMMC7721、Huh7、SK-Hep1、MHCC97H、HCCLM3 及人正常肝细胞系L02、胎盘细胞系PLC 中mRNA 表达水平,β-actin 作为内参。结果显示,NEK2 在Huh7、SMMC7721、MHCC97H、HCCLM3 中的表达水平高于其在Hep3B、HepG2 及SK-Hep1 中的表达(图5A)。利用细胞免疫荧光染色,结果显示NEK2 在HCCLM3 和SMMC7721 中表达较高,在SK-Hep1和HepG2中表达较低,且NEK2主要在胞浆内表达(图5B),与其在细胞系中的表达基本一致。
在体外利用肝癌细胞系SK-Hep1,构建NEK2过表达稳转细胞株。采用qRT-PCR 检测NEK2 过表达效率(图5C)。为了探讨NEK2 对肝癌细胞增殖功能的影响,采用CCK-8 方法进行检测,结果发现过表达NEK2 组较对照组能够促进肝癌细胞的增殖(图5D)。进一步采用transwell 小室法检测NEK2 对肝癌细胞迁移、侵袭的影响。结果显示,过表达NEK2 后,其迁移及侵袭能力较其对照组明显增强(图5E)。
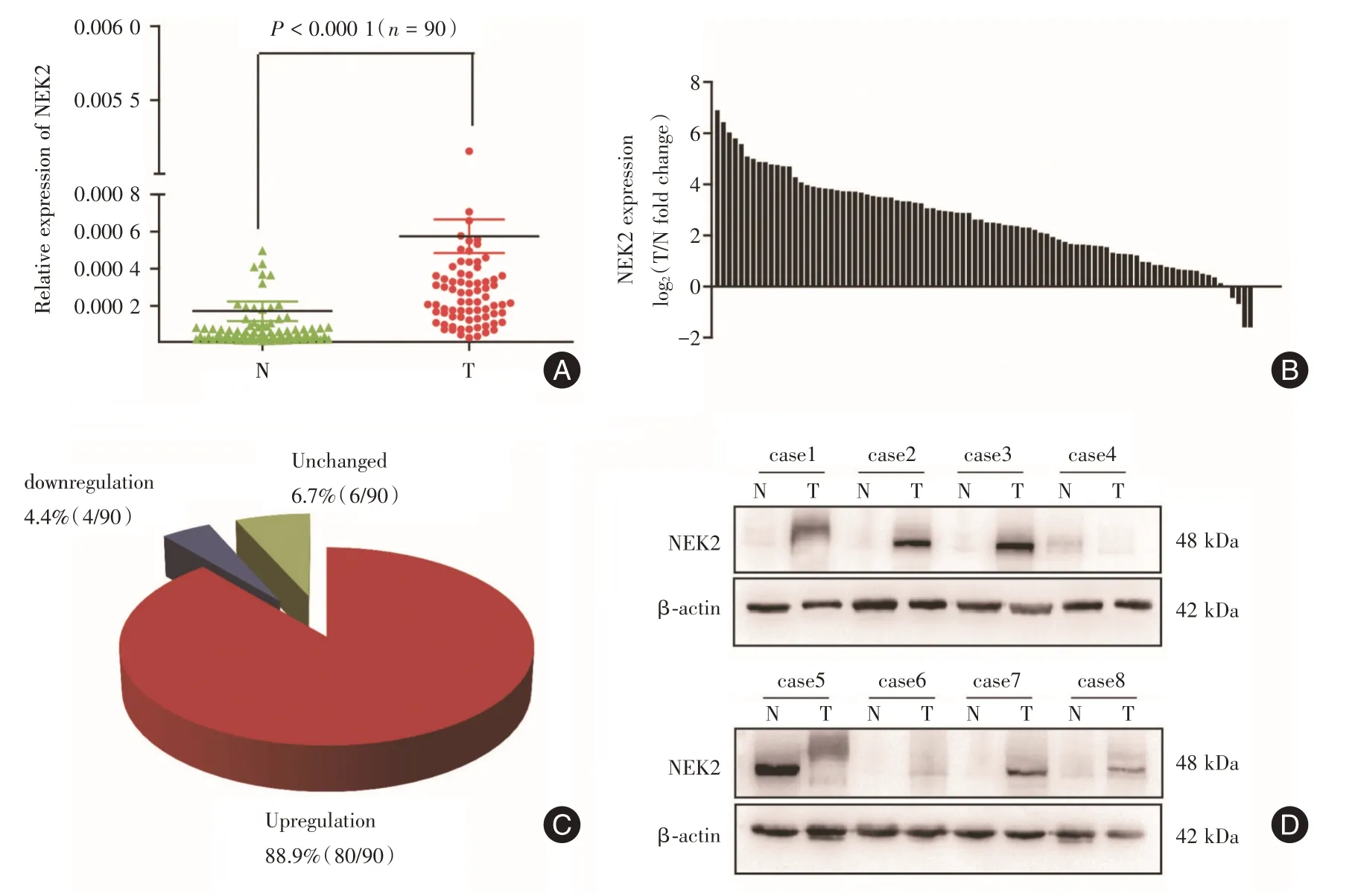
图3 NEK2 在肝癌组织样本中表达增加Fig.3 Expression of NEK2 is upregμLated in human HCC tissues
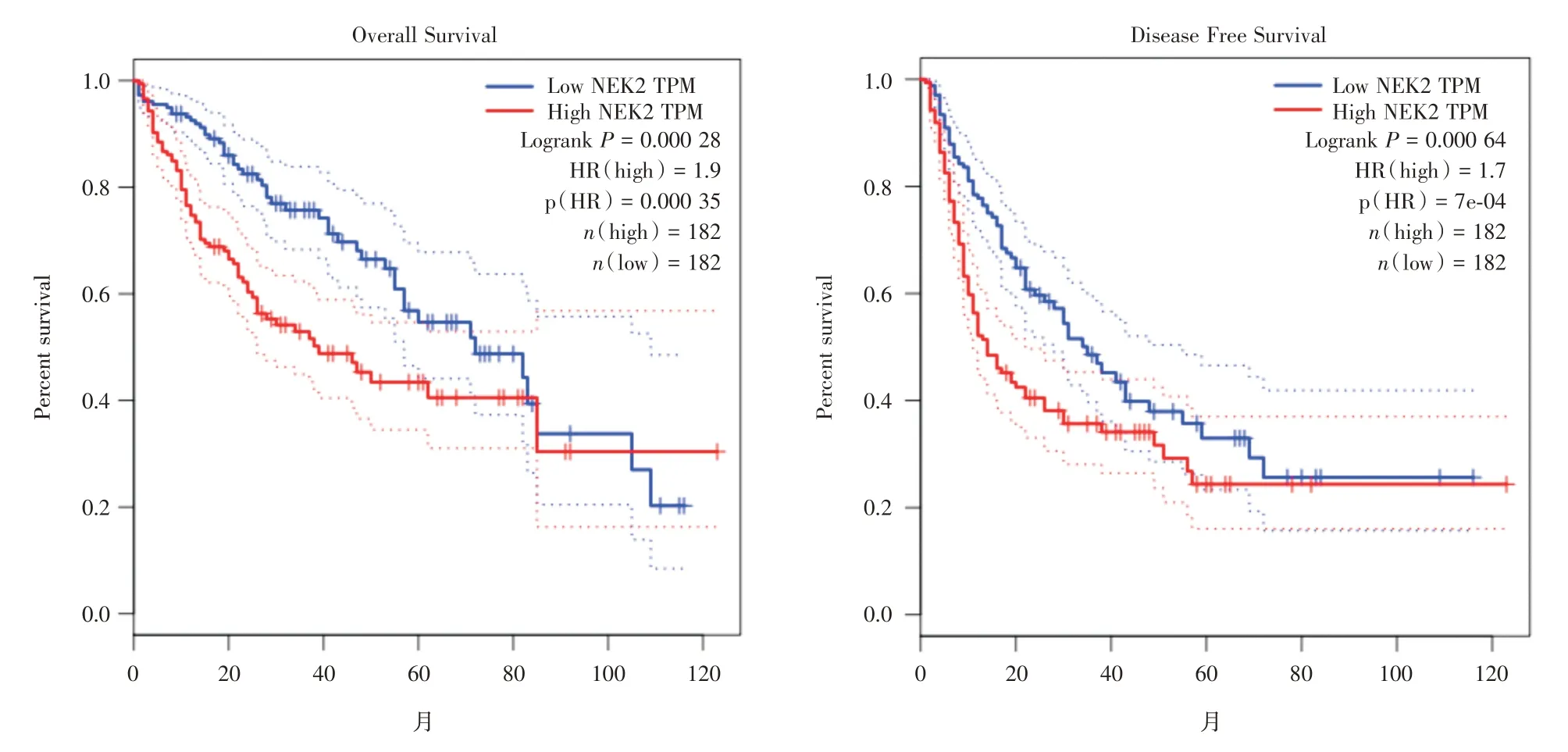
图4 GEPIA 数据库分析NEK2 的表达水平与肝癌患者的预后相关性Fig.4 Kaplan-Meier curves for NEK2 expression in HCC with GEPIA dataset
同上,在NEK2 本底表达较高的SMMC7721和HCCLM3 肝癌细胞系中,构建干扰NEK2 的稳转细胞株。采用qRT-PCR 检测NEK2 干扰效率(图6A、B)。同样采用CCK-8 法发现干扰掉NEK2后较对照组能够明显抑制肝癌细胞的增殖(图6C、D)。采用transwell 小室法检测发现在NEK2 干扰组中,迁移及侵袭能力较其对照组明显减弱(图6E、F)。
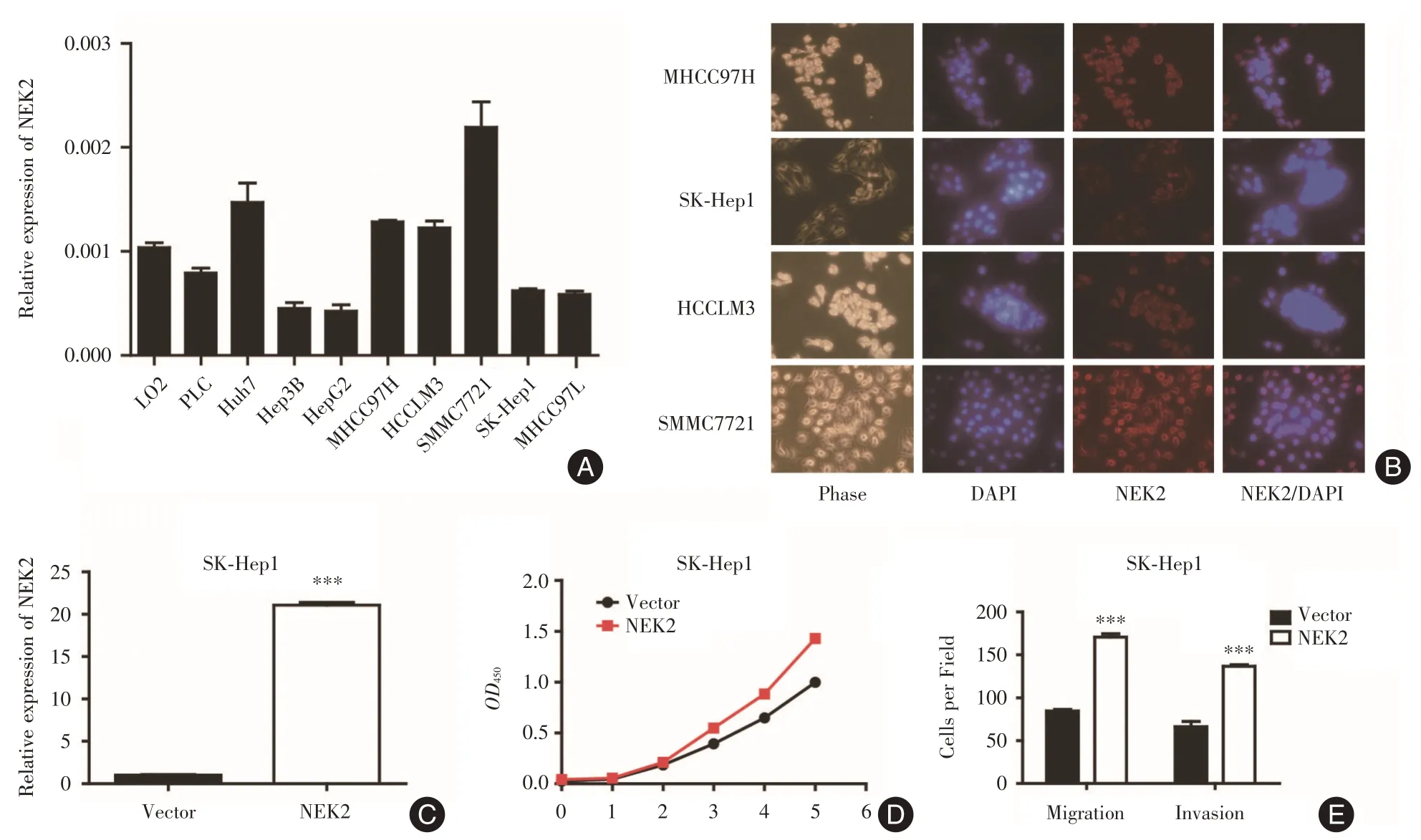
图5 NEK2 高表达促进肝癌细胞增殖和转移能力Fig.5 Overexpression of NEK2 increases proliferation and metastatic potentials of HCC cells
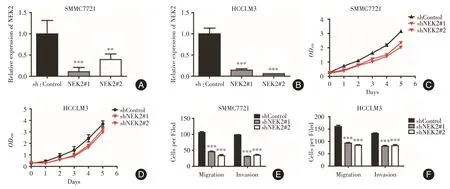
图6 抑制NEK2 的表达抑制肝癌细胞增殖和转移能力Fig.6 Knockdown of NEK2 decreases proliferation and metastatic potentials of HCC cells.
2.5 NEK2 的表达与EMT 相关分子的关系通过GEPIA 数据库在肝癌组织化学标本中分析NEK2与EMT 相关分子的关系。选取间叶细胞来源的分子标记物Twist1、SNAIL、ZEB1、FN1、CD44、Vim 及TGFB1,上皮细胞来源的分子标记物CDH1、TJP1、KRT19 以及JUP 进行分析。结果显示NEK2 与Twist1、ZEB1、Vim、FN1、TJP1、TGFB1、CDH1、CD44及JUP 呈正相关,差异有统计学意义(P<0.05);而与SNAIL,KRT19 无相关性。提示随着NEK2 表达量增加,EMT 相关分子的表达也增加,NEK2 可能通过调控EMT 相关分子,促进肿瘤的进展和转移(图7)。
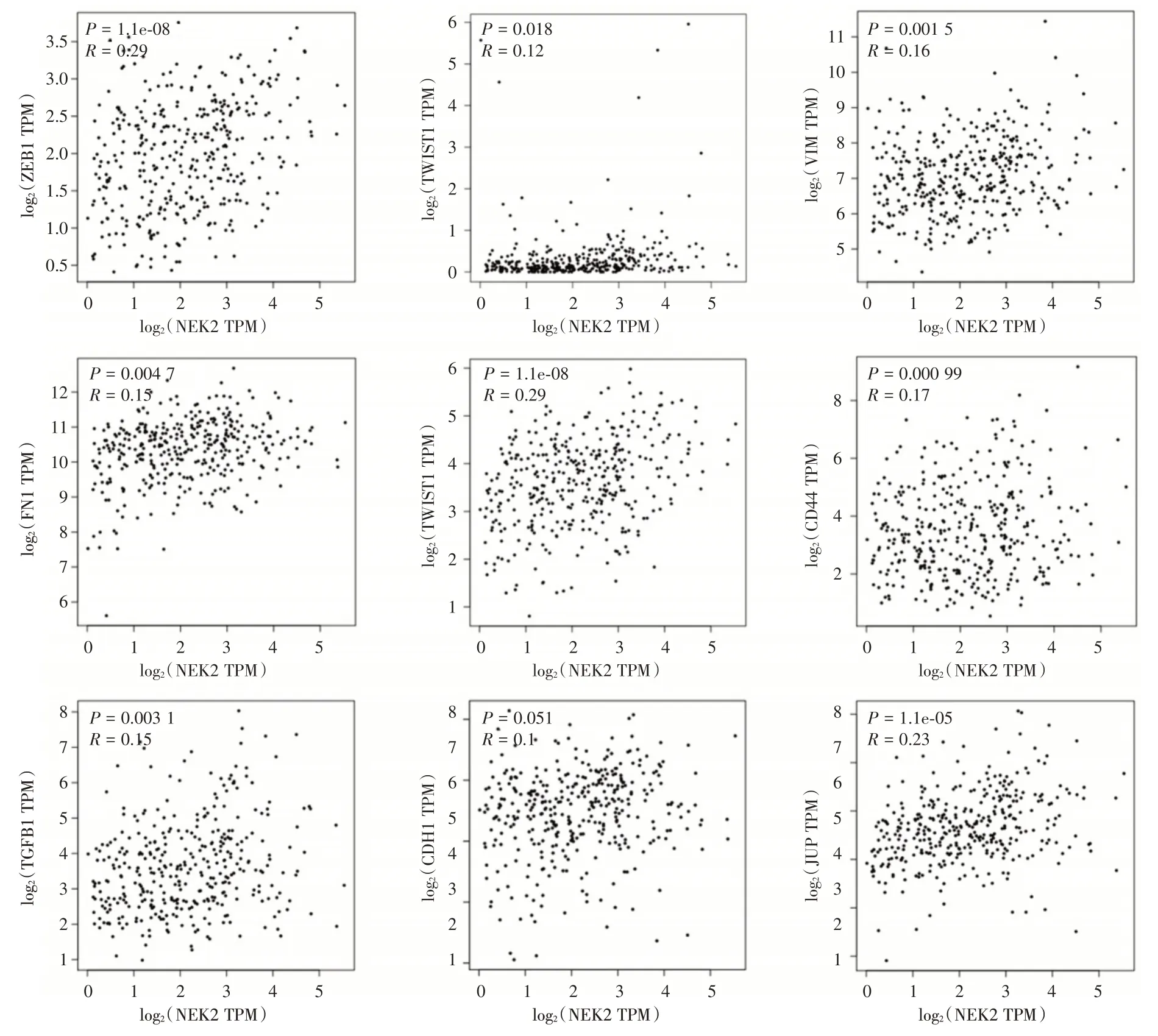
图7 GEPIA 数据库分析在肝癌中NEK2 的表达水平与EMT 相关性Fig.7 Correlation of NEK2 with EMT markers in HCC by GEPIA data-mining analysis
3 讨论
NEK2 存在于人类染色体lq32.2_q41 位区域,编码蛋白NIMA 相关激酶2,主要作用于有丝分裂过程,调节中心体产生非整倍性,导致肿瘤的发生[8]。NEK2 作为一个肝癌预后的独立危险因素被认定为原癌基因,在预测肝癌的发生中起到一定的提示作用[9]。本研究对90 例肝癌样本及其配对癌旁组织进行qRT-PCR 检测,发现在mRNA 水平上,NEK2 的表达在肝癌组织中显著高于其对照组;在8 对配对的肝癌组织样本中进行蛋白水平的验证,也发现了同样的结论;表明NEK2 可能作为一个肿瘤标志物对肝癌的发现起到提示作用。通过GEPIA 数据库分析发现NEK2 的高表达与肝癌不良预后密切相关,对预测肝癌的预后具有重要参考价值。
本研究同时探讨了NEK2在肝癌细胞恶性生物学行为中的作用。通过在相对低表达NEK2的肝癌细胞系SK-Hep1 中过表达NEK2,然后采用CCK-8及transwell 实验检测NEK2 的增殖和运动侵袭能力。结果显示过表达NEK2 后能够促进肝癌细胞的增殖和运动侵袭能力。反过来,在相对高表达NEK2 的肝癌细胞系HCCLM3 和SMMC7721 中干扰掉NEK2 后,结果显示低表达NEK2 抑制了肝癌细胞的增殖和运动侵袭能力,以上结果提示NEK2在肝癌的增殖及运动侵袭的恶性生物学方面起到一定作用。但是关于NEK2 如何调控肝癌恶性生物学行为的机制尚不清楚。目前少数研究报道NEK2 通过Wnt/β-catenin 信号途径调控β-catenin的表达来调控肝癌细胞的生长[10]。另有研究发现NEK2 调控肝癌细胞侵袭转移能力可能通过pAKT信号途径,进而激活MMP 的活性来实现的[9]。但NEK2 影响这些代谢途径的机制尚未明确,还需要进一步的探讨。
LI 等[5]发现NEK2 在SMMC-7721 肝癌细胞系中的表达显著高于正常肝细胞系HL-7702 中的表达,但是并没有比较其在高转移性细胞系中的表达情况。ZHANG 等[11]发现NEK2 在肝癌细胞中的表达高于正常肝细胞系LO2,并且发现在高转移性细胞系HCCLM3 中的表达更高,但是并没有探讨其在低转移能力肝癌细胞SK-Hep1 以及人正常胎盘细胞系PLC中的表达情况。本研究发现NEK2在高转移性肝癌细胞系HCCLM3、MHCC97H 中的表达高于正常肝细胞LO2 以及人正常胎盘细胞系PLC,而在低转移能力SK-Hep1 中呈现相对低表达。表明NEK2 在不同细胞系中呈现出不同的表达差异,但其差异表达的机制尚不明确。
上皮细胞间充质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞脱黏附而转变成具有迁移能力的间质细胞的现象,在组织纤维化、慢性炎症、胚胎发育及肿瘤转移过程中发挥重要的病理作用[12],肿瘤细胞通过发生EMT,逃逸了机体的抗癌屏障,导致发生转移的肿瘤细胞数量增加。约90%的肿瘤患者死亡均源于肿瘤侵袭转移,可见调控EMT 进程对肿瘤的防治意义重大[13]。本研究通过GEPIA 数据库探讨了NEK2 与EMT 相关分子之间的关系,结果发现NEK2与Twist1、ZEB1、Vim、FN1、TJP1、TGFB1、CDH1、CD44 及JUP 呈正相关,差异有统计学意义,表明随着NEK2 表达量增加,EMT 相关分子的表达也增加,NEK2 可能通过调控EMT 相关分子进而促进肝癌的转移,进一步的验证实验及如何调控EMT 相关分子机制探讨还需要更深一步研究。
综上所述,NEK2 在肝癌中呈现高表达,与肝癌不良预后密切相关。NEK2 表达增加能够促进肝癌细胞的增殖和侵袭转移能力,并与EMT 表型呈现正相关,对于肝癌的诊断和预测预后具有指导意义。
