沉默Cx43对癫痫小鼠的症状改善作用及对海马星形胶质细胞葡萄糖摄取的影响
2021-03-17刘国玲薛亦白江康徐凯丽
刘国玲 薛亦白 江康 徐凯丽
郑州大学第五附属医院1神经内科,2心脏外科(郑州450000);3南阳医学高等专科学校第一附属医院神经内科(河南南阳473000);4郑州儿童医院神经内科(郑州450000)
癫痫是一种临床常见的慢性反复发作性神经系统疾病,表现为肌肉抽搐和意识障碍,具有突发性、短暂性、反复发作性等特点[1]。癫痫患者目前主要通过服用药物来控制癫痫发作,对于耐药性癫痫则采取切除致痫灶方式进行治疗,但药物难以保护神经细胞,手术方式易损害神经功能,寻找新的治疗靶点对改善癫痫患者症状具有重要意义[2-3]。缝隙连接(gap junction,GJ)广泛存在于神经系统,尤以星形胶质细胞存在较多,由相邻细胞膜的缝隙连接蛋白(connexins,Cxs)组成,介导细胞物质和信息交流,与癫痫发生发展关系密切[4]。星形胶质细胞中Cxs以Cx43表达最多,在神经系统受损后表达上调,参与调节神经损伤[5]。研究显示,能量代谢紊乱是癫痫发生的主要原因之一,癫痫发作过程中局部脑组织能量代谢降低,神经细胞能量主要来源于葡萄糖代谢,星形胶质细胞在脑组织协调葡萄糖代谢过程中发挥重要作用[6]。Cx43 在神经系统中发挥重要作用,但在癫痫模型及其在星形胶质细胞葡萄糖代谢中的作用研究尚少,本研究通过沉默Cx43,观察其对癫痫小鼠的改善作用,以及对星形胶质细胞葡萄糖摄取能力的影响,旨在探讨Cx43 在癫痫中的作用机制,为临床治疗癫痫提供新靶点和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物SPF 级C57BL/6J 小鼠95 只,8 周龄,体质量(20±1)g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006,购入后控制温度(22 ± 2)℃,相对湿度(50±5)%,适应性饲养7 d。
1.1.2 主要试剂和仪器东莨菪碱,盐酸匹鲁卡品(美国Sigma 公司),地西泮注射液(国药准字H12020957,天津金耀药业有限公司,2 mL:10 mg),重组慢病毒(LV-shCx43 和LV-EGFP)(上海吉玛制药技术有限公司),小鼠海马星形胶质细胞[澳赛尔斯生物技术(上海)有限公司],兔抗小鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体(美国Neomarkers 公司),Cy3 标记的驴抗兔IgG(美国Sigma 公司),2-脱氧葡萄糖(2-deoxyglucose,2-NBDG)摄取试剂盒(美国Cayman 公司),小鼠脑立体定位仪(安徽正华生物仪器设备有限公司),RM6240 生物信号采集处理系统(成都仪器厂),IX53 倒置荧光显微镜(日本Olympus 公司),Mini-Protean4 电泳仪(美国BioRad 公司)。
1.2 方法
1.2.1 分组及慢病毒注射取95只小鼠,随机分为假手术组(20 只)、癫痫组(25 只)、空载组(25 只)和沉默组(25 只)。所有小鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉,使用脑立体定位仪固定头部,沿正中矢状位切开皮肤,暴露颅骨和前囟,根据小鼠脑立体定位图谱确定海马齿状回,使用颅钻钻孔,手术组和癫痫组注射5 μL 生理盐水,空载组和沉默组分别注射5 μL LV-EGFP 和LV-shCx43,缝合伤口,涂抹碘伏。
1.2.2 建模注射后恢复7 d,建立癫痫小鼠模型[7]。除假手术组外,其他各组小鼠腹腔注射2 mg/kg 东莨菪碱,用于拮抗外周胆碱能反应,30 min 后,腹腔注射300 mg/kg盐酸匹鲁卡品。观察小鼠反应,根据Racine量表[8],评估小鼠癫痫发作严重程度,面部抽搐,眨眼、节律性咀嚼为1分,出现点头动作为2分,单侧前肢出现阵挛为3 分,双侧前肢出现阵挛为4分,失去平衡、摔倒为5分。2 h内癫痫等级≥3 级,且发作次数≥3 次,达到癫痫持续状态,视为造模成功。2 h 后按5 mg/kg 体质量腹腔注射地西泮,终止癫痫发作。假手术组小鼠腹腔注射等量生理盐水。最终各组小鼠均有20 只用于后续实验。
建模成功后第1 天开始,根据脑图谱定位将脑电图电极植入颅骨左右额叶(3.5 mm A,2.5 mm L)皮层和枕叶皮层(5 mm P,2.5 mm L),参考电极植入小鼠鼻根部,用牙膏水泥固定电极,置入7 d 后开始监测,每组每天各选5 只小鼠,至实验结束,统计各组每分钟平均放电次数。
1.2.3 RT-qPCR 检测小鼠海马组织Cx43 mRNA表达造模后5 d,各组随机选择5 只小鼠,处死后取大脑,分离海马组织,按照Trizol 试剂盒说明书提取总RNA,逆转录合成cDNA,取逆转录模板进行PCR 扩增。反应体系包括:模板cDNA 2 μL,上下游引物各0.5 μL,Taq DNA 聚合酶10 μL,双蒸水7 μL。扩增条件:94 ℃预变性5 min,94 ℃变性5 s,60 ℃退火10 s,72 ℃延伸60 s,共45 个循环。Cx43上游引物:正向:5′-ATGCATCGATAAGCCTAGAT-3′;反向正向:5′-CGTAGACAATGCTGAATGC-3′。以β-actin为内参基因,采用2-△△CT法计算Cx43 mRNA相对表达水平。
1.2.4 荧光免疫组织化学染色观察星形胶质细胞造模后5 d,各组随机选择5 只小鼠,处死取大脑,-80 ℃保存。取保存大脑组织,-20 ℃冠状位连续冰冻切片(片厚10 μm)。切片复温后于4%多聚甲醛固定15 min,PBS 漂洗15 min×3 次,正常牛血清室温封闭2 h,滴加兔抗GFAP 一抗(1∶100),4 ℃孵育过夜,PBS 漂洗15 min×3 次,加入Cy3 标记的二抗(1∶100),室温孵育1 h,PBS 漂洗5 min×3次,50%甘油封片,荧光显微镜下观察星形胶质细胞(Cy3 呈红色荧光)。
1.2.5 观察各组小鼠癫痫持续时间和频率造模后10 d 开始录像观察,记录各组植入电极的小鼠≥4 级癫痫发作持续时间和频率,连续20 d,取平均值。
1.2.6 Cx43 转染星形胶质细胞将小鼠海马星形胶质细胞按1 × 105个/孔,接种于6 孔板,按照LipofectamineTM2000 转染试剂说明书,转染星形胶质细胞,随机分为空白组(转染LipofectamineTM2000)、sh-Cx43 组(转染Cx43-shRNA 质粒脂质体复合物)、NC 组(转染Cx43-shRNA-NC 质粒脂质体复合物),5% CO2培养箱中37 ℃培养,48 h 后显微镜下观察,细胞转染效率均>85%,可用于后续实验。
1.2.7 Western blot检测细胞中Cx43蛋白表达转染48 h 后,收集细胞,加入裂解液,冰上裂解2 h,12 000 r/min 4 ℃离心15 min,收集上清,按照BCA试剂盒说明书测定蛋白浓度,上样蛋白,进行SDSPAGE 电泳,结束后将蛋白转至PVDF 膜,5%脱脂奶粉封闭2 h,TBST 洗膜,加入稀释的Cx43 一抗(1∶500),4 ℃孵育过夜,TBST 洗膜,加入辣根过氧化物酶标记的二抗,室温孵育2 h,TBST 洗膜,将ECL 化学发光液滴加于膜上,显影、定影、拍照。计算Cx43 蛋白相对表达水平(以其与内参蛋白条带灰度比值表示)。
1.2.8 流式细胞仪检测细胞摄取葡萄糖能力取稳定转染各组细胞,加入25 mmol/L 的2-NBDG,37 ℃孵育1 h,用含2 mmol/L D 型葡萄孵育5 min进行竞争性抑制,PBS 洗涤,加入裂解液裂解细胞,10 000 r/min 离心5 min(离心半径12 cm),取上清,上流式细胞仪检测2-NBDG 表达阳性细胞数,计算阳性表达率(2-NBDG 表达阳性细胞数/细胞总数×100%)。
1.3 统计学方法采用统计学软件SPSS 22.0 分析数据,计量资料以均数±标准差表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠海马组织Cx43 mRNA水平比较假手术组、癫痫组、空载组和沉默组海马组织中Cx43 mRNA相对表达量分别为:(0.36±0.08)、(2.32± 0.18)、(2.28 ± 0.15)、(0.51 ± 0.09),海马组织中Cx43 mRNA 相对表达量比较,差异有统计学意义(F=307.708,P<0.001)。与假手术组比较,癫痫组、空载组和沉默组海马组织中Cx43 mRNA 相对表达量升高(P<0.05);与癫痫组和空载组比较,沉默组海马组织中Cx43 mRNA 相对表达量降低(P<0.05);癫痫组和空载组海马组织中Cx43 mRNA相对表达量比较,差异无统计学意义(P>0.05)。
2.2 各组小鼠星形胶质细胞观察荧光显微镜下显示,假手术组星形胶质细胞形状规则,排列整齐;癫痫组GPAP 阳性细胞明显增多,突起增多,排列混乱,交织成网状;空载组与癫痫组细胞状态相似;沉默组GPAP 阳性细胞较癫痫组和空载组明显减少。见图1。
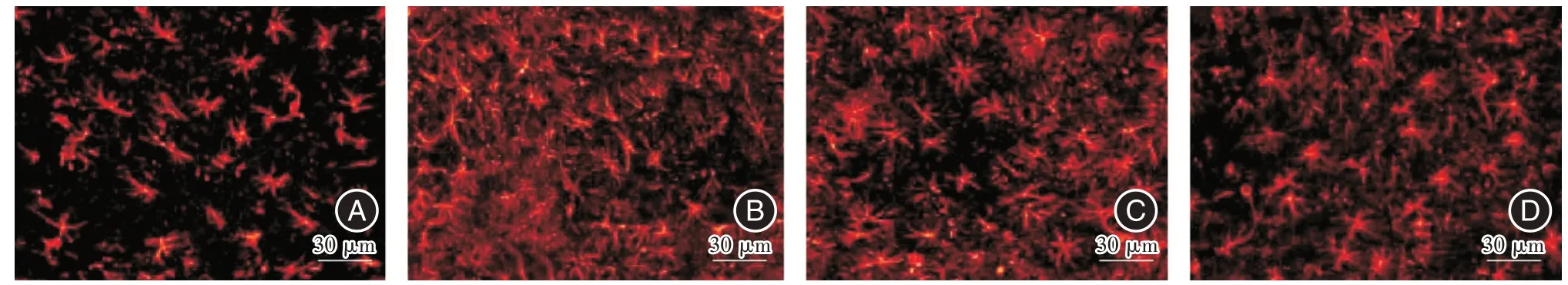
图1 海马A3 区GFAP 阳性的星形胶质细胞(400×)Fig.1 GFAP-positive astrocytes in the hippocampus A3 area(400×)
2.3 各组小鼠脑电监测结果假手术组脑电波以α、θ为主,波幅均在75 μV以下;癫痫组脑电波表现为棘波、尖波节律以及复合波等癫痫样放电,波幅100 ~1 000 μV;空载组波形与癫痫组相同;沉默组棘波、尖波节律以及复合波等癫痫样放电,频率较癫痫组明显降低,波幅在400 μV以下。见图2。
假手术组、癫痫组、空载组和沉默组每分钟平均放电次数分别为:(18.59 ± 6.68)、(282.19 ±15.57)、(276.45 ± 16.13)、(93.27 ± 10.46)次,每分钟平均放电次数组间比较,差异有统计学意义(F= 535.133,P<0.001)。与假手术组比较,癫痫组、空载组和沉默组每分钟平均放电次数增加(P<0.05);与癫痫组和空载组比较,沉默组每分钟平均放电次数减少(P<0.05);癫痫组和空载组每分钟平均放电次数比较,差异无统计学意义(P>0.05)。
2.4 各组小鼠癫痫发作次数和发作持续时间比较发作次数和持续时间组间比较,差异有统计学意义(P<0.05)。与癫痫组和空载组比较,沉默组发作次数和持续时间减少(P<0.05);癫痫组和空载组发作次数和持续时间比较,差异无统计学意义(P>0.05)。见表1。
2.5 转染星形胶质细胞结果荧光显微镜下观察,转染Cx43-shRNA 和转染Cx43-shRNA-NC 的星形胶质细胞90%以上均有荧光表达,可用于后续实验。见图3。
2.6 各组细胞中Cx43 蛋白表达空白组、NC 组和sh-Cx43 组Cx43 蛋白相对表达量分别为:(0.56± 0.11)、(0.53 ± 0.10)、(0.28 ± 0.06),细胞中Cx43蛋白相对表达量比较,差异有统计学意义(F=13.794,P<0.001)。与空白组和NC组比较,sh-Cx43组细胞中Cx43 蛋白相对表达量降低(P<0.05);空白组和NC 组细胞中Cx43 蛋白相对表达量比较,差异无统计学意义(P>0.05)。
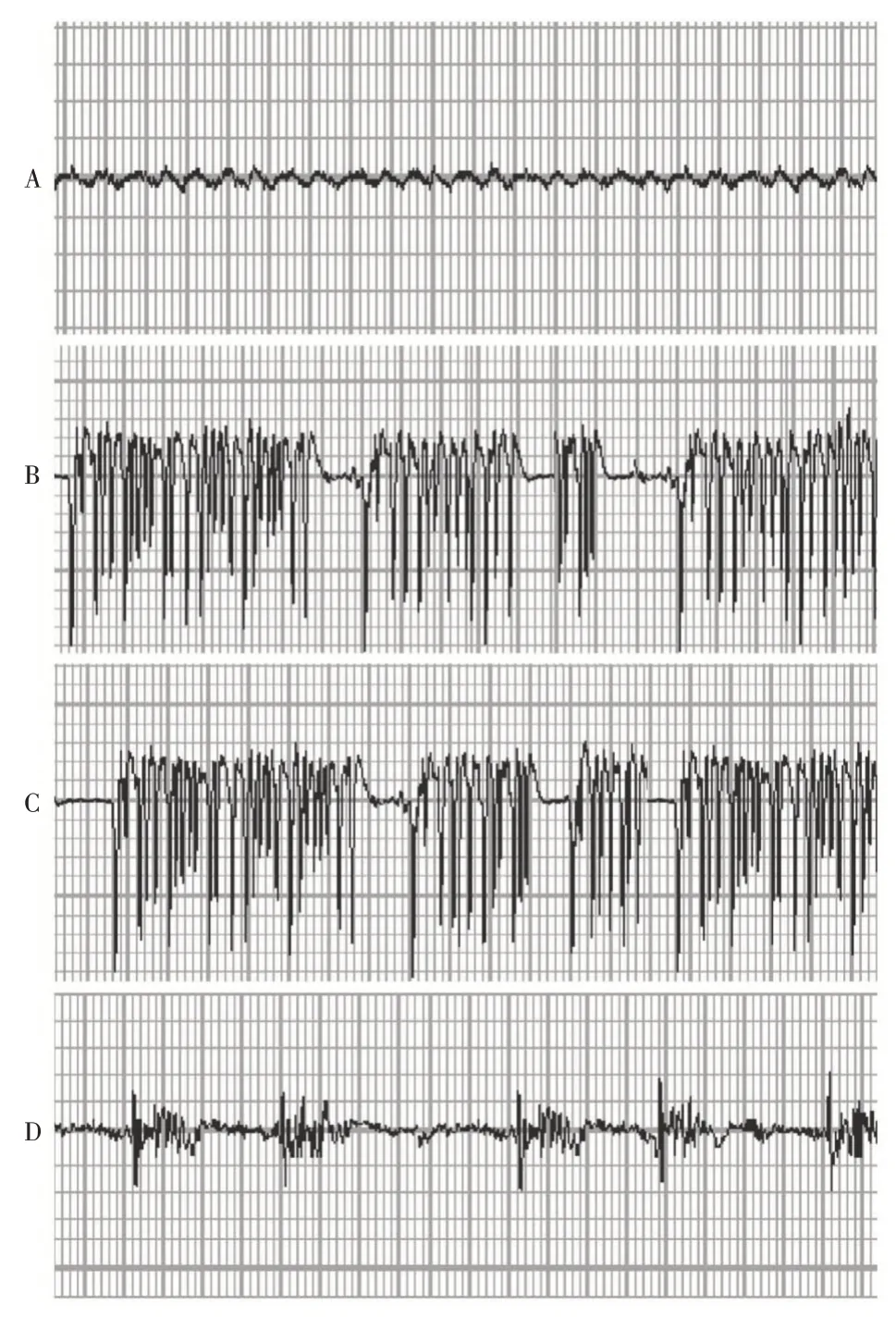
图2 各组小鼠皮层脑电图Fig.2 Cortical EEG of rats in each group
表1 各组小鼠癫痫发作次数和持续时间比较Tab.1 Comparison of the number and duration of seizures in each group of mice ±s
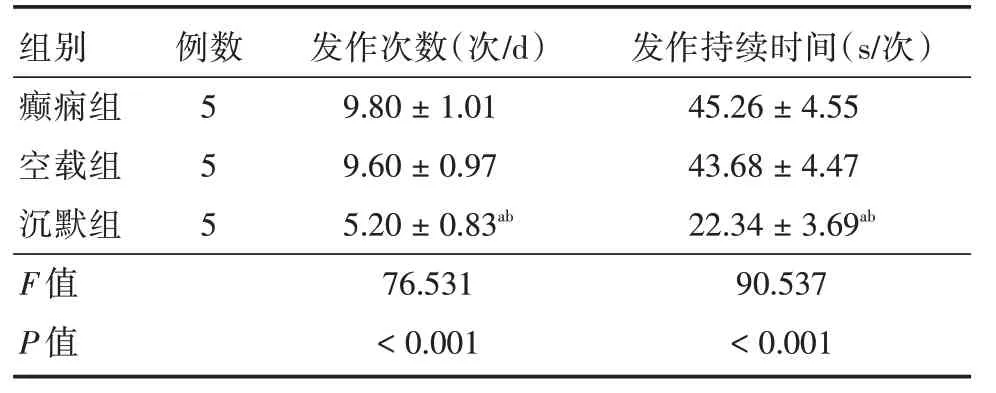
表1 各组小鼠癫痫发作次数和持续时间比较Tab.1 Comparison of the number and duration of seizures in each group of mice ±s
注:与癫痫组比较,aP <0.05;与空载组比较,bP <0.05
组别 例数 发作次数(次/d) 发作持续时间(s/次)癫痫组空载组沉默组F 值P 值5 5 5 9.80±1.01 9.60±0.97 5.20±0.83ab 76.531<0.001 45.26±4.55 43.68±4.47 22.34±3.69ab 90.537<0.001
2.7 各组细胞2-NBDG表达阳性率比较空白组、NC 组和sh-Cx43 组阳性2-NBDG 表达率分别为(15.68±4.57)%、(16.16±4.25)%、(72.45±7.31)%,2-NBDG 阳性表达率组间比较,差异有统计学意义(F=216.489,P<0.001)。与空白组和NC 组比较,sh-Cx43 组2-NBDG 阳性表达率升高(P<0.05);空白组和NC 组2-NBDG 阳性表达率比较,差异无统计学意义(P>0.05)。

图3 星形胶质细胞转染效果图(×200)Fig.3 Transfection effect of astrocytes(×200)
3 讨论
癫痫是一种脑神经元细胞反复异常放电引起的脑部疾病,发作时神经系统功能短暂性功能失常,反复或长时间发作易使患者神经递质过度兴奋,进而损伤神经元功能和结构,影响患者认知功能[9]。中枢神经系统神经胶质细胞在维持神经系统功能中发挥极其重要的作用,癫痫除神经元发生病变外,还伴随神经胶质细胞形态和功能异常[10]。缝隙连接在神经元和神经胶质细胞信号传递过程中发挥重要作用,是癫痫发生发展内在机制之一,阻滞缝隙连接可抑制癫痫发作[11]。Cx43 作为缝隙连接的主要蛋白,抑制其表达可阻滞缝隙连接,推测沉默Cx43 有助于抑制癫痫发作。故本研究通过沉默Cx43,探讨其对癫痫小鼠的治疗作用,并进一步检测其对星形胶质细胞葡萄糖代谢的影响,验证沉默Cx43 的抗癫痫作用。
星形胶质细胞是中枢神经系统特有的神经胶质细胞[12]。与神经元间存在广泛信息交流,活化后可以释放营养因子等,通过缝隙连接影响神经元微环境,调节神经元兴奋性,从而使神经元异常放电,导致癫痫[10]。发生癫痫后,星形胶质细胞形态和结构发生变化,与神经元之间连接模式发生异常,细胞间信息传递功能紊乱,促进癫痫发作[13]。神经胶质细胞之间通过Cxs 传递代谢物和化学信号,支持神经元功能,其中Cx43 在星形胶质细胞中表达最高,是调节神经系统损伤程度的重要因子[14]。体外实验研究显示,特异性阻断星形胶质细胞的Cx43 膜通道,可以减轻体外海马脑片实验中的癫痫发作[15]。动物模拟实验显示,使用阻滞Cx43 半通道的模拟肽,可以抑制癫痫小鼠发作,发挥抗惊厥作用[16]。本研究癫痫组小鼠海马组织Cx43 mRNA 表达较高,经沉默Cx43 基因后,小鼠脑平均每分钟放电次数、星形胶质细胞数量以及癫痫发作次数和发作时间减少,提示沉默Cx43 表达,可在一定程度减少癫痫发作。
星形胶质细胞不仅对神经元有营养、支持、保护和绝缘作用,同时参与调节神经元能量代谢,对大脑能量传递、生产、利用以及存储等方面发挥重要作用[17]。哺乳动物大脑对能量需求非常旺盛,神经元葡萄糖来源除通过血液循环直接获取外,还可以通过星形胶质细胞获得。星形胶质细胞从血液循环中获得的葡萄糖除用于有氧酵解外,剩余葡萄糖以糖原形式储存,是脑中唯一可以储存糖原的细胞,糖原通过降解为神经元提供更多能量底物。癫痫发生发展与大脑能量代谢失衡有关,发生癫痫后,局部神经元细胞缺失,对葡萄糖的利用率降低,癫痫灶出现葡萄糖代谢减低区[18-19]。本研究为进一步明确Cx43 对星形胶质细胞的作用,在细胞水平通过沉默Cx43,结果显示,星形胶质细胞对葡萄糖摄取能力明显提高,提示沉默Cx43 可能通过影响星形胶质细胞能量代谢,维持神经元正常功能,发挥抗癫痫作用。
本研究从动物模型及细胞实验沉默Cx43,结果显示癫痫小鼠临床症状得到明显改善,并能增加星形胶质细胞对葡萄糖的摄取能力,改善大脑能量代谢,维持神经元正常功能,为临床治疗癫痫提供实验参考。本研究未从动物层面探讨Cx43对癫痫小鼠大脑葡萄糖代谢的影响,后续研究需重点探讨,进一步验证沉默Cx43 抗癫痫的作用机制。综上所述,沉默Cx43 可能通过影响星形胶质细胞葡萄糖代谢,发挥一定抗癫痫作用。
