红景天苷预处理脂肪干细胞促进糖尿病大鼠皮肤创面愈合的作用及机制
2021-03-17杨金龙张荣明魏巍汤锋陈健
杨金龙 张荣明 魏巍 汤锋 陈健
1锦州医科大学附属第一医院烧伤整形小儿外科(辽宁锦州121000);2辽宁省锦州市中心医院整形外科(辽宁锦州121000);3中国人民解放军第968 医院烧伤整形科(辽宁锦州121000)
糖尿病皮肤溃疡是常见的糖尿病并发症之一, 近些年干细胞移植用于该病的治疗价值受到越来越多关注。但是,高糖环境对干细胞的增殖、迁移及分化具有抑制作用,不利于干细胞向糖尿病溃疡创面的定向移动,进而影响了创面修复的效果[1-3]。红景天苷是藏药红景天中的活性成分,有研究报道红景天苷在干细胞的增殖、迁移、分化中起到调控作用[4-7]。脂肪干细胞(adipose-derived stem cells,ADSCs)是组织工程领域重要的种子细胞之一,具有来源广泛、取材方便等优势,被用于烧伤创面、糖尿病皮肤溃疡创面的治疗[8-10]。本研究将红景天苷用于ADSCs的干预,一方面观察红景天苷在高糖环境下对ADSCs 增殖、迁移及分化的影响,另一方面观察红景天苷处理ADCSs 后对糖尿病大鼠皮肤创面的愈合作用,旨在为今后使用ADSCs治疗糖尿病皮肤溃疡提供一定的理论参考。
1 材料与方法
1.1 实验材料
1.1.1 动物7 ~8 周龄的SPF 级雄性SD 大鼠购自上海杰思捷实验动物有限公司,体质量200 ~250 g,许可证号:SCXK(沪)2018-0004。
1.1.2 试剂红景天苷、链脲佐菌素购自Sigma 公司,MTS 细胞增殖活力检测试剂盒购自Promega 公司,结晶紫购自上海生工公司,RIPA 蛋白裂解液、BCA 蛋白定量试剂盒购自上海碧云天公司,HE 染色试剂盒购自上海歌凡生物,CD44、CD29、CD45、CD34、角蛋白19(Cytokerantin19,CK19)、CD31、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、胶原蛋白(Collagen,Col)-Ⅰ、Col-Ⅲ抗体购自Abcam公司。
1.1.3 仪器细胞培养箱购自Thermo 公司,显微镜购自Nikon 公司,酶标仪购自Bio-tek 公司,凝胶成像系统购自上海天能公司。
1.2 实验方法
1.2.1 ADSCs 的分离及验证分离大鼠大腿内侧腹股沟处的脂肪组织,剔除脂肪组织膜及血管后剪碎,消化酶消化组织后离心得到沉淀,重悬并接种在培养瓶中,24 h 后换液、去除未贴壁的细胞,而后每3 天换液1 次,细胞融合至80% ~90%后进行消化,取第三代细胞,在流式细胞仪上检测CD44、CD29、CD45、CD34 的表达。
1.2.2 ADSCs 的分组及给药第3 代ADSCs 随机分为对照组、高糖组、高糖+红景天苷组、红景天苷组,分别用低糖(5.5 mmol/L)DMEM、高糖DMEM(25.0 mmol/L)、含有100 μg/mL 红景天苷的高糖DMEM、100 μg/mL 红景天苷的低糖DMEM 处理,每组设置4 个复孔。
1.2.3 ADSCs 增殖的检测采用MTS 试剂盒检测细胞活力并在酶标仪上检测490 nm 波长处的吸光值A490。
1.2.4 ADSCs 迁移的检测在Transwell 模型中检测细胞迁移,ADSCs 接种在上层小室内,下层小室内加入含血清培养基,分组干预后2 d 用结晶紫对迁移细胞进行染色,而后在显微镜下观察计数。
1.2.5 动物分组、造模及干预实验动物随机分为模型组、ADSCs 组、红景天苷ADSCs 组,每组各8 只。造模方法如下:高脂高糖饲料喂养1 个月、腹腔注射链脲佐菌素诱导糖尿病,在背部正中做一直径2 cm 创面。造模后6 h 开始进行干预,对照组经尾静脉注入1 mL 培养基,ADSCs 组经尾静脉注入1 mL 含有2 × 106个ADSCs 的培养基,红景天苷ADSCs 组 经尾静脉注入1 mL 含 有2 × 106个红景天苷预处理48 h 的ADSCs 的培养基。
1.2.6 创面愈合的大体观察干预前、及干预后第7 天、第14 天时,观察创面并拍照,计算创面面积及愈合率。
1.2.7 创面愈合的形态学观察干预后第14 天,处死大鼠并收集创面组织,4%多聚甲醛固定后制作切片,采用HE 染色试剂盒进行染色并在显微镜下观察形态学改变。
1.2.8 蛋白表达的Western blot检测取分组给药的ADSCs或干预后第14天的大鼠创面组织,用RIPA裂解液提取蛋白并检测蛋白含量,取含有30 μg 蛋白的样本进行Western blot 检测,电泳、电转PVDF膜、5%脱脂牛奶封闭、孵育一抗、二抗后在凝胶成像系统中显影得到蛋白条带,根据灰度值计算表达量。
1.3 统计学方法采用SPSS 20.0软件录入数据,计量资料采用均数±标准差表示,采用单因素方差分析进行差异性分析,P<0.05为差异有统计学意义。
2 结果
2.1 ADSCs 表面干细胞标志物的表达第三代ADSCs 表面CD44、CD29 的阳性率均在95%以上,CD45、CD34 阴性表达,表明ADSCs 符合间充质来源干细胞的特性。见图1。
2.2 红景天苷促进ADSCs 的增殖与对照组比较,高糖组的A490水平明显降低,红景天苷组的A490水平明显增加(P<0.05);与高糖组比较,高糖+红景天苷组的A490水平明显增加(P<0.05)且在干预的第1 天、第2 天,红景天苷组及高糖+红景天苷组的A490水平逐步增加,而从干预的第3 天起、红景天苷组及高糖+红景天苷组的A490水平不再继续增加,因此后续选择红景天苷干预2 d 作为检测ADSCs 迁移、分化的时间点。见图2。
2.3 红景天苷促进ADSCs 的迁移干预后2 d,对照组、高糖组、高糖+红景天苷组、红景天苷组的迁移数目分别为(22.38±6.86)、(11.75±3.47)、(19.75±5.14)、(37.49±9.39)。与对照组比较,高糖组的迁移细胞数目明显减少,红景天苷组的迁移细胞数目明显增加(P<0.05);与高糖组比较,高糖+红景天苷组的迁移细胞数目明显增加(P<0.05)。见图3。
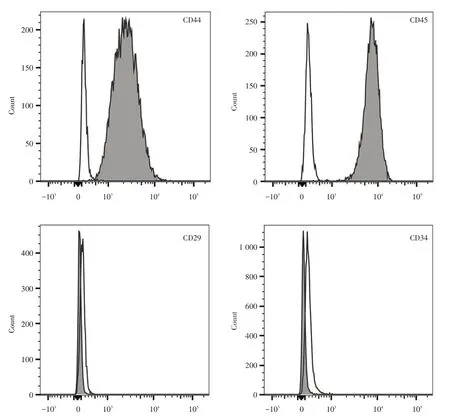
图1 ADSCs 表面CD44、CD29、CD45、CD34 的表达Fig.1 Expression of CD44,CD29,CD45 and CD34 on ADSCs
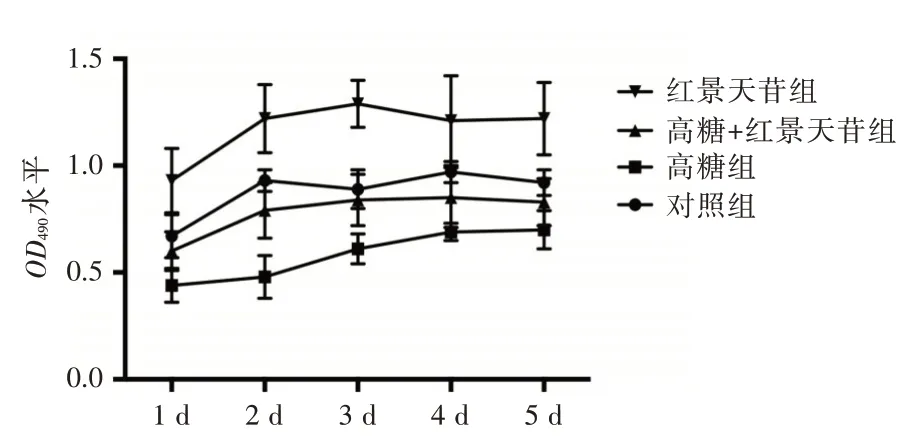
图2 红景天苷对高糖条件下ADSCs 增殖的影响Fig.2 Effect of salidroside on the proliferation of ADSCs under high glucose condition
2.4 红景天苷促进ADSCs 的定向分化干预后2天,与对照组比较,高糖组的CK19、CD31、α-SMA表达量明显减少,红景天苷组的CK19、CD31、α-SMA 表达量明显增加(P<0.05);与高糖组比较,高糖+红景天苷组的CK19、CD31、α-SMA 表达量明显增加(P<0.05)。见图4、表1。
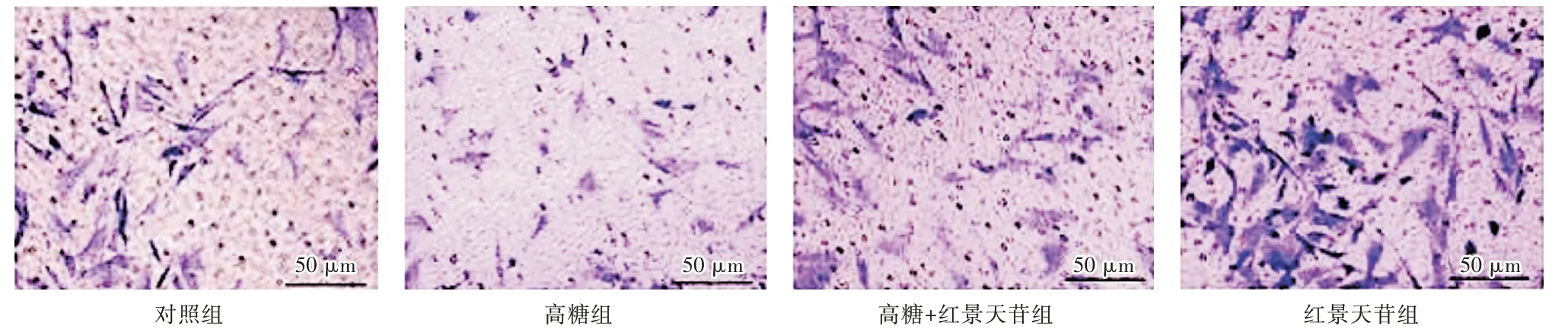
图3 红景天苷对高糖条件下ADSCs 迁移的影响Fig.3 Effect of salidroside on the migration of ADSCs under high glucose condition
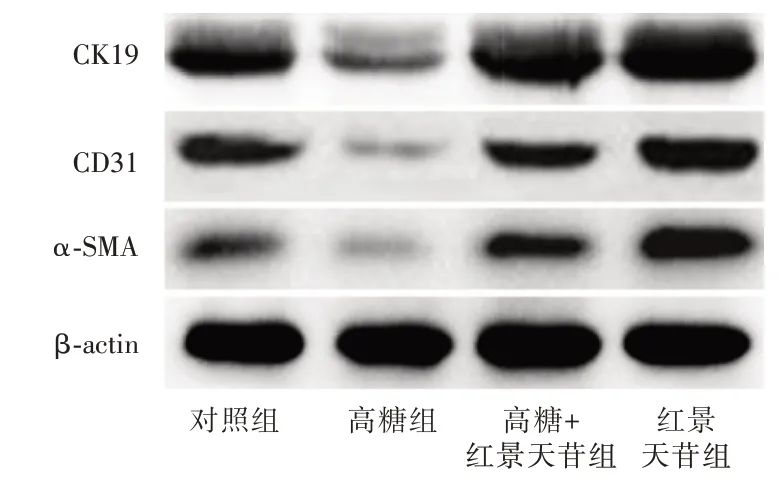
图4 红景天苷对高糖条件下ADSCs 中CK19、CD31、α-SMA 表达的影响Fig.4 Effect of salidroside on the expression of CK19,CD31,α-SMA in ADSCs under high glucose condition
2.5 红景天苷预处理ADSCs 移植促进糖尿病大鼠皮肤创面愈合的大体观察及形态学观察与模型组比较,ADSCs 组、红景天苷+ADSCs 组的创面愈合率均增加(P<0.05)且红景天苷+ADSCs 组的创面愈合率高于ADSCs 组(P<0.05),见表2;HE染色观察形态学改变显示,模型组创面组织中存在大量淋巴细胞、中性粒细胞等炎症细胞,新生血管及成纤维细胞减少;ADSCs 组、红景天苷+ADSCs组创面组织中成纤维细胞增多、炎症细胞减少且红景天苷+ADSCs 组的变化较ADSCs 组更明显,见图5。
表1 红景天苷对高糖条件下ADSCs 中CK19、CD31、α-SMA 表达的影响Tab.1 Effect of salidroside on the expression of CK19,CD31,α-SMA in ADSCs under high glucose condition ±s

表1 红景天苷对高糖条件下ADSCs 中CK19、CD31、α-SMA 表达的影响Tab.1 Effect of salidroside on the expression of CK19,CD31,α-SMA in ADSCs under high glucose condition ±s
注:与对照组比较,*P <0.05;与高糖组比较,#P <0.05
组别对照组高糖组高糖+红景天苷组红景天苷组例数4 4 4 4 CK19 0.78±0.16 0.40±0.09*0.89±0.14*1.19±0.24#CD31 0.69±0.08 0.31±0.07*0.60±0.07*0.93±0.18#α-SMA 0.52±0.09 0.24±0.07*0.58±0.10*0.79±0.14#
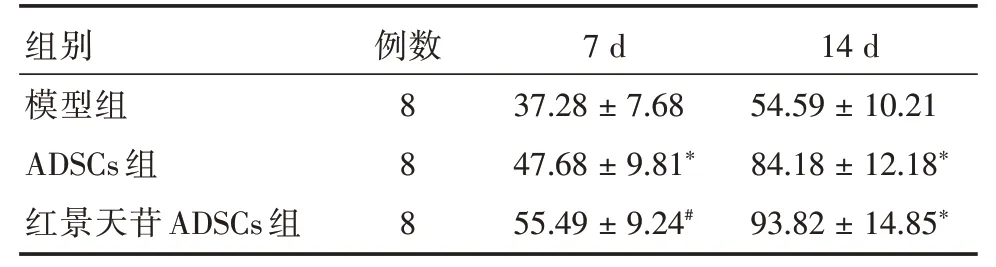
表2 红景天苷预处理ADSCs 移植对糖尿病大鼠皮肤创面愈合率的影响Tab.2 Effect of salidroside pretreated ADSCs transplantation on skin wound healing rate in diabetic rats x±s
2.6 红景天苷预处理ADSCs增加糖尿病大鼠皮肤创面中胶原的表达量与模型组比较ADSCs 组、红景天苷+ADSCs 组皮肤创面中Col-Ⅰ、Col-Ⅲ的表达量明显增加(P<0.05)且红景天苷+ADSCs 组皮肤创面中Col-Ⅰ、Col-Ⅲ的表达量明显高于ADSCs组(P<0.05)。见图6、表3。
2.7 红景天苷预处理ADSCs增加糖尿病大鼠皮肤创面中CK19、CD31、α-SMA 的表达量与模型组比较,ADSCs 组、红景天苷+ADSCs 组皮肤创面中CK19、CD31、α-SMA 的表达量明显增加(P<0.05)且红景天苷+ADSCs 组皮肤创面中CK19、CD31、α-SMA 的表达量明显高于ADSCs 组(P<0.05)。见图7、表4。
3 讨论
ADSCs 是创面修复常用的一类干细胞[11-12],多项研究报道,高糖环境显著抑制ADSCs 的增殖、迁移及分化[13-16]。本研究分离ADSCs 并用高糖培养基处理,结果发现细胞的增殖、迁移受抑制,表皮、血管内皮、血管平滑肌的标志基因CK19、CD31、α-SMA 表达降低,表明高糖对ADSCs 的增殖、迁移及分化具有抑制作用,与既往其他学者的研究结果吻合。
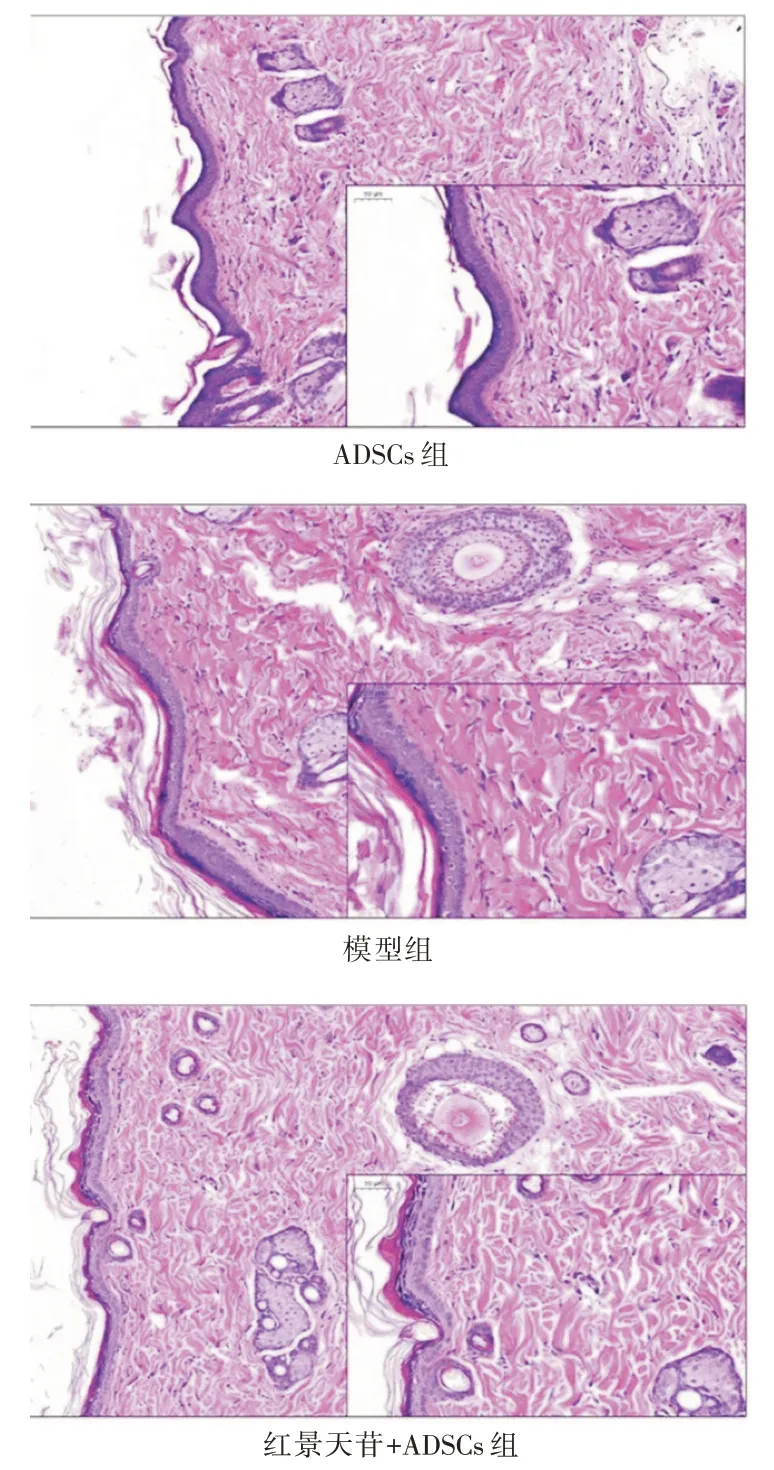
图5 红景天苷预处理ADSCs 移植对糖尿病大鼠皮肤创面形态学的影响(HE 染色,×400)Fig.5 Effect of salidroside pretreated ADSCs transplantation on skin wound morphology in diabetic rats(HE staining,×400)
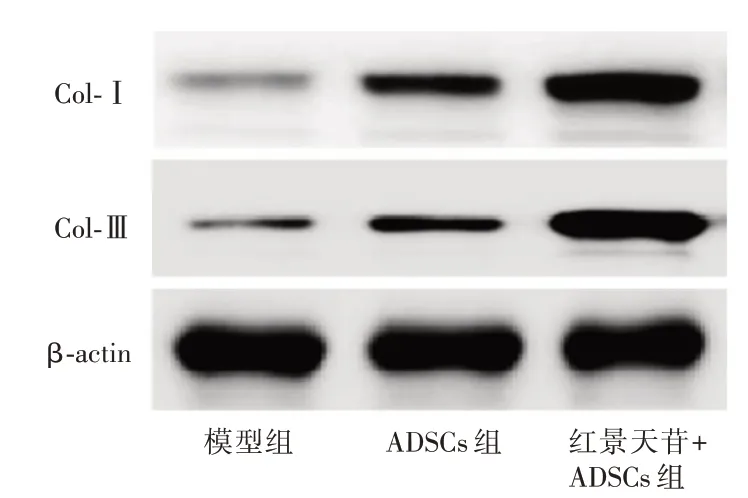
图6 红景天苷预处理ADSCs 移植对糖尿病大鼠皮肤创面中Col-Ⅰ、Col-Ⅲ表达的影响Fig.6 Effect of salidroside pretreated ADSCs transplantation on Col-Ⅰ,Col-Ⅲexpression in skin wound in diabetic rats
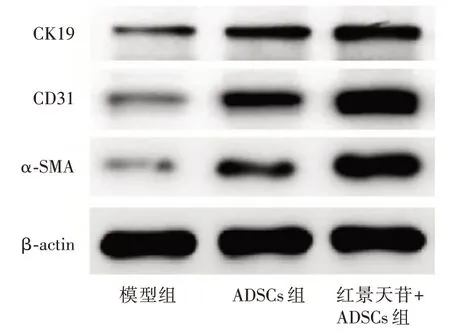
图7 红景天苷预处理ADSCs 移植对糖尿病大鼠皮肤创面中CK19、CD31、α-SMA 表达的影响Fig.7 Effect of salidroside pretreated ADSCs transplantation on CK19,CD31,α-SMA expression in skin wound in diabetic rats
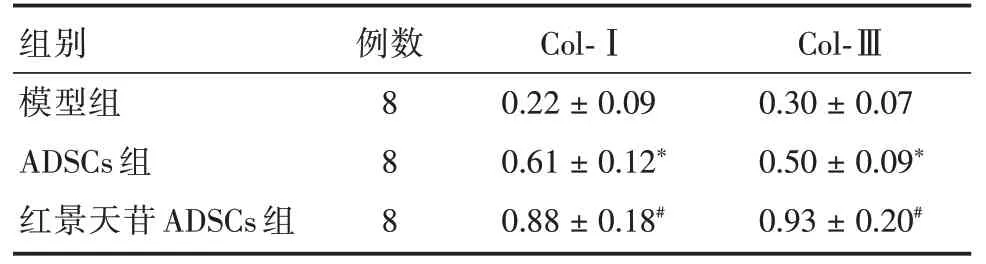
表3 红景天苷预处理ADSCs 移植对糖尿病大鼠皮肤创面中Col-Ⅰ、Col-Ⅲ表达的影响Tab.3 Effect of salidroside pretreated ADSCs transplantation on Col-Ⅰ,Col-Ⅲexpression in skin wound in diabetic rats x±s
ADSCs 在高糖环境下的上述变化会直接影响其修复糖尿病溃疡创面的作用,需要进行必要的干预。国内学者的研究使用白细胞介素8、趋化因子-8 进行干预后,能够减轻高糖引起的ADSCs 损伤[13-14];国外学者的研究使用HIF-1α、CDC42 基因修饰的方式减轻了高糖引起的ADSCs 损伤[15-16]。红景天苷是藏药红景天的活性成分,对高糖引起的多种细胞损伤具有保护作用[17-19]。本实验在高糖环境下加用红景天苷对ADSCs 进行处理,结果发现红景天苷能够减轻高糖对ADSCs 增殖、迁移、分化的抑制作用。
表4 红景天苷预处理ADSCs 移植对糖尿病大鼠皮肤创面中CK19、CD31、α-SMA 表达的影响Fig.4 Effect of salidroside pretreated ADSCs transplantation on CK19,CD31,α-SMA expression in skin wound in diabetic rats±s
注:与模型组比较,*P <0.05;与ADSCs 组比较,#P <0.05
组别 例数CK19CD31α-SMA模型组ADSCs 组红景天苷ADSCs 组8 8 8 0.40±0.09 0.67±0.13*0.93±0.17#0.35±0.07 0.70±0.12*1.04±0.20#0.24±0.05 0.56±0.09*0.94±0.18#
干细胞在创面内的归巢并向上皮细胞、内皮细胞、平滑肌细胞分化能够促进创面的修复[20-22]。本实验在建立糖尿病大鼠皮肤创面的模型后进行了ADSCs 的移植,单纯移植ADSCs 能够促进创面愈合、增加创面中的血管内皮细胞及成纤维细胞,而移植红景天苷预处理的ADSCs 能够增强上述促愈合作用,且创面中CK19、CD31、α-SMA 的表达均增加。这一结果表明红景天苷预处理的ADSCs 具有更强的创面修复能力,红景天苷可能通过促进ADSCs 增殖、迁移及分化的方式增强ADSCs 的创面修复能力。
综上所述,红景天苷对ADSCs 的增殖、迁移、分化具有促进作用,移植红景天苷预处理的ADSCs 能够促进糖尿病大鼠皮肤创面的愈合,促进ADSCs 增殖、迁移及其向表皮、血管内皮及血管平滑肌分化是可能的分子机制。但是目前关于ADCSs进入体内后增殖、定向分化并分布至溃疡的机制尚未明确,今后应通过更多的在体外动物实验来阐明ADCSs 或其他干细胞进入体内后的增殖、分化、迁移过程及相关机制。
