射频消融术联合阿帕替尼治疗肝细胞癌复发患者的疗效及预后因素研究*
2021-03-17高福洋沈太伟张宏伟季世强张化玉许新征
高福洋 沈太伟 张宏伟 米 超 季世强 张化玉 许新征
河北省承德市中心医院(承德医学院第二临床学院)普外科 (河北 承德, 067000)
肝细胞癌(HCC)在全球恶性肿瘤患病率中位居第6位,每年新发HCC患者高达46.6万。患者行根治性切除术治疗后,5年内复发率仍高达70%,预后欠佳[1]。现阶段临床针对复发性HCC已有多种治疗策略,包括再次手术切除、肝移植、射频消融术(RFA)、药物治疗等,其中肝移植、手术切除是治疗该病的根治性方案,但部分患者因多发性肿瘤、肝脏储备能力低下、肝硬化等因素,不宜再行手术治疗。因此,大部分患者选择RFA与药物治疗。RFA可以利用热能使局部组织达到高温,将癌细胞杀死,且不会致周围正常组织受损,但对于肿瘤形态不规则或体积过大的HCC患者而言,消融范围比较局限,可能致治疗效果不理想。阿帕替尼是抗血管生成药物,可对血管生成进行调节,减少肿瘤供血促进癌细胞凋亡,抑制肿瘤的侵袭[2]。基于此,本研究采用RFA联合阿帕替尼治疗复发性HCC患者,分析该方案对患者预后的影响,报告如下。
1 资料与方法
1.1 一般资料 将本院2017年9月至2019年5月收治的复发性HCC患者98例,根据随机数字表法分为两组各49例。观察组男26例,女23例;平均年龄(60.58±10.64)岁;Child-Pugh分级:A级25例,B级24例;肿瘤平均直径(4.23±1.31)cm;肿瘤部位:左肝上12例,右肝上32例,双侧肝上5例;BCLC分期:0期6例,A期33例,B期10例。对照组男29例,女20例;平均年龄(63.57±8.35)岁;Child-Pugh分级:A级22例,B级27例;肿瘤平均直径(4.34±1.57)cm;肿瘤部位:左肝上14例,右肝上27例,双侧肝上8例;BCLC分期:0期4例,A期31例,B期14例。两组患者在一 般资料方面比较,差异均无显著性意义,均P>0.05,具有可比性。
1.2 纳入、排除标准 纳入标准:①诊断符合中华人民共和国卫生和计划生育委员会医政医管局制定的原发性肝癌诊断规范中的标准[3],确诊为肝癌术后复发者,未见远处转移;②癌结节数量≤3个;③Child-Pugh分级为A、B级;④无法行外科手术治疗;⑤精神状态、认知功能正常;⑥签订知情同意书。排除标准:①同时患有其他原发性肿瘤者;②顽固性腹水者;③肾、心等主要脏器严重损害者;④近1个月内使用过对凝血功能有影响的药物者;⑤治疗前消化道出血者;⑥病例资料不全者。
1.3 治疗方法 对照组患者单纯行RFA治疗,仪器为上海涵飞医疗GY-8100射频消融治疗仪。治疗前患者需进行常规的肝肾功能、血常规、心功能、凝血功能等检查,利用腹部彩超确定肝脏肿瘤的数量、位置以及大小,治疗前8 h禁食,取100 mg盐酸哌替啶注射液(国药准字H63020022,青海制药厂有限公司,规格:1 ml∶50 mg)肌肉注射,术前根据情况给予维生素、保肝等处理。患者选择仰卧位,常规消毒、铺巾,行局部麻醉,经手术刀于进针点部位切开,长度约0.3 cm,在CT或彩超引导下,插入射频消融针,使其达肿瘤部位,若肿瘤直径≤3 cm,则需将针尖穿刺至病灶对侧缘0.5~1.0 cm,如果病灶直径在3~5 cm间,则需将针尖放置在病灶中心附近。必须确保进针点与进针路径的准确性,避免因多次穿刺促进肿瘤播散或引起组织损伤。待穿刺成功,将冷循环系统启动,输出功率调整为100 w左右,根据病灶大小确定消融时间,通常选择单针单点消融,首先深部消融,然后浅部消融,若病灶边缘不规则,或病灶直径为3~5 cm,则选择一针多点模式,重叠进行消融。在RFA治疗完毕前,再次接受CT或超声检查,确保消融完全,边界超过病灶边缘的0.5~1.0 cm,待治疗完毕,则将冷循环系统关闭,实施针道消融,最终用纱布覆盖穿刺点并固定。术后常规进行心电监护,卧床休息约6 h,行抗感染、保肝等治疗。术后鼓励患者尽早下床活动,饮食主要为高纤维、高蛋白食物。观察组患者采用RFA联合阿帕替尼治疗。在RFA治疗前2周观察组患者口服阿帕替尼(国药准字H20140103,江苏恒瑞医药股份有限公司,规格:0.25 g/片),以500 mg作为起始剂量,1次/d,餐后30 min服用,在RFA前2 d停药,在RFA治疗后3~7 d,患者肝功能为A、B级,未见严重并发症,则再次口服阿帕替尼,剂量、方法同前。
1.4 观察指标
1.4.1 疗效评估 在首次消融后1个月,评估患者的短期疗效。疗效评估标准[3]。完全缓解:瘤体完全消失;部分缓解:瘤体至少比原体积缩小50%;稳定:瘤体缩小不足原体积50%或增加不足25%;进展:瘤体增加>原体积25%。总缓解率=(完全缓解+部分缓解)/总例数×100%。
1.4.2 血清指标检测 分别在治疗前、首次消融后1个月检测患者血清血管内皮生长因子(VEGF)、E-钙黏蛋白(EC)、基质金属蛋白酶(MMP)以及血清总胆红素(TBil)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)水平。采集3 ml空腹静脉血,离心20 min,转速3 000r/min,分离血清,存放-80℃冰箱待测。经酶联免疫吸附法(试剂盒由上海生工生物工程股份有限公司提供)测定血清VEGF、EC、MMP、TBil、ALT、AST水平。
1.4.3 不良事件发生情况 记录两组患者消融综合征、血象改变及胃肠道反应发生情况。
1.4.4 预后评估 随访18个月,分析患者的生存、死亡率。
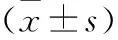
2 结果
2.1 两组患者临床疗效 见表1。

表1 两组患者临床疗效比较 [例(%)]
2.2 两组患者治疗前后血清VEGF、EC、MMP水平检测结果见表2。

表2 两组患者治疗前后3项指标结果比较
2.3 两组患者治疗前后肝功能检测结果 见表3。

表3 两组患者治疗前后肝功能检测结果比较
2.4 两组患者预后情况 随访18个月观察组患者的总生存率为85.71%(42/49),死亡率为14.29%(7/49),对照组则分别为67.35%(33/49),32.65%(16/49)。两组患者总生存率、死亡率比较,差异均有显著性意义(P<0.05)。
2.5 两组患者不良事件发生情况 观察组有10(20.41%)例患者发生不良事件,其中消融综合征4例,血液不良反应3例,胃肠道反应3例;对照组有8(16.33%)例患者发生不良事件,消融综合征3例,血液不良反应2例,胃肠道反应3例。两组患者不良事件发生率比较,差异无显著性意义(χ2=0.272,P=0.602)。
2.6 影响复发性HCC患者预后的单因素分析 见表4。
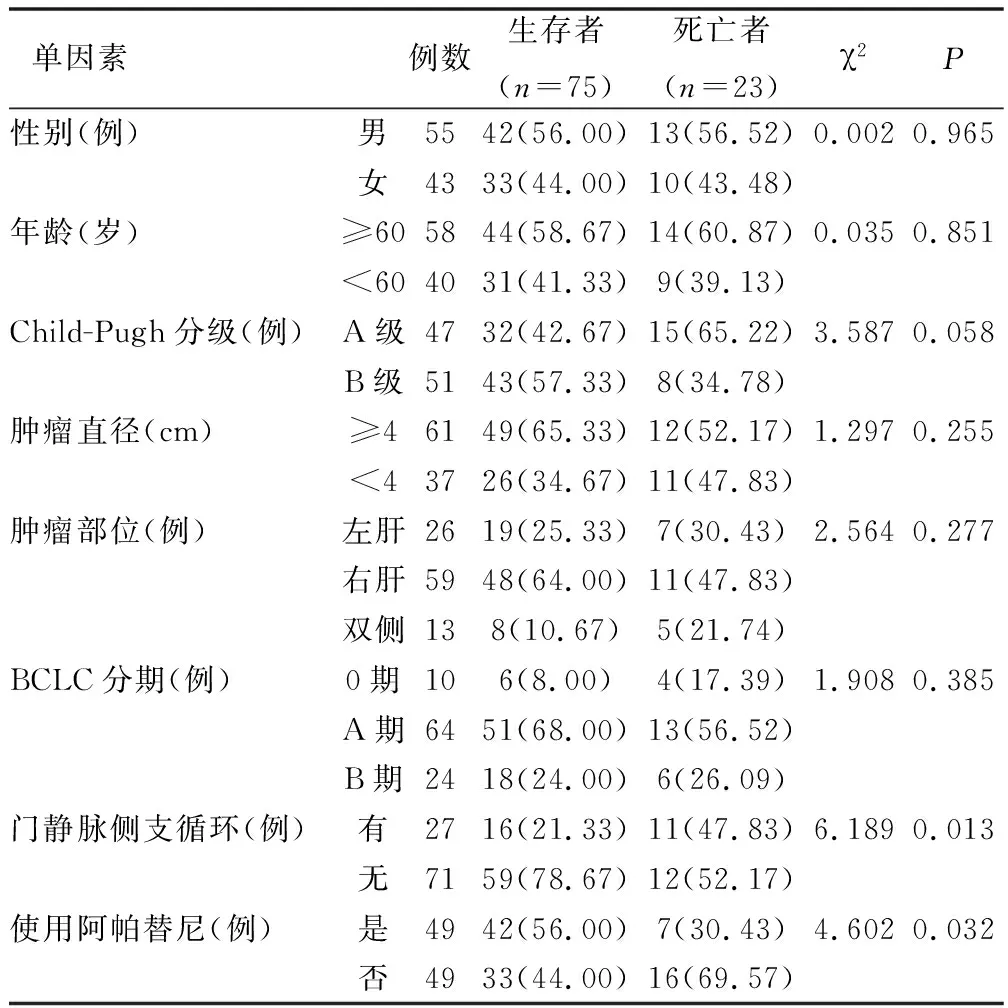
表4 影响患者预后的单因素分析
2.7 影响患者预后因素的COX多因素分析 经COX多因素分析模型对相关变量行量化赋值,以门静脉侧支循环、使用阿帕替尼为自变量X,以复发性HCC患者预后为因变量Y(生存=0,死亡=1),结果提示,门静脉侧支循环与使用阿帕替尼是预后的影响因素(P<0.05),见表5。

表5 影响患者预后的COX多因素分析
3 讨论
肝癌术后复发与多种因素有关,如肿瘤浸润程度、肿瘤大小、手术方式、手术切缘等,若未能及时治疗,随着病情进展,可导致病灶进一步扩大,增加死亡率。目前,RFA在复发性HCC治疗中应用越来越广泛,其具有方便、创伤小、安全性高等特点,在复发、多发性肝癌中均适用[4]。但也有研究认为,即便肝癌患者经RFA干预后,病灶转移微环境仍未能完全改善,再次复发风险仍较高[5]。鉴于此,临床主张在RFA治疗基础上给予靶向药物治疗,提升疗效。有学者认为,恶性肿瘤的转移、复发与血管生成密切相关,使用抗血管生成药物,可能对提高临床疗效有益,阿帕替尼作为新型抗血管生成药,在肿瘤治疗中也有较多应用,它在浓度较低的情况下便能对癌细胞进行抑制[6]。
VEGF是一种促血管新生因子,对血管内皮功能有调节作用,能提升血管通透性[7]。MMP在肝癌侵袭、转移中有重要作用,能促进细胞外基质多个成分降解,增加癌细胞转移风险[8]。EC能调节细胞迁移以及组织分化过程,一旦其表达下调,则可致细胞黏附强度下降,提升其活动性,促进肿瘤侵袭、转移[9]。TBil、ALT、AST是常用的评估肝功能的指标,复发性HCC患者因癌细胞对组织的侵害,导致肝功能下降[10]。本研究发现应用RFA联合阿帕替尼,能进一步抑制血管因子生成与癌细胞分化,改善患者肝功能。分析原因可能一方面RFA用物理方法将癌细胞杀灭,使癌细胞凝固坏死,而且具备微创特征,不会对肝功能产生太多影响[11];另一方面,阿帕替尼对肿瘤血管生成有较强抑制作用,可下调血清VEGF水平,调节抗凋亡基因与促凋亡基因,抑制肿瘤细胞增殖促使癌细胞凋亡[12]。曾广源等[13]也发现,阿帕替尼能抑制肝癌细胞迁移、增殖能力,为本次结论提供了支持。两种治疗方案的近期总缓解率未见差异,表明RFA联合阿帕替尼方案未能提升近期疗效,这可能是由于观察时间较短,尚未体现出联合治疗的优势。结果还提示在RFA基础上加用阿帕替尼治疗的安全性较高。郎丰平等[14]研究结果也提示,阿帕替尼的耐受性良好,进一步证实该药安全、可靠。
既往虽然有关于阿帕替尼治疗肝癌的报道,但大多将肝动脉化疗栓塞术与其联用,而有研究认为肝动脉栓塞可能致肝功能损害加重[15]。本研究创新点在于将RFA与阿帕替尼联用,发现该方案能更有效地改善患者肝功能,中期疗效也比较理想。本研究最终证实,门静脉侧支循环与使用阿帕替尼是预后的影响因素。门静脉侧支循环会增加死亡风险,原因在于其能引起肝硬化门脉高压,使静脉回流受阻,易诱发肝衰竭、消化道出血等严重并发症,导致死亡[16]。阿帕替尼则是改善预后的保护性因素,其能通过调节血管生成因子,抑制癌细胞生长,促进其坏死、凋亡。因此,临床在复发性HCC治疗中,要综合考虑上述因素,积极给予对症处理,改善患者预后。
但该方案的近期疗效未体现出明显优势,研究样本量偏少,且在分析预后影响因素时,纳入的变量较少,未来还需增加样本量,并纳入更多变量对此进行分析。
