等离子体对花生蛋白功能特性和结构的影响
2021-03-16王文涛刘兴丽相启森陈一凡张艳艳
王文涛 张 华 刘兴丽 相启森 陈一凡 张艳艳
(郑州轻工业大学食品与生物工程学院;食品生产与安全河南省协同创新中心;河南省冷链食品质量安全控制重点实验室,郑州 450002)
花生是我国四大油料作物之一,国家统计局信息显示2019年我国花生的产量达1 751.96万t,占全球的39.4%,居世界首位。其中46%的花生用于榨油,产生大量的花生粕。花生粕富含蛋白质、维生素及矿物质,其中蛋白质量分数高达40%~55%,且氨基酸种类齐全,与动物蛋白相近,不含胆固醇,可消化性高,具有丰富的营养价值[1]。然而,由于花生蛋白经过了高温变性、机械压榨等使得其口感和风味也发生了改变,大部分被用作为畜禽类动物的饲料,产品附加值低[2]。因此,花生蛋白的改性和资源利用成为该领域的研究热点[3-6]。
等离子体是由原子或原子团失去电子后电离产生的带电离子及中性粒子组成的离子化气体状物质,被认为是除固体、液体和气体以外,物质的“第四态”。可通过体系中大量的带电粒子和活性粒子的作用实现对样品的加工,是近年来迅速发展起来的新型加工技术,已经在食品工业中显现出了极大的应用潜力,比如对食品体系中的有机大分子淀粉[7]和蛋白质[8]进行改性与功能性优化。
本研究采用常压等离子体射流处理花生蛋白,研究等离子体对花生蛋白功能特性、结构和热特性的影响,以期通过非化学途径改性提高花生蛋白的功能特性,为其在食品领域的应用提供参考。
1 材料与方法
1.1 材料与试剂
热榨花生粕,金龙鱼大豆油,溴化钾光谱纯,其他试剂均为分析纯或优级纯。
1.2 仪器与设备
TS-PL200等离子体处理机,Q100差示扫描量热仪(DSC),Vertex 70 FTIR仪,LGJ-10冷冻干燥机,纳米粒度仪。
1.3 实验方法
1.3.1 花生蛋白悬浮液的制备及等离子体处理
将花生粕原料粉碎后,按照王章存等[9]方法提取蛋白,蛋白质量分数为85.5%。称取6.00 g花生蛋白,缓慢倒入200 mL去离子水,制成浓度为30 g/L的花生蛋白悬浮液。将花生蛋白悬浮液置于等离子体处理机的探头(直径5 mm)下,调节探头到样品的高度为15 mm,处理功率750 W,射频25 kHz,气体压力为0.18 MPa的压缩空气,射流出口流速为30 L/min。在室温下分别处理0、30、60、90、120和150 s,处理后的样品冷冻干燥、研磨、收集,备用。
1.3.2 花生蛋白功能特性的测定
准确称取等离子体处理后的花生蛋白粉末0.4 g溶解于10 mL的去离子水中,参照邵悦等[10]方法进行蛋白溶解性的测定。持水性和吸油性的测定参考文献[10]中的方法进行,起泡性及泡沫稳定性、乳化性及乳化稳定性的测定参考文献[11]中的方法进行。
1.3.3 粒径分布
参考Crudden等[12]测定方法,称取一定量的花生蛋白粉溶解于磷酸盐缓冲溶液(0.05 mol/L,pH7.0)中,配置成0.2%的花生蛋白溶液,采用纳米粒度仪测定花生蛋白溶液的粒径分布。
1.3.4 花生蛋白结构特性的测定
1.3.4.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)
参考Laemmli[13]的方法,SDS-PAGE在12%分离胶(pH8.6)和4%浓缩胶(pH 6.7)的垂直电泳板中进行。非还原条件下,蛋白样品溶解于0.01 mol/L Tris-HCl 缓冲液(pH 6.8,含10% SDS、10%甘油和0.1%溴酚蓝)中,沸水浴5 min后,8 000 r/min离心,取上清液上样10 μL。还原条件下,在Tris-HCl 缓冲液中添加5% β-巯基乙醇。凝胶采用0.25%考马斯亮蓝(R-250)溶液染色,脱色后于凝胶成像系统进行成像处理。
1.3.4.2 二级结构
参考Li等[14]方法,称取2 mg的花生蛋白粉,加入KBr充分研磨均匀后压制成薄片,利用傅里叶红外光谱对薄片进行波段(4 000~400)cm-1扫描。
1.3.4.3 紫外光谱
称取200 mg花生蛋白粉溶解于15 mL磷酸盐缓冲溶液(0.05 mol/L, pH7.0)中,在4 670 g下离心10 min后留上清液。参考涂宗财等[15]方法,取0.5 mL蛋白上清液稀释至12倍,进行紫外光谱扫描。扫描参数:扫描范围:200~400 nm,扫描速度:60 nm/min,光程1.0 cm,狭缝宽度0.2 nm。
1.3.5 花生蛋白热特性的测定
参考Meng等[16]方法,采用差示扫描量热法(DSC)分析花生蛋白的热特性。称取5 mg样品置于铝盒中,压片密闭后进行测定。设定N2速率为50 mL/min,在25~120 ℃进行扫描,扫描速率为10 ℃/min,并选择空密闭铝盒作为参照。
1.4 数据分析
所有试验结果表示为平均值±标准差(n≥3),通过SPPS 16.0、Origin 2018及PeakFit v4.12等软件进行处理和分析。
2 结果与讨论
2.1 等离子体对花生蛋白功能特性的影响
由表1可以看出,等离子体对花生蛋白的各项功能特性均产生了显著变化。随着处理时间的延长,花生蛋白的溶解性、持水性和吸油性不断增大。与对照组相比,分别提高了278%、25.9%和73.7%。随着等离子体处理时间的延长,花生蛋白的起泡性不断降低,乳化性呈现先上升后降低的趋势,起泡稳定性和乳化稳定性不断提高。等离子体处理可向生物大分子中引入大量的亲水性功能基团如氨基、羧基和羟基等[17],使蛋白与水通过氢键的结合能力提高,持水性增加[18]。亲水性基团增多也可以提高花生蛋白的溶解性。Buβler等[19]也发现介质阻挡放电等离子体处理提高了豌豆分离蛋白的持水、吸油能力和溶解性。对于蛋白的起泡性随着等离子体处理时间的增加而降低,可能是因为大量亲水基团的增加,覆盖了疏水基团,影响蛋白分子与乳液的非极性相互作用,蛋白的两性性质减弱,对乳化性和起泡性产生不利影响[20]。
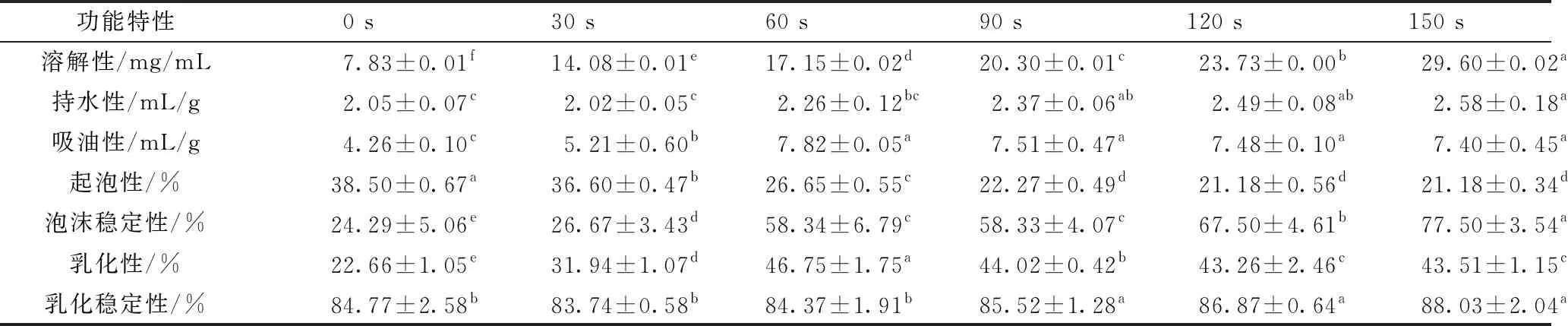
表1 等离子体处理不同时间对花生蛋白功能特性的影响
2.2 等离子体对花生蛋白粒径分布的影响
图1显示,对照组中花生蛋白分子的粒径大小主要为1 000~10 000 μm,占63.2%。随着等离子体处理时间的延长,粒径大的分子含量降低,而粒径小的分子含量不断升高。等离子体处理后,花生蛋白分子的粒径大小主要分布在10~100 μm和100~1 000 μm。当处理时间为150 s时,粒径大小在0~10 μm的蛋白分子占9.6%,粒径大小在10~100 μm的分子占46.1%,粒径大小在100~1 000 μm的分子占32.8%,而粒径大小在1 000~10 000 μm的分子由63.2%(对照)降至11.5%。在一定条件下等离子体处理可向生物大分子中引入大量的自由电子和带电离子,可能使大分子蛋白解聚,蛋白分子粒径变小。当等离子体处理150 s时,粒径大小在1 000~10 000 μm的蛋白分子含量增加,可能是由于等离子体处理破坏了花生蛋白分子的微观结构,导致蛋白分子在水中时颗粒膨胀。
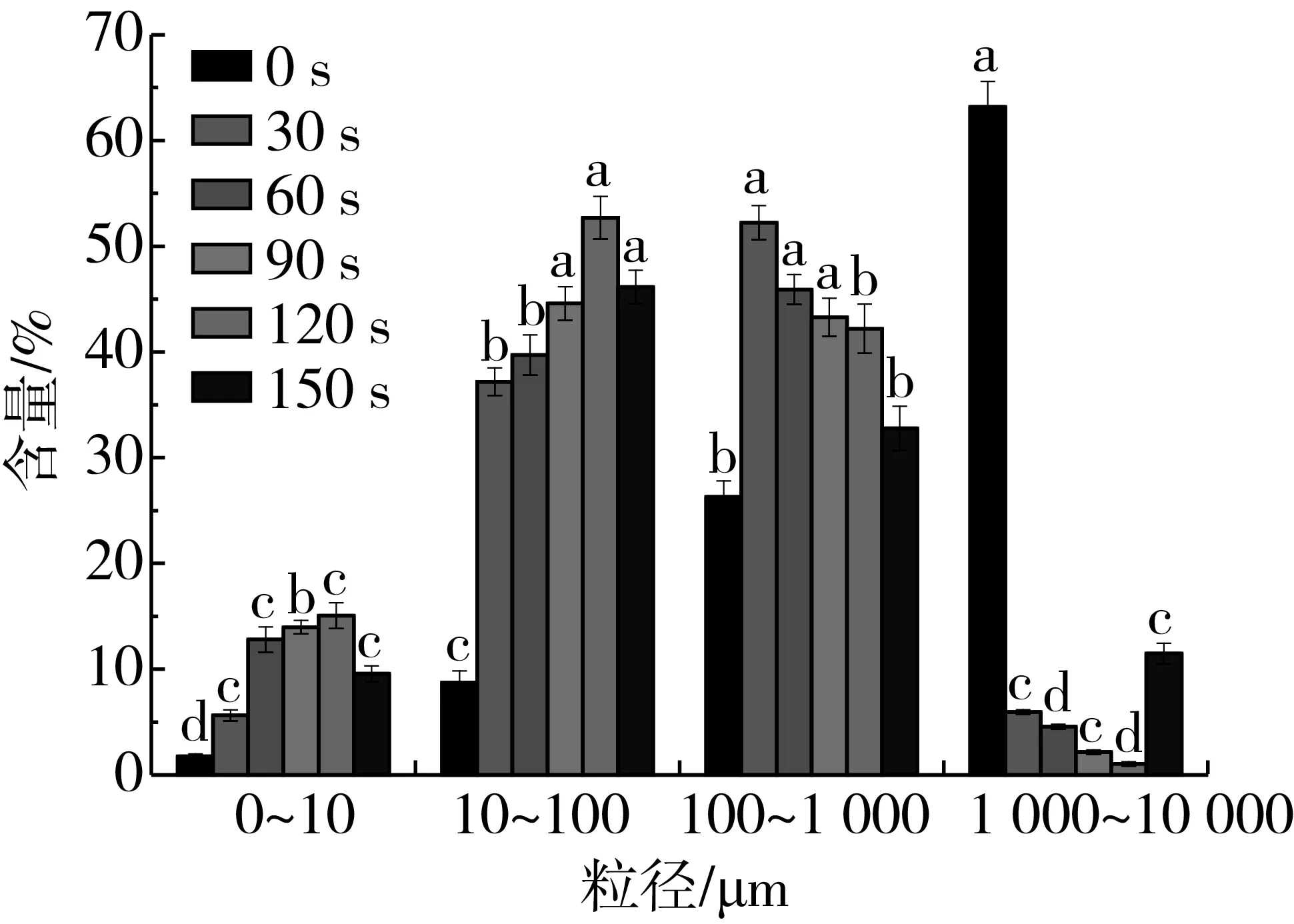
图1 等离子体处理不同时间的花生蛋白粒径分布
2.3 等离子体对花生蛋白结构特性的影响
植物蛋白的功能特性与其相对分子质量分布、亚基的大小、组成、空间特性及其热稳定性有密切的关系[21,22]。为了揭示等离子体对花生蛋白功能特性的作用机制,展开了等离子体对花生蛋白结构的影响分析。
2.3.1 SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)
在还原和非还原条件下,对等离子体处理了不同时间的花生蛋白进行SDS-PAGE分析,研究等离子体处理对蛋白质一级结构和蛋白质聚集体的影响。通过对比图2a与图2b,发现非还原性条件下,在63~75 ku的蛋白亚基中存在着二硫键。非还原条件下,在17~25 ku和25~35 ku范围内的亚基条带,在0~120 s内随着时间的延长不断变深变宽。表明等离子体处理引入的大量的自由电子、带电离子和亲水基团,可能破坏或降低了花生蛋白大分子的静电作用和氢键等,使大相对分子质量蛋白亚基降解为小相对分子质量的蛋白亚基。等离子体处理150 s时,非还原条件下在63~75 ku范围内的亚基条带显著变浅变窄,17~25 ku范围内的亚基条带显著变深,还原条件下在35~48 ku和63~75 ku范围内的亚基条带显著变浅变窄,表明等离子处理150 s时破坏了大分子蛋白亚基(63~75 ku)内以SS键为主的分子结构作用力,也破坏了蛋白亚基(35~48 ku)中除二硫键外的作用力,从而降解成相对分子质量更小的亚基(17~25 ku)。Mehr等[23]也通过电泳研究了大气冷等离子体处理对草豌豆分离蛋白亚基的影响,得到了相同的结果,等离子体处理使交联的蛋白质聚合物或蛋白质聚集体发生了破碎。


注:非还原性SDS-PAGE(a)和还原性SDS-PAGE(b);泳道M为蛋白分子标样;自左向右依次是等离子体处理0、30、60、90、120、150 s的蛋白样品。图2 等离子体处理不同时间的花生蛋白亚基分布
2.3.2 二级结构
表2中数据显示,随着等离子体处理时间的延长,α-螺旋含量呈先降低后上升的趋势。β-折叠由42%逐渐下降至38.82%,而β-转角由20.34%逐渐提高至23.74%,无规则卷曲含量无明显变化。随着处理时间的延长,α-螺旋的下降是因为等离子体处理破坏了氢键,原来有序结构的次级键打开,空间有序度降低。当处理时间大于90 s时,蛋白分子发生了局部聚集,从而α-螺旋含量上升。随着等离子体处理时间的延长,β-折叠含量不断降低,而β-转角含量不断提高,表明等离子体处理可能使β-折叠转化为β-转角,这与氢键的破环有关[24]。而β-转角含量与蛋白质水合性质成正比,β-转角含量上升,会提高蛋白质水合性质[25],即持水性和溶解性增加,这与前面结果一致。季慧等[26]采用低温等离子体处理花生分离蛋白,也得到相似的结果,蛋白的有序结构被破坏,蛋白结构由紧密变松散,亲水性增强。
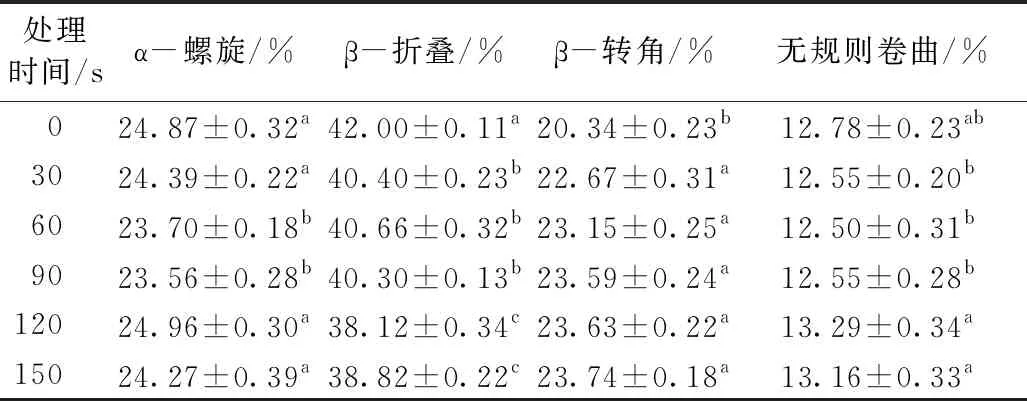
表2 等离子体处理不同时间的花生蛋白二级结构

表3 等离子体处理不同时间的花生蛋白热特性
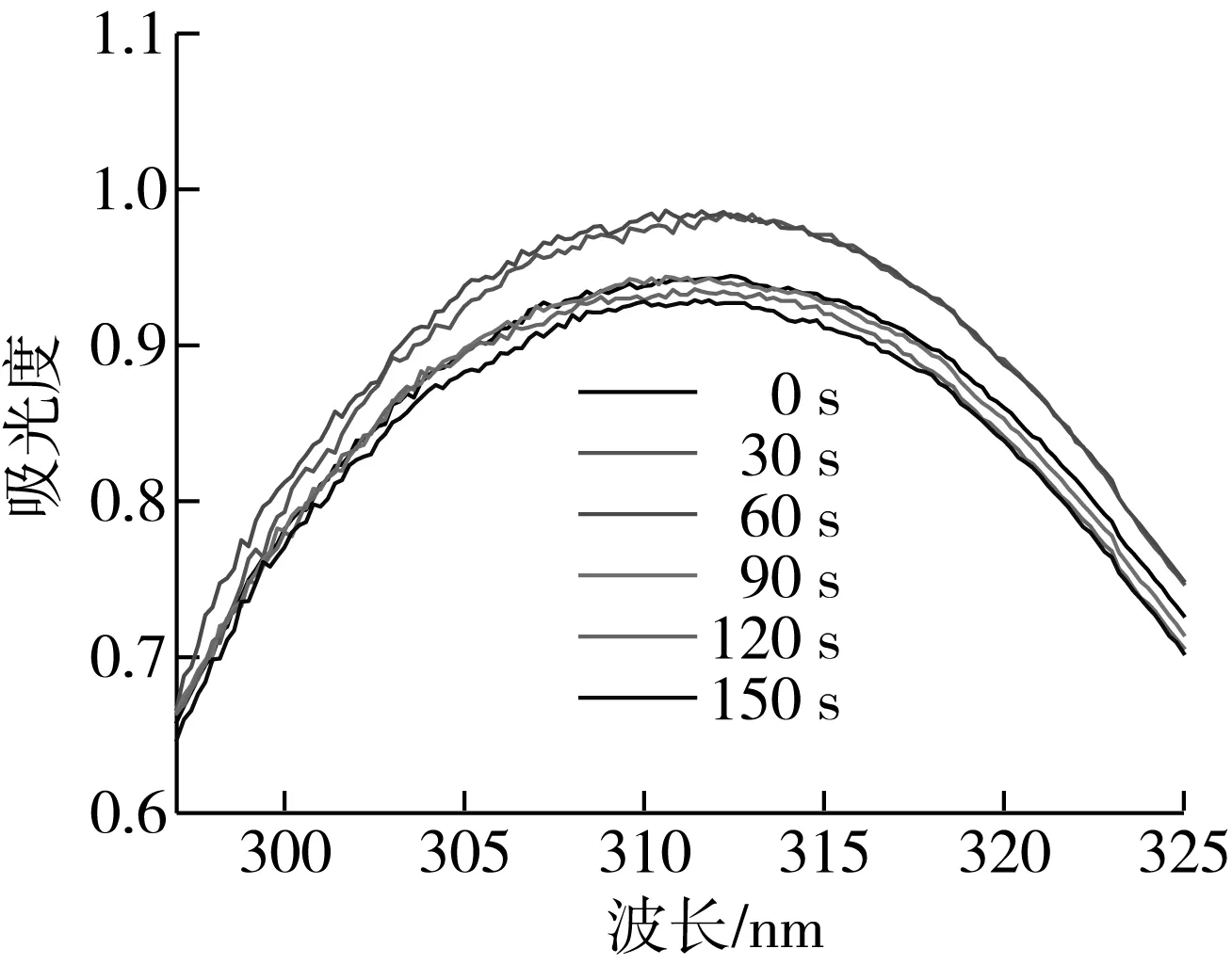
图3 等离子体处理不同时间的花生蛋白紫外光谱
2.3.3 紫外光谱
紫外吸收光谱可推断蛋白质分子三级构象的变化,蛋白质产生紫外吸收主要由于蛋白的发色基团对紫外光的吸收作用[27]。等离子体处理不同时间的花生蛋白紫外光谱图见图3,等离子体处理30~60 s,蛋白的最大吸收波长(λmax)发生蓝移,吸光度增加,说明蛋白质三级结构发生了改变,蛋白分子展开,更多发色基团暴露。处理90~150 s,吸收峰下降,λmax红移,说明等离子体处理使大分子蛋白解聚。
2.4 等离子体对花生蛋白热特性的影响
变性温度(Td)反映了蛋白质的热稳定性,与氨基酸组成和蛋白质的结构和构象有关。如图4所示,花生蛋白有两个吸热峰,分别为花生伴球蛋白和花生球蛋白,花生伴球蛋白肽链更易吸收热量伸展变性,花生球蛋白相对伴球蛋白具有更高的热稳定性[28]。
变性焓值(ΔH)体现了未变性蛋白质的比例和结构的有序程度,也可以反映蛋白质分子的聚集程度[29]。变性温度范围(ΔT)在一定程度代表着变性协同性。峰越窄,说明协同性越高[30]。如表3所示,伴球蛋白的变性焓值(ΔH)随等离子体处理时间的延长逐渐提高,变性温度范围(ΔT)逐渐增大。而球蛋白的变性焓值随等离子体处理时间的延长呈现下降的趋势。表明花生蛋白在等离子体处理后,花生伴球蛋白具有更多有序的空间构象以及维持空间构象所需要的疏水键、二硫键和离子键,变性协同性降低。相反地,花生球蛋白的空间构象有序度降低。
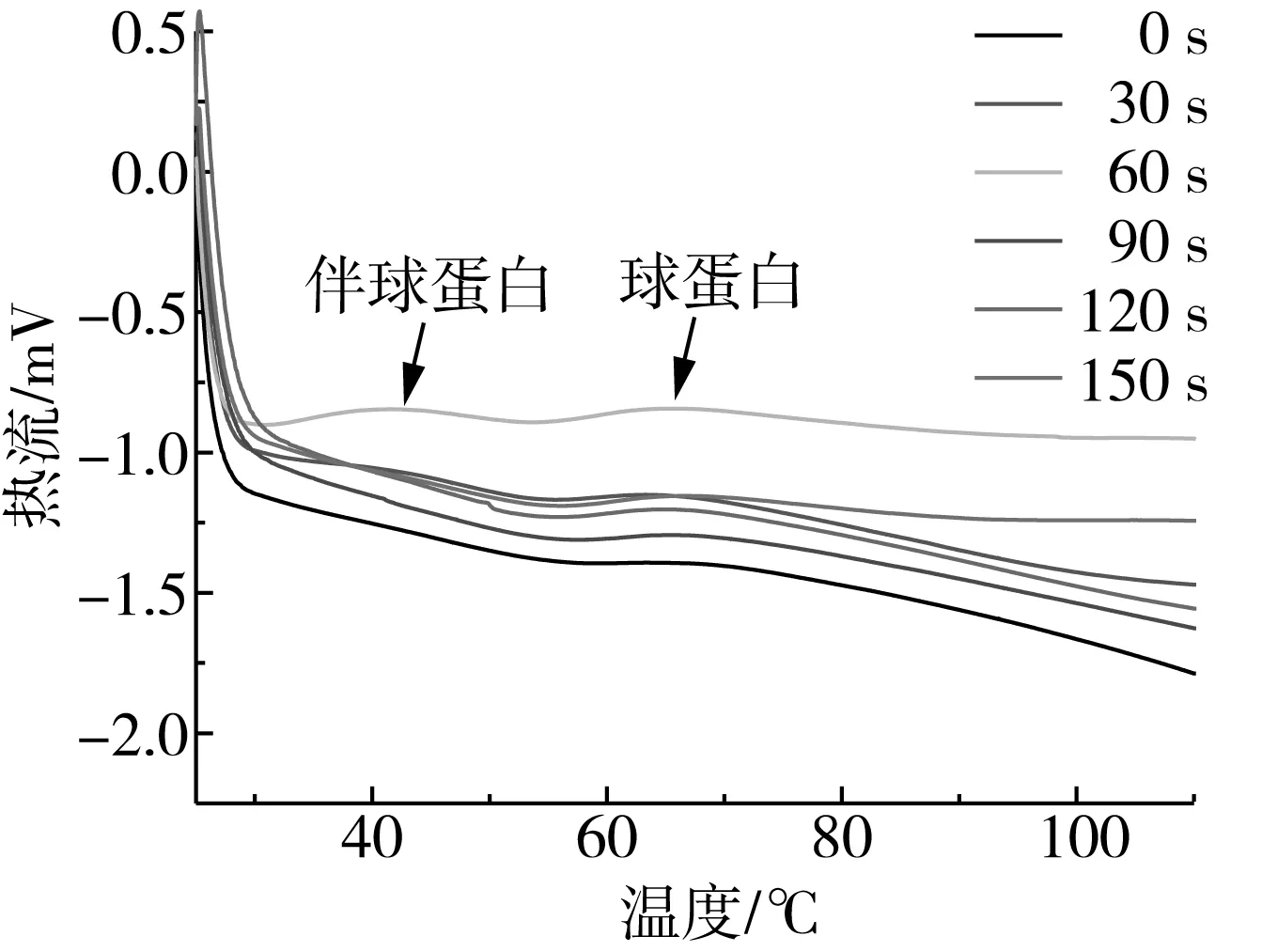
图4 等离子体处理不同时间的花生蛋白DSC曲线
3 结论
研究发现,花生蛋白在等离子体处理150 s后,其溶解性、持水性和吸油性均显著(P<0.05)提高。花生蛋白分子受到等离子体作用,蛋白大分子聚合物解聚为小分子物质,分子粒径变小,二级结构中有序结构被破坏,蛋白质构象发生变化。DSC结果表明,与对照组相比,等离子体处理后的花生伴球蛋白具有更多有序的空间构象以及维持空间构象所需要的化学作用力,变性协同性降低。相反,等离子体处理降低了花生球蛋白的空间构象有序度。总的来说,等离子体对花生蛋白的功能、结构和热力学性质具有明显的改善作用,在蛋白改性方面体现出巨大的价值。
