不同沉淀剂制备Pd/TiO2催化剂对直接合成过氧化氢催化性能的影响
2021-03-15王耀丹史连军秦红潘红艳林倩张鑫
王耀丹,史连军,秦红,潘红艳,林倩,张鑫
(1.贵州大学 化学与化工学院,贵州 贵阳 550025;2.贵州省绿色化工与清洁能源技术重点实验室,贵州 贵阳 550025;3.中低品位磷矿及其共伴生资源高效利用国家重点实验室,贵州 瓮安 550400)
H2O2是一种重要的化工原料,应用于造纸、环保、食品、医药以及农业等领域[1-2]。氢氧直接合成H2O2前景极好,Pd基催化剂被认为是催化效果最好的[3-4]。本文使用不同沉淀剂制备催化剂Pd/TiO2-CD(X),讨论不同沉淀剂制备的催化剂Pd/TiO2-CD(X)对直接合成H2O2催化性能的影响。
1 实验部分
1.1 试剂与仪器
氯化钯、无水碳酸钠、氨水、二氧化钛、尿素、甲醇、浓硫酸、硫代硫酸钠等试剂均为分析纯;实验用水均为去离子水。
DC-3010低温恒温循环槽;JF电子天平;DF-1磁力搅拌器;GC9560气相色谱仪;101-3AB恒温干燥箱;KSS-1400 ℃高温森管式炉;活性评价装置,自制。
1.2 催化剂的制备
称量0.99 g TiO2置于50 mL小烧杯中,加入10 mL 浓度为0.1 mol/L HCl,加入4.69 mL浓度为0.02 mol/L H2PdCl4溶液,在60 ℃下恒温搅拌,滴加浓度为0.25 mol/L Na2CO3溶液,直至体系pH=9。搅拌3 h后,使用去离子水洗涤3次,80 ℃下干燥12 h,600 ℃下焙烧3 h,250 ℃还原2.5 h,得负载量为1%的 Pd/TiO2催化剂,将其命名为Pd/TiO2-CD(Na2CO3)。使用氨水作为沉淀剂,得到催化剂Pd/TiO2-CD(NH3·H2O);使用尿素作为沉淀剂时,先将载体TiO2、尿素和氯钯酸溶液加入到去离子水中,80 ℃水浴5 h,再经过后期热处理,得到催化剂Pd/TiO2-CD(Urea)。
1.3 表征
1.3.1 活性组分Pd 使用Auto ChemⅡ2920 化学吸附仪表征。测试条件:在50 mL/min 的H2气氛中以10 ℃/min 的升温速率程序升温至350 ℃,在该温度下进行还原3 h,之后用N2替换H2,该温度下吹扫0.5 h,再降温至40 ℃,基线平稳后就开始脉冲吸附CO,没有被吸附的CO会通过热导检测器(TCD)进行检测。
1.3.2 催化剂的比表面积以及孔结构参数 使用ASAP 2020 比表面积孔隙度测定仪表征。测试条件:在120 ℃脱气处理后,在77 K下吸附N2。
1.3.3 催化剂的金属氧化物的种类以及含量 使用AutoChem Ⅱ 2920 化学吸附仪表征。测试条件:10%H2/Ar,总流量50 mL/min,升温速率10 ℃/min,热导池检测器检测程序升温还原过程中的耗氢量。
1.3.4 催化剂的晶相 使用XRD表征。测试条件:铜靶Kα光源(λ=0.154 32 nm),在0~90°区间扫描速度为5(°)/min。
1.4 催化剂活性评价
直接合成H2O2的活性评价在半间歇式三相玻璃反应器内进行,气体流量O2(99.9% )10 mL/min、H2(99.999% )5 mL/min 和N2(99.99%)20 mL/min,同时,以80 mL 甲醇和0.9 mL 浓硫酸作为反应的介质。使用催化剂0.02 g,反应温度0 ℃,反应压力101.325 kPa,反应2 h。通过气相色谱定量分析测定尾气中的气体组成,采用碘量法来测定反应介质中生成H2O2的浓度。
2 结果与讨论
2.1 催化剂的表征
2.1.1 金属分散度及其晶粒尺寸 表1为不同沉淀剂制备Pd/TiO2-CD催化剂的CO-脉冲吸附数据。
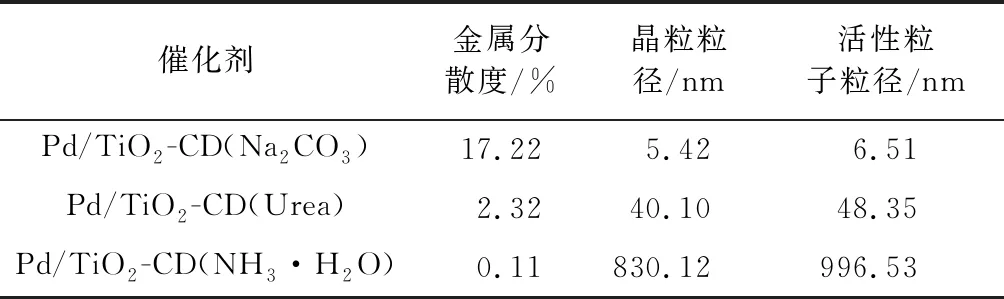
表1 不同沉淀剂制备Pd/TiO2-CD催化剂的CO-脉冲吸附Table 1 CO-pulse adsorption of Pd/TiO2-CD catalysts prepared by different precipitate
由表1可知,沉淀剂对活性组分Pd晶粒粒径和分散度有明显的影响,3个催化剂的Pd分散度顺序为:Pd/TiO2-CD(Na2CO3)>Pd/TiO2-CD(Urea)> Pd/TiO2-CD(NH3·H2O),而晶粒粒径的大小顺序则与之相反,使用Na2CO3溶液作为沉淀剂所制备的催化剂Pd/TiO2-CD(Na2CO3)有着较高的分散度和较小的Pd粒子粒径,其分散度为17.22%,Pd粒子粒径为5.42 nm。这是因为沉积-沉淀法制备催化剂的时候,当Na2CO3溶液滴加到体系,将Pd从盐溶液中转化为沉淀,吸附并固定在载体TiO2上[5]。而催化剂Pd/TiO2-CD(Urea)的金属分散度较小,分散度为2.32%,晶粒粒径为40.10 nm,这是由于尿素在60 ℃以上的水溶液中才能发生缓慢的水解,得到弱碱性的水溶液,而这个过程时间较长,使得Pd沉淀容易团聚长大,所以得到了金属分散度较低的Pd基催化剂。
使用氨水作为沉淀剂制备的催化剂Pd/TiO2-CD(NH3·H2O)的活性组分Pd的分散度相对较低,Pd粒径却较大,Pd的分散度仅仅只有0.11%,活性组分Pd几乎团聚,晶粒粒径增大为830.12 nm。 这是因为使用氨水作为沉淀剂的时候,氨水与溶液中的Pd盐发生了络合反应[6],并没有有效的沉淀在载体的表面,在干燥过程中,发生了结晶,得到了较大的Pd盐颗粒,焙烧时Pd颗粒发生了团聚,得到的催化剂有较小的金属分散度和较大的晶粒粒径。
2.1.2 孔结构分析 图1(a)为使用不同沉淀剂制备的Pd/TiO2-CD催化剂的N2吸附等温线。
由图1(a)可知,使用不同沉淀剂制备的Pd/TiO2-CD催化剂的孔结构相对于载体都发生了不同程度的改变。3个Pd/TiO2-CD催化剂的N2等温吸附线均属于III型等温吸附线,在P/P0<0.1时,他们的N2吸附量均较小,说明所制备的催化剂微孔含量较少,与图1(b)中的孔径分布图相符。并且3个催化剂在P/P0大于0.8有H2型的滞后环,BET比表面积和孔容最大,说明这3个催化剂经热处理后得到较多的大中孔,与图1(b)中的孔径分布图相符,这是由于沉积-沉淀法制备催化剂时,沉淀pH大于TiO2的等电点,TiO2纳米颗粒发生了团聚,使得制备的催化剂的孔径主要分布在大中孔部分。表2为不同沉淀剂制备的催化剂Pd/TiO2-CD的比表面积及孔结构参数。

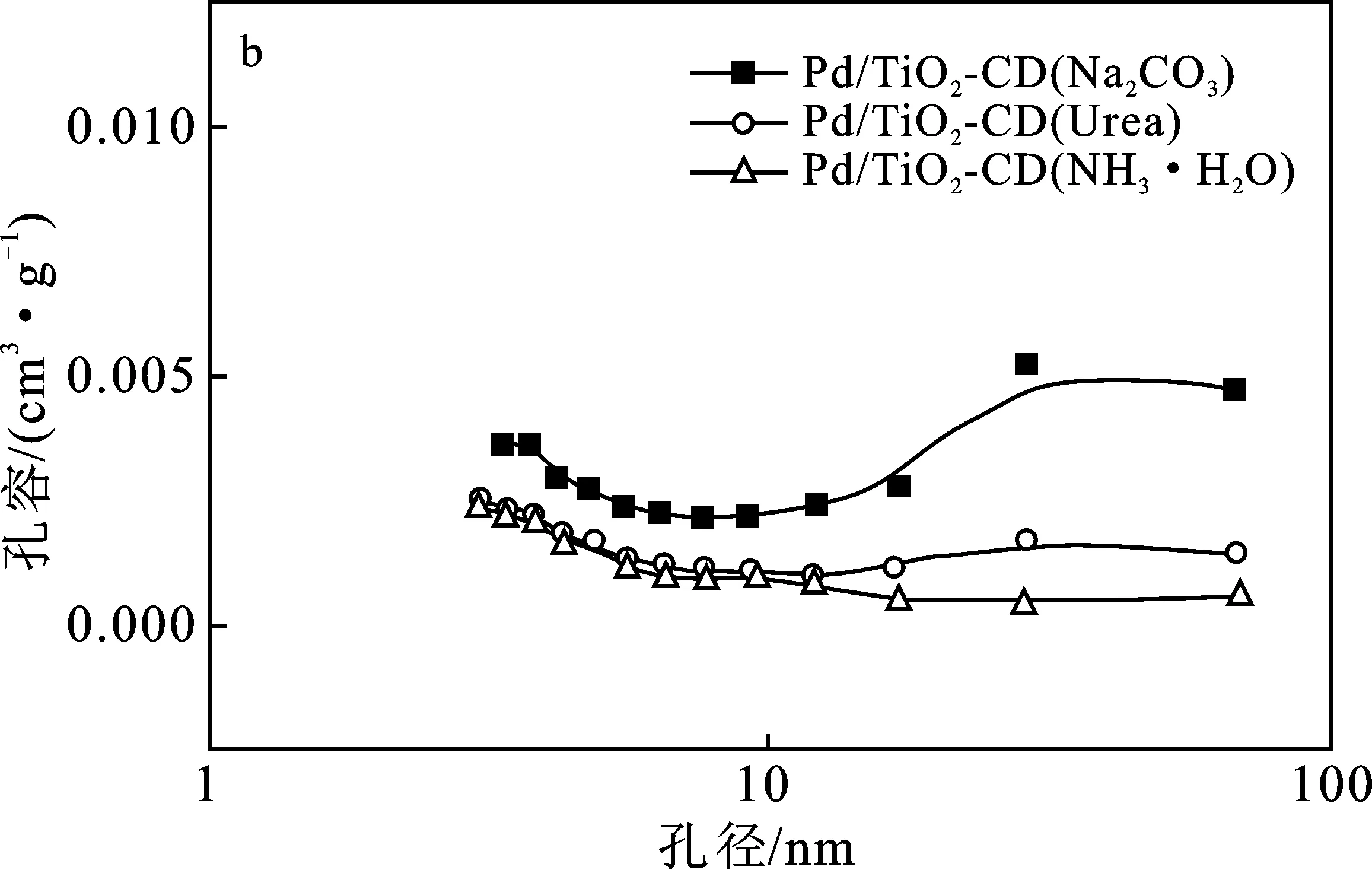
图1 不同沉淀剂制备Pd/TiO2-CD催化剂的N2等温吸附/脱附等温线及孔径分布图Fig.1 N2 adsorption-desorption isotherms and pore size distribution of Pd/TiO2-CD catalysts prepared by different precipitate

表2 不同沉淀剂制备Pd/TiO2-CD催化剂的BET比表面积与孔结构参数Table 2 BET specific surface area and pore structure parameters of Pd/TiO2-CD catalysts prepared by different precipitate
由表2可知,催化剂Pd/TiO2-CD(Na2CO3)较其他两个催化剂有更大的比表面积和孔容,催化剂Pd/TiO2-CD(Na2CO3)分散度最好,所以催化剂Pd/TiO2-CD(Na2CO3)比另外两个有更好的比表面积和孔结构,这将有利于H2O2的反应物和生成物的进出,从而有利于提高H2O2的选择性和产率。
2.1.3 H2-TPR 图2是不同沉淀剂制备的催化剂Pd/TiO2-CD的H2-TPR图。
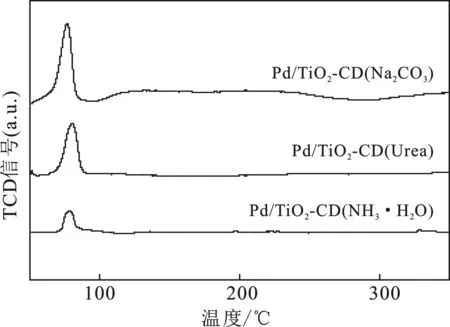
图2 不同沉淀剂制备Pd/TiO2-CD催化剂的H2-TPR图谱Fig.2 H2-TPR of Pd/TiO2-CD catalysts prepared by different precipitate
由图2可知,3个催化剂均在80 ℃时出现了较大还原峰,为PdO的还原峰。可知,在TiO2和氧气的参与下,使用不同沉淀剂制备的Pd/TiO2-CD催化剂均会形成部分氧化态的PdO活性组分。
对比3个催化剂上的PdO还原峰面积可知,催化剂的PdO还原峰面积大小顺序为Pd/TiO2-CD(Na2CO3)>Pd/TiO2-CD(Urea)>Pd/TiO2-CD(NH3·H2O),可知,Pd/TiO2-CD(Na2CO3)上PdO含量最大,PdO能够使O2分子发生非解离吸附,使得O2分子中的O—O键不容易发生断裂,从而不易生成H2O,有效减少副反应的发生。
2.1.4 XRD表征 图3为不同沉淀剂条件下制备的催化剂Pd/TiO2-CD的XRD图。
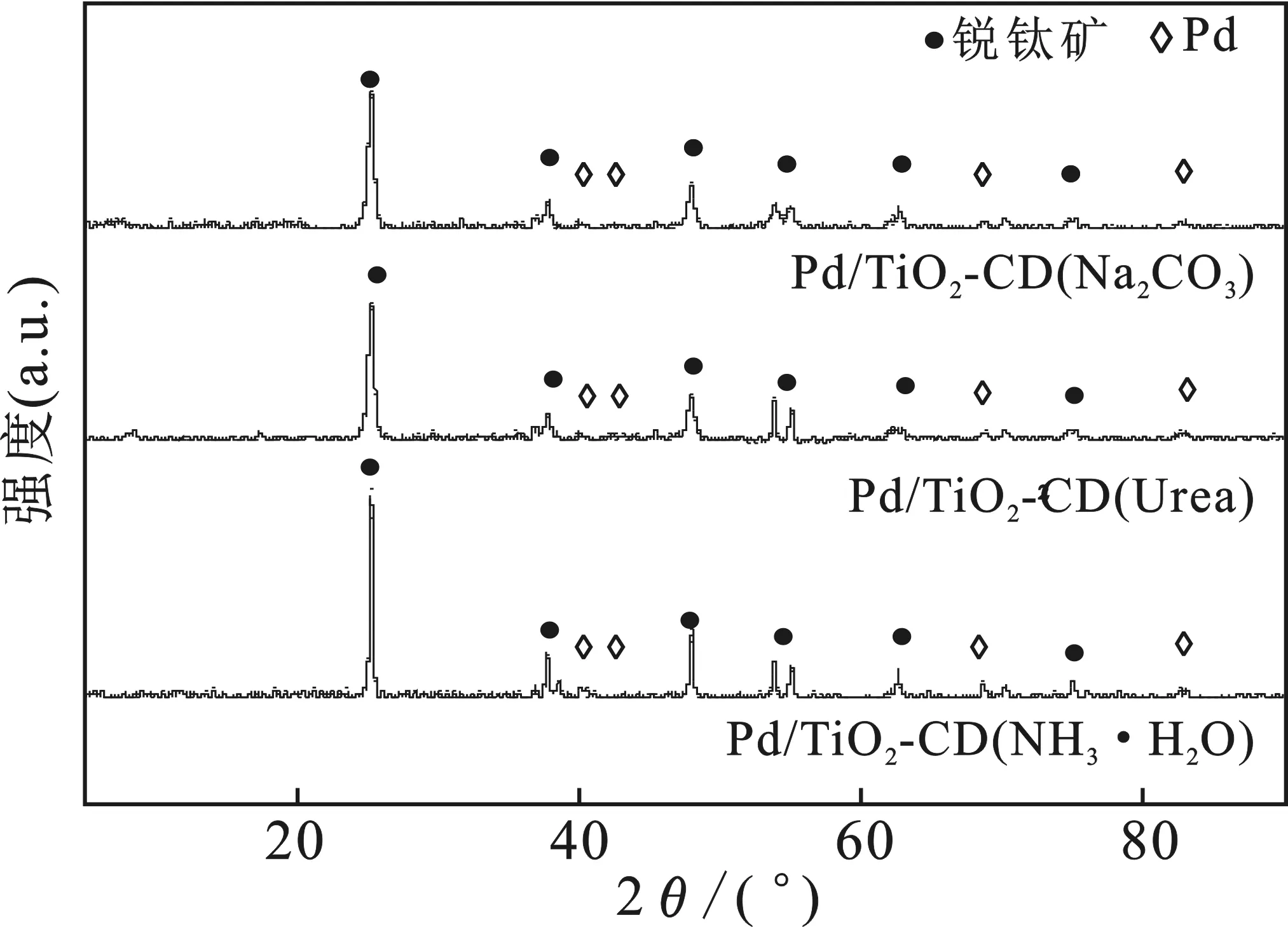
图3 不同沉淀剂制备的催化剂Pd/TiO2-CD的XRD图Fig.3 XRD of Pd/TiO2-CD catalysts prepared by different precipitate
由图3可知,在2θ=25.3,38,47.7,54.8°处3个催化剂都出现了锐钛矿型TiO2的特征衍射峰,说明催化剂的制备过程中载体TiO2的晶型没有发生转变。
此外,在2θ=40.1,46.6,68.1,82.2°处3个催化剂都出现了比较弱的Pd特征衍射峰,表明3个催化剂上的活性组分主要为Pd。同时,XRD图中没有检测出PdO的特征衍射峰,但从H2-TPR图(见图2)可知,3个催化剂都含有PdO。这是由于晶体尺寸小于5 nm的金属(或金属氧化物)颗粒不能被XRD检测出,因此,可推测出3个催化剂中PdO的颗粒尺寸较小。
2.2 催化剂的活性评价
图4为3个催化剂Pd/TiO2-CD催化H2、O2直接合成H2O2的活性评价。
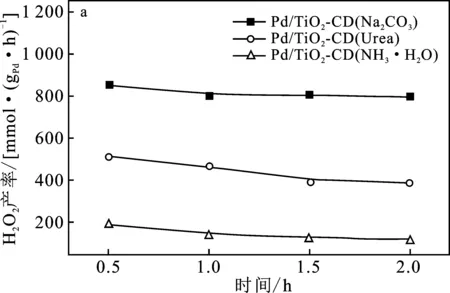
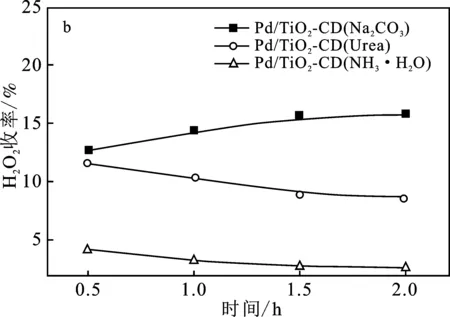
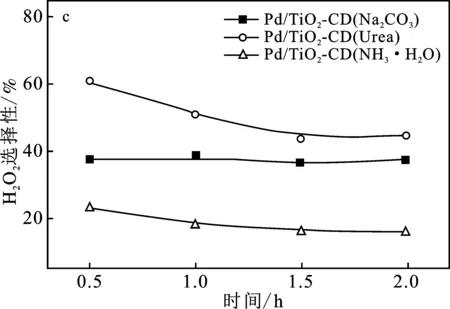
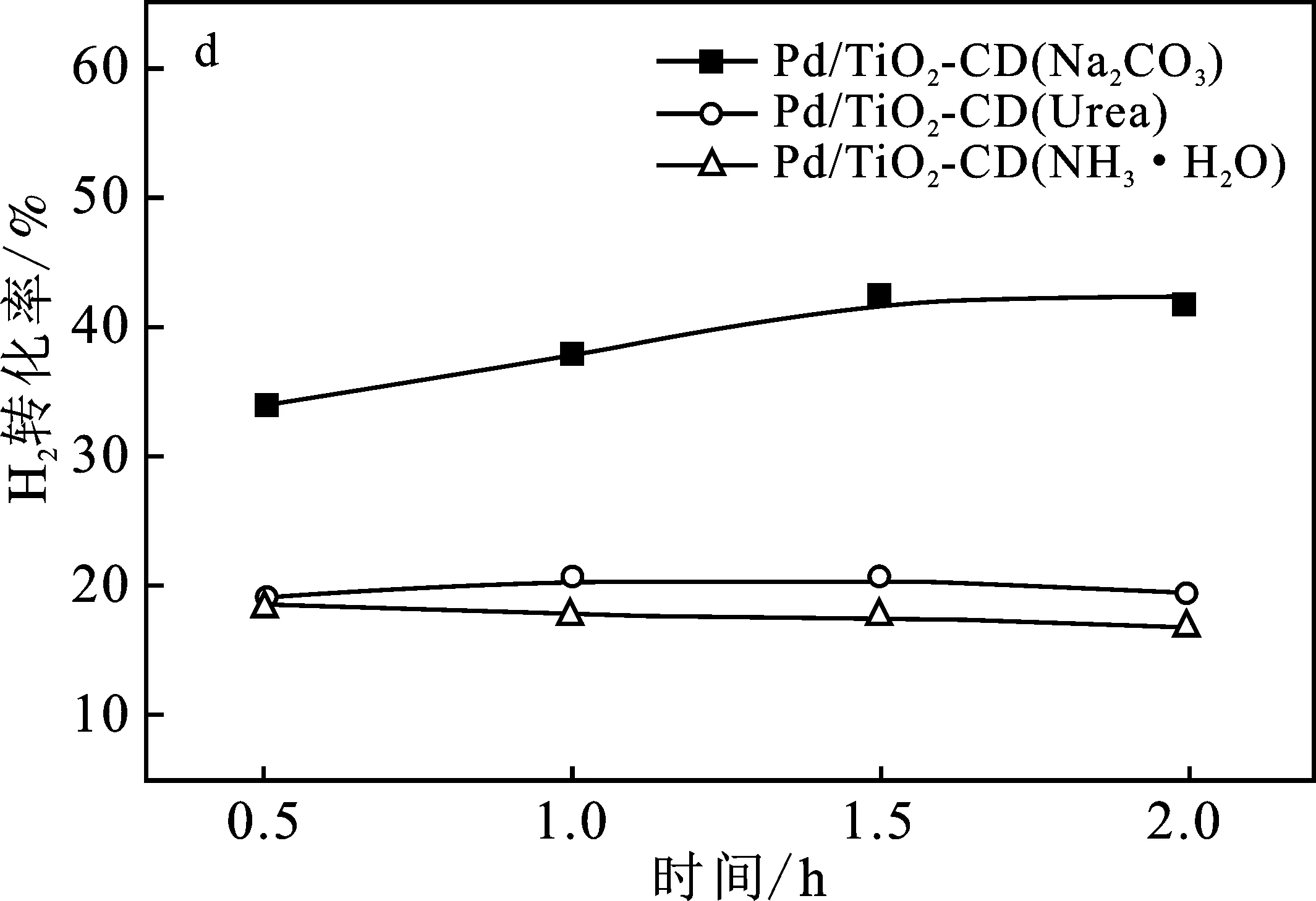
图4 不同沉淀剂制备的催化剂Pd/TiO2-CD催化H2、O2直接合成H2O2活性评价Fig.4 The activity test of Pd/TiO2-CD catalysts prepared by different precipitate on the performance of direct synthesis of H2O2(a)H2O2产率;(b) H2O2收率;(c) H2O2选择性;(d) H2转化率
由图4(a)可知,3个催化剂合成H2O2产率的大小顺序是:Pd/TiO2-CD(Na2CO3) > Pd/TiO2-CD(Urea) > Pd/TiO2-CD(NH3·H2O)。可知,Pd/TiO2-CD(Na2CO3)有较好的催化性能,反应0.5 h,H2O2产率达到852.3 mmol H2O2/(gPd·h),而Pd/TiO2-CD(Urea)和Pd/TiO2-CD(NH3·H2O)催化剂在反应0.5 h时合成H2O2的产率却分别低至517.0 mmol H2O2/(gPd·h)和187.8 mmol H2O2/(gPd·h)。这是由于Pd/TiO2-CD(Na2CO3)催化剂上活性金属Pd的晶粒粒径较小,仅为5.42 nm,分散度越大,提供的活性位点就越多,更有利于反应物分子在活性位点上的吸附和活化,从而提高合成H2O2的活性。此外,3个催化剂随反应时间的增加,H2O2的产率变化较小,说明3种催化剂稳定性较好。因此,后续使用碳酸钠溶液作为沉淀剂制备Pd/TiO2-CD催化剂进行研究。
3 结论
通过沉积-沉淀法,不同沉淀剂制备了催化剂Pd/TiO2-CD(Na2CO3)、Pd/TiO2-CD(Urea)、Pd/TiO2-CD(NH3·H2O),并使用CO 脉冲、孔结构分析、H2-TPR、XRD等表征手段分析催化剂的性质,讨论催化剂对直接合过氧化氢的影响。结果表明,催化剂Pd/TiO2-CD(Na2CO3)的金属分散度较高,Pd粒径较小,分散度为17.22%,粒径为5.42 nm,分散度越高,同时粒径越小,意味着活性组分可以暴露出更多的活性位点,有利于合成过氧化氢。同时,催化剂Pd/TiO2-CD(Na2CO3)有较大的比表面积和平均孔容,比表面积为54.136 m2/g,平均孔容为0.437 cm3/g,这更加有利于反应物和生成物的进出。催化剂Pd/TiO2-CD(Na2CO3)上PdO含量最大,PdO能够促进O2分子发生非解离吸附,使得PdO活性位上吸附的O2分子的O—O键不易发生断裂,减少H2O的合成,从而提高H2O2选择性。
当沉淀剂为Na2CO3时的催化剂Pd/TiO2-CD(Na2CO3)对直接合成过氧化氢有较好的催化性能,产率达到852.3 mmolH2O2/(gPd·h),较催化剂Pd/TiO2-CD(Urea)[517.0 mmol H2O2/(gPd·h)]和Pd/TiO2-CD(NH3·H2O)[187.8 mmol H2O2/(gPd·h)]产率最佳。
