利格列汀联合门冬胰岛素50治疗肝源性糖尿病患者疗效及HOMA-IR和HOMA-β水平变化
2021-03-15夏文芳
张 彦,夏文芳,金 进,王 黎
肝脏在人体糖代谢和脂代谢过程中发挥着重要的作用。各种慢性肝脏疾病所引发的肝实质损伤均会引起肝源性糖尿病的发生,临床主要表现为糖代谢紊乱和慢性肝病的症状,如乏力、纳差、恶心等[1]。临床上,对于肝源性糖尿病的治疗主要以注射胰岛素以降血糖为主。门冬胰岛素50是将天门冬氨酸替代胰岛素P链分子上的第28位的脯氨酸,能有效促进门冬胰岛素的吸收。但是,在治疗过程中患者易出现低血糖、头晕等不良反应[2]。利格列汀是在高通量筛选得到先导化合物后再进行改造获得的非拟肽类二肽基肽酶4抑制剂,属于新一代的二肽基肽酶4抑制剂,具有良好的降糖作用,且不会引起血糖水平的较大波动[3]。本研究应用胰岛素50联合利格列汀治疗肝源性糖尿病患者,观察了治疗效果及稳态模型评估胰岛素抵抗(homeostasis model assessment-insulin resistance,HOMA-IR)和基于稳态模型评估的胰岛β细胞功能指数(index of β-cell function in homeostasis model assessment,HOMA-β)的变化。
1 资料与方法
1.1 一般资料 本研究获我院医学伦理委员会批准。2017年1月~2019年12月收治的非酒精性脂肪性肝病所致的肝源性糖尿病患者98例,男性54例,女性44例;年龄为57~78岁,平均年龄为(63.47±4.62)岁。所有患者均符合《中国2型糖尿病防治指南(2013年版)》[4]和《非酒精性脂肪性肝病诊疗指南(2006年2月修订)》[5]的诊断标准。排除标准:药物性肝损伤、肝癌、肝豆状核变性;血液性疾病;肺、肾、心脏等重要器官功能障碍;合并严重的遗传性疾病;既往有精神病或认知障碍。采用随机数字表法将患者分为对照组和观察组,每组49例。两组一般资料比较均无统计学差异(P>0.05),具有可比性。
1.2 治疗方法 给予两组患者阿托伐他汀钙片(北京嘉林药业股份有限公司,国药准字H20093819)20 mg口服,1次/d。在对照组,给予门冬胰岛素50注射液(丹麦Novo Nordisk A/S,国药准字J20170032)0.4 U.kg-1,皮下注射,2次/d;在观察组,在对照组治疗的基础上给予利格列汀片(Boehringer Ingelheim Pharmaceuticals Inc,国药准字J2017108)5 mg口服,1次/d。两组均治疗观察12 w。
1.3 指标检测 使用血糖仪(SXT,三诺生物传感股份有限公司)检测空腹血糖(FBG)和餐后2 h血糖(2 h PG)水平,并应用公式计算HOMA-IR[6]和HOMA-β[7];采用胶体金法检测血糖化血红蛋白(glycosylated hemoglobin,HbA1C)水平(上海基蛋生物科技股份有限公司);使用AU5800全自动生化分析仪(美国贝克曼库尔特有限公司)及其配套试剂检测血生化指标。
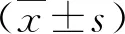
2 结果
2.1 两组糖代谢指标比较 在治疗后,观察组血清FPG、2 h PG和HbAlc水平显著低于对照组(P<0.05,表1)。

表1 两组糖代谢指标比较
2.2 两组胰岛功能指标比较 在治疗后,观察组HOMA-IR显著低于对照组,而HOMA-β水平显著高于对照组(P<0.05,表2)。
2.3 两组肝功能指标比较 在治疗后,观察组血清ALT和AST水平显著低于对照组(P<0.05,表3)。
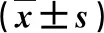
表2 两组胰岛功能指标比较
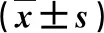
表3 两组肝功能指标比较
3 讨论
肝脏是葡萄糖代谢的重要器官,当其功能因各种肝病而受损时,往往影响正常糖代谢,甚至出现糖耐量减退或糖尿病,这种继发于慢性肝实质损害的糖尿病统称为肝源性糖尿病,是一种肝实质病变引发的糖尿病症候群的总称,常继发于慢性肝炎、酒精性肝炎、脂肪性肝病或其他慢性肝病。糖尿病的发生能增加肝硬化和肝癌发生的几率,多数患者先有肝病症状而后出现糖尿病的症状,少数亦可同时出现,有三分之一的患者可出现类似成年人糖尿病的表现,有三多症、消瘦,但很轻微,多数患者有食欲不振、厌油、腹胀、乏力、肝区不适或疼痛症状,查体可见肝病面容、肝掌、蜘蛛痣、肝缩小或肿大、脾肿大,甚至有黄疸、腹水征阳性[8]。临床研究发现[9],50%~80%慢性肝病患者有糖耐量减退,其中20%~30%最终发展为糖尿病。我国各型肝炎、肝硬化的发病率较高,因此由慢性肝炎和肝硬化引起的糖耐量减退或糖尿病并不少见。因此,及时诊断和正确治疗肝源性糖尿病的异常糖代谢对于有效地治疗各种慢性肝病、改善患者预后十分重要。目前,临床对于肝源性糖尿病的治疗仍以促进胰岛素分泌为主。门冬胰岛素50可在短时间内显著降低肝源性糖尿病患者的血糖水平[10],同时其在患者体内积蓄量较少,可显著降低患者全天高胰岛素血症,同时其速效成分比例高,能更好地控制餐后高血糖[11]。利格列汀是先在高通量筛选得到先导化合物后再进行有效关系研究并改造后得到的新一代非拟肽类的二肽基肽酶4抑制剂,是一种黄嘌呤衍生物[12],其能通过抑制高血糖素样多肽的降解,增加人体内源性多肽高血糖素样物质浓度,并能抑制胰高血糖素的合成、促进胰岛素合成,从而降低餐后血糖水平[13]。血红蛋白的半衰期为60 d。研究[14]显示,血红蛋白在高血糖环境中会逐渐糖基化,形成HbAlc。因此,HbAlc水平也是评价血糖水平的重要指标之一。本研究在治疗后,观察组FPG、2 h PG和HbAlc水平显著低于对照组,说明利格列汀联合门冬胰岛素50能显著改善肝源性糖尿病患者血糖水平,促进患者疾病好转。
肝源性糖尿病归属于2型糖尿病,但又不同于原发性2型糖尿病。有研究[15]发现,肝源性糖尿病患者HOMA-IR显著高于其它2型糖尿病患者,说明肝源性糖尿病患者胰岛素抵抗程度更重,胰高血糖素水平明显增高,胰岛β细胞受损更严重。由于肝源性糖尿病患者肝细胞功能减退,对胰岛素灭活减少,导致高胰岛素血症[16],进一步引起肝源性糖尿病患者外周组织胰岛素受体数目减少。同时,由于肝脏细胞大量受损,引起生长激素及血浆胰高血糖素、糖皮质激素等生糖激素水平下降,胰岛β细胞不能相应增加足够的胰岛素分泌,造成胰岛素抵抗,在肝源性糖尿病发病早期出现糖耐量减低[17],最终形成肝源性糖尿病[18]。因此,降低肝源性糖尿病患者胰岛素抵抗、改善胰岛β细胞功能是有效治疗肝源性糖尿病的有效途径之一。
本研究在治疗后,观察组HOMA-IR低于对照组,HOMA-β水平高于对照组,说明利格列汀能有效降低肝源性糖尿病患者的胰岛素抵抗水平,同时改善胰岛β细胞功能障碍。有研究[19]结果表明,胰岛素抵抗会引起患者血清二肽基肽酶4的活性明显增高。利格列汀可通过抑制二肽基肽酶4活性,抑制胰高血糖素样多肽的降解,维持患者机体内源性胰高血糖素样多肽水平,以葡萄糖依赖的方式促进胰岛素的分泌,减少肝糖输出。此外,利格列汀还可有效缓解β细胞功能障碍,原因在于其能通过调节肠促胰岛素效应改善胰岛素分泌。因此,能有效降低HOMA-IR,升高HOMA-β水平。此外,在病毒性肝炎、酒精性肝炎、脂肪性肝病等慢性肝脏疾病患者,由于病毒入侵、免疫功能损害、肝纤维化等原因损伤胰腺,引起机体胰岛素抵抗并对胰岛β细胞功能产生不利影响,从而引发肝源性糖尿病,而肝源性糖尿病会进一步引起肝脏损伤,促进肝脏疾病的进展,诱发肝硬化或肝癌等的发生,而在肝功能异常时,葡萄糖激酶、糖原合成酶和葡萄糖氧化限速酶活性降低,导致葡萄糖磷酸化、糖原的合成和葡萄糖的利用障碍,引起肝糖原合成减少,减弱肝脏和周围组织摄取葡萄糖和利用葡萄糖的能力,加速糖代谢紊乱。本研究在治疗后,观察组ALT和AST水平显著低于对照组,说明利格列汀能通过降低机体胰岛素抵抗、改善胰岛β细胞功能,缓解肝损伤,促进肝脏营养物质的供应,进一步改善了机体的糖代谢。
综上所述,在门冬胰岛素50的基础上联合利格列汀对肝源性糖尿病患者进行治疗,可改善胰岛β细胞功能,有效降低HOMA-IR,升高HOMA-β,从而显著改善患者的血糖水平,同时改善患者的肝功能,其疗效较好,值得在临床进一步研究。过去,肝源性糖尿病多见于肝硬化,以病毒感染为常见的病因。现在,随着NAFLD发病的增加,由NAFLD引起的肝病及其糖尿病也多起来,需要引起更多的关注。
