RASSF1A促进DLD-1细胞凋亡和线粒体自噬并抑制DLD-1细胞增殖和黏附
2021-03-13唐文如盛苗苗
胡 斐,陈 丽,马 萍,唐文如,盛苗苗
据世界卫生组织估计,全球2018 年新增结直肠癌病例19 292 789 例,在所有新增肿瘤病例数中占10%,居第3 位;死亡9 958 133 例,占肿瘤所有死亡病例的9.4%,居第2 位[1]。根据中国各地区登记的恶性肿瘤发病率和死亡率数据估计,2015 年中国新发结直肠癌约38.8 万例,在全部恶性肿瘤中居第3 位,世界人口标化发病率为17.2/10 万;2015 年结直肠癌死亡人数为18.7 万例,在全部恶性肿瘤中居第5 位,世界人口标化死亡率为8.12/10 万[2];2013 和2014 年结直肠癌的世界人口标化发病率分别为17.2/10万和17.52/10 万,世界人口标化死亡率分别为7.76/10 万和7.91/10 万。由此可见,结直肠癌的发病率和死亡率都呈上升趋势[3-4]。2000—2014年,年龄<50 岁结直肠癌患者的死亡率增加13%;但同时,由于结直肠癌早期筛查的覆盖面较广,因此年龄≥50 岁结直肠癌患者的死亡率下降了34%[3]。因此,早期筛查是结直肠癌防治的重要措施。
结直肠腺瘤可通过3 种分子机制发展成为结直肠癌,包括染色体不稳定(chromosomal instability,CIN)、微卫星不稳定(microsatellite instability,MSI)和CpG 岛甲基化表型(CpG island methylator phenotype,CIMP),分别占结直肠癌的65%~85%、12%~15%和10%~20%。根据CIMP,结直肠癌可分为高CIMP 和低CIMP。高CIMP 预示预后较差,但当存在MSI 时,高CIMP 则预示着较好的预后[4]。
Ras-结合结构域家族蛋白1A(Ras-association domain family 1A,RASSF1A)是一种抑癌基因,属于RASSF1 家族成员,参与多种生物学进程,包括微管稳定、基因组稳定性、细胞周期调控、细胞黏附和迁移以及细胞凋亡等。在多种肿瘤中,RASSF1A基因常因启动子高甲基化而沉默,而甲基化是肿瘤的高风险因素[5-6]。RASSF1A基因的甲基化率在各种肿瘤中不尽相同,在肺癌中为32%~82%,在胃癌中为4%~67%,在肝癌中为19%~100%,在乳腺癌中为49%~65%[7]。
结直肠癌中RASSF1A基因的甲基化率为12%~81%。RASSF1A 与结直肠癌相关性的Meta 分析以及肿瘤基因组图谱(The Cancer Genome Atlas,TCGA)分析结果都显 示,RASSF1A 是结直肠癌的高危因素,并且预示预后较差[8-9]。虽然RASSF1A基因甲基化与结直肠癌的关系较为密切,但RASSF1A 在结直肠癌中的抑癌机制尚待深入研究。本研究首先筛选得到RASSF1A基因甲基化的结直肠癌DLD-1 细胞,然后恢复DLD-1 细胞中RASSF1A 的表达水平,随后进一步研究其对DLD-1 细胞的增殖、凋亡、线粒体膜电位以及细胞黏附的影响。
1 材料与方法
1.1 细胞、试剂及仪器
人结直肠癌上皮细胞DLD-1 以及人结直肠腺癌细胞HCT116、SW480、HT-29 和LoVo 购自国家实验细胞资源共享服务平台(北京总部)。胎牛血清(fetal bovine serum,FBS)和RPMI 1640 培养液购自美国Gibco 公司。实验所用细胞用含10% FBS 的RPMI 1640 培养液,置于37 ℃、CO2体积分数为5%的培养箱中进行培养。
Annexin Ⅴ-FITC/ 碘化丙 啶(propidium iodide,PI)凋亡检测试剂盒(货号:556547)购自美国BD 公司,JC-1 线粒体膜电位检测试剂盒(货号:M8650)购自北京索莱宝科技有限公司,CCK-8 试剂盒(货 号:40203ES76)购自上海翊圣生物科技有限公司,DCFHDA(货 号:D6883)和TRIzol 试 剂(货 号:T9424)购自美国Sigma 公司。实时荧光定量PCR 检测试剂盒Roche SYBR Green Master(货号:4913914001)购自瑞士Roche 公司,空载体PEAK13 由本实验室自行保存,克隆试剂盒ClonExpress MultiS One Step Cloning Kit(货号:C113-01)和亚硫酸氢盐测序PCR(bisulfite sequencing PCR,BSP)扩增使用的Green Taq Mix 购自南京诺唯赞生物科技股份有限公司,转染试剂LipofectAMINETM2000(货号:11668-019)购自美国Invitrogen 公司,亚硫酸盐修饰试剂盒EZ DNA Methylation-Gold Kit(货号:D5006)购自美国Zymo Research 公司,反转录试剂(货号:A2801)购自美国Promega 公司。限制性核酸内切酶NheI(货号:1241S)购自日本TaKaRa公司,NotI 购自美 国New England Biolabs 公司(货号:R3189S)。感受态细胞T1(货号:370419)购自北京全式金生物技术有限公司,质粒提取和PCR 产物纯化试剂盒(货号:DP103-02 和DP204-02)购自天根生化科技(北京)有限公司。兔抗人RASSF1A8 多克隆抗体(货号:NHA297)购自美国Novogene 公司,鼠抗人Bcl-2 单克隆抗体(货号:610539)购自美国BD 公司,鼠抗人GAPDH(内参照)单克隆抗体(货号:SC-322333)和兔抗人Bcl-2 结合蛋白X(Bcl-2-associated X,Bax)多克隆抗体(货号:SC-493)购自美国SANTA 公司,兔抗人Yes 相关蛋白1(Yes-associated protein 1,YAP1)(货号:A1002)、磷酸化-YAP1(phospho-YAP1,p-YAP1)、p-YAP1-S397(货号:AP0922)、丝氨酸/ 苏氨酸-蛋白激酶1(serine/threonine-protein kinase 1,LATS1)(货号:A7159)和p-LATS1-S909/LATS2-S872 多克隆抗体(货号:AP0904)均购自美国ABclonal 公司,兔抗人PRKN(parkin RBR E3 ubiquitin protein ligase)多克隆抗体(货号:WL02512)购自美国Wanleibio 公司,兔抗人LC3 多克隆抗体(货号:NB100-2331)购自美国NOVUS 公司,兔抗人p62 单克隆抗体(货号:8025s)购自美国CST 公司,鼠抗人RAS 单克隆抗体(货号:610002)购自美国BD 公司,兔抗人RAF-1 多克隆抗体(货号:SC-133)购自美国SANTA 公司,鼠抗人丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)单克隆抗体(货号:4694S)、兔抗人p-MEK-S217/221(货号:0154S)、磷酸化-细胞外信号调节激酶(phospho-extracellular signalregulated kinase,p-ERK)(货号:3192S)和磷脂酰肌 醇3-激 酶(phosphoinositide 3-kinase,PI3K)单克隆抗体(货号:4249S)、兔抗人哺乳动物雷帕霉素靶体蛋白(mammalian target of rapamycin,mTOR)多克隆抗体(货号:2972S),兔抗人p-mTOR-S2448 单克隆抗体(货号:2976S)、兔抗人蛋白激酶B(protein kinase B,PKB,又称AKT)单克隆抗体(货号:3788S)、兔抗人p-AKT-T308(货号:9275S)、4EBP1(货号:9452S)、p-4EBP1(T37/46)(货号:9459S)、p-4EBP1(S65)(货号:9451S)和p-4EBP1-T70多克隆抗体(货号:9455S)均购自美国CST 公司,鼠抗人α-tubulin 和β-actin 单克隆抗体(货号:sc-69971 和sc-47778)购自美国SANTA 公司,兔抗人cofilin(货号:A1704)和CTTN(货号:A18038)多克隆抗体购自美国Abclonal 公司,兔抗人黏着斑蛋白(vinculin)多克隆抗体购自美国Sigma 公司,兔抗人β-连环蛋白(β-catenin)多克隆抗体(货号:9562S)购自美国CST 公司;辣根过氧化物酶标记的羊抗兔(货号:111-035-003)或羊抗鼠(货号:115-035-003)IgG 购自美国Jackson Immuno Research 公司。
PCR 仪(型号:2720)和实时荧光定量PCR 仪(型号7300)为美国Applied Biosystems公司产品,流式细胞仪(型号:Accuri C6)为美国BD 公司产品。
1.2 BSP 法检测结直肠癌细胞中RASSF1A 基因甲基化的情况
收集人结直肠癌上皮细胞DLD-1 以及人结直肠腺癌细胞HCT116、SW480、HT-29 和LoVo(细胞数为2×106~1×107个)共5 种细胞株,采用异丙醇沉淀法抽提细胞DNA;随后,采用EZ DNA Methylation-Gold Kit 对DNA 进行亚硫酸盐修饰,以修饰后的DNA 为模板进行PCR 扩增。上游引物序列为5’-GGTTTTATAGT TTTTGTATTTAGGTTTTTA-3’,下游引物序列为5’-CAACTCAATAAACTCAAACTCCC-3’(Green Taq 酶为北京诺禾致源科技股份有限公司产品)。PCR 扩增条件:94 ℃预变性10 min;94 ℃解链30 s,退火温 度从72 ℃开始梯度下降,每一个循环降低2 ℃,逐步将退火温度降至58 ℃,退火时间为45 s,72 ℃延伸1 min;以58 ℃为退火温度再进行35个循环。由北京擎科新业生物技术有限公司完成PCR 产物测序。
1.3 实时荧光定量PCR 法和蛋白质印迹法检测RASSF1A mRNA 在结直肠癌细胞中的表达情况
收集人 结直肠 癌DLD-1、HCT116 和HT-29 细胞株(细胞数为2×106~1×107个)。采用TRIzol 法提取细胞总RNA,并且反转录为cDNA;以cDNA 为模板(1 μL),加入5 μL 2×SYBR Green 和终浓度为0.5 μmol/L 的上下游引物,用去离子水补充反应体积至10 μL。用AB公司的7300 RT 机进行检测,程序为95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火和延伸1 min。RASSF1A基因上游引物序列为5’-CACCTG ACCTTTCTCAAG-3’,下游引物序列为5’-GA TGAAGCCTGTGTAAGAA-3’;内参照GAPDH基因上游引物序列为5’-GGTGGTCTCCTC TGACTTCAACA-3’,下游引物序列为5’-GTT GCTGTAGCCAAATTCGTTGT-3’。
1.4 构建RASSF1A 基因过表达载体
以HT-29 细胞的cDNA(cDNA 的获得同1.3 节)为模板,以携带有限制性核酸酶切NheI和NotI 序列的引物进行RASSF1A基因扩增。RASSF1A基因上游引物序列为5’-GAAGCTT GAATTCGCGCTAGCCATGTCGGGGGAGCC TGAG-3’,下游引物序列为5’-TGGGCTGGCT TACCTGCGGCCGCTTCACCCAAGGGGGCA GG-3’。DNA 扩增采用南京诺唯赞生物科技股份有限公司的Phanta® Max Super-Fidelity 试剂盒,具体PCR 扩增条件参阅试剂盒提供的操作说明。扩增获得的PCR 产物采用PCR 产物纯化试剂盒进行回收,然后用NheI 和NotI 双酶切处理载体,DNA 片段不进行酶切处理。将酶切处理后的载体和回收的PCR 产物用ClonExpress®MultiS One Step Cloning Kit 进行连接。将连接获得的重组质粒转化至感受态T1 细胞中,并进行克隆筛选。具体流程:先冰上解冻50 μL T1细胞,解冻后加入5 μL 重组质粒,冰上孵育30 min,42 ℃水浴60 s,加入500 μL 不含抗生素的LB 培养液,37 ℃低速振荡孵育2 h,然后涂抹至固体LB 培养基上,37 ℃ 16 h;挑选阳性克隆进行菌落PCR 扩增。以菌落为模板,先以5’-CA TGCTAGCCATGTCGGGGGAGCCTGAG-3’为上游引物,5’-CGCGCGGCCGCTCTCATG AATTCACCCAAGGGGGCAGG-3’为下游引物进行第1 轮筛选,得到第1 轮阳性菌落;再从 第1 轮阳性 菌落中,以5’-GCAGTGCG CGCATTGC-3’为上游引物以及5’-CGCGCG GCCGCTCTCATGAATTCACCCAAGGGGGCA GG-3’为下游引物进行第2 轮筛选,得到第2 轮阳性菌落。由北京擎科新业生物技术有限公司对第2 轮阳性菌落进行测序验证,得到序列准确的阳性克隆。挑取阳性克隆接种于LB 培养液进行扩增培养。然后,采用质粒提取试剂盒提取质粒。
1.5 CCK-8 法检测
采用CCK-8 法检测RASSF1A基因过表达对DLD-1 细胞增殖的影响。先将DLD-1 细胞以5 000 个/孔的密度接种于96 孔板中,待12 h 细胞贴壁后用,采用LipofectAMINETM2000 进行瞬时转染,将RASSF1A基因过表达重组质粒转入DLD-1细胞,以细胞中只加入转染试剂作为对照组。分别于24、48 和72 h 时加入CCK-8 试剂,37 ℃孵育30 min 后,在酶联免疫检测仪波长450 nm 处检测各孔的D值。
1.6 细胞凋亡的检测
采用FCM 法检测RASSF1A基因过表达对DLD-1 细胞凋亡的影响。将DLD-1 细胞以1.75×105个的细胞数接种于6 孔板中,待12 h 细胞贴壁后,采用LipofectAMINETM2000 进行瞬时转染,实验分组同1.5 节。待细胞转染24、48 和72 h 后收集细胞,用Annexin V-FITC/PI 染色后检测各组细胞的凋亡率,实验流程参阅说明书。
1.7 活性氧(reactive oxygen species,ROS)检测
DCFH-DA 用DMSO 配制成10 nmol/L 的母液。细胞的处理及分组同1.5 节。同时,设置加入H2O2处理的阳性对照组[即在细胞培养48 h 后向阳性对照组中加入2% 的H2O2(以1 ∶1 000 的体积比进行稀释),37 ℃处理30 min]。各组细胞培养48 h 后,更换为无血清培养液,同时以1 ∶1 000 的体积比进行稀释后加入DCFH-DA,37 ℃孵育30 min。用胰蛋白酶消化后收集细胞,再用PBS 重悬细胞,上流式细胞仪检测ROS 含量。
1.8 膜电位检测
将DLD-1 细胞(1.75×105个)接种于6 孔板中,待12 h 细胞贴壁后,用Lipofect AMINETM2000 进行转染,细胞的处理及分组同1.5 节。转染48 h 后收集细胞,采用JC-1 试剂盒进行膜电位检测,检测流程参阅说明书。
1.9 蛋白质印迹法检测
DLD-1 细胞(1.75×105个/孔)接种于6 孔板 中,待12 h 细胞贴壁后,用Lipofect AMINETM2000 进行瞬时转染,分别于24、48 和72 h 时收集细胞。用RIPA 蛋白裂解液提取细胞蛋白,BCA 法检测蛋白浓度,随后按20 μg/孔的上样量行SDS-PAGE 分离蛋白(分离胶浓度为4%~20%梯度),将分离后的蛋白采用湿转法以180 mA 的电流3 h 转移至PVDF膜上,用含5%脱脂牛奶的封闭液室温条件下封闭处理1 h;用TBST 洗膜,每次5 min 重复3次;用含2%牛血清蛋白(bovine serum albumin,BSA)的TBS 稀释一抗(体积稀释比例均为1 ∶1 000)后,滴加于膜上4 ℃孵育过夜。再用TBST洗膜,每次5 min 重复3 次;加入二抗(辣根过氧化物酶标记的羊抗兔或羊抗鼠IgG),二抗与TBST 的体积稀释比例均为1 ∶1 000,室温孵育2 h;用TBST 洗膜,每次10 min 重复3 次。最后加入电化学发光试剂于膜上,采用Tanon 化学发光/荧光图像分析系统进行拍照。

Fig.1 The methylation of Ras-association domain family 1A (RASSF1A) promoter in DLD-1,HCT116,HT-29,LoVo and SW480 cells was detected by bisulfite sequencing PCR (BSP).图1 BSP 法检测5 种结直肠癌细胞株(DLD-1、HCT116、HT-29、LoVo 和SW480)中RASSF1A 基因启动子区的甲基化情况
所用一抗为兔抗人RASSF1A8、Bax、YAP1、p-YAP1、p-YAP1-S397、LATS1、p-LATS1-S909/LATS2-S872、PRKN、LC3 和RAF-1 多克隆抗体,鼠抗人Bcl-2、RAS 和GAPDH(内参照)单克隆抗体,兔抗人p62 单克隆抗体,鼠抗人MEK单克隆抗体,兔抗人p-MEK-S217/221、p-ERK和p-PI3K 单克隆抗体,兔抗人mTOR 多克隆抗体、兔抗人p-mTOR-S2448 单克隆抗体、兔抗人AKT 单克隆抗体及兔抗人p-AKT-T308 多克隆抗体,兔抗人4EBP1、p-4EBP1(T37/46)、p-4EBP1(S65)和p-4EBP1-T70 多克隆抗体,鼠抗人α-tubulin 和β-actin 单克隆抗体,兔抗人cofilin、CTTN、vinculin 和β-catenin 多克隆抗体。显影液使用Tanon(货号:180-501)。
1.10 统计学方法
应用Graph Pad Prism 7 软件对所有的实验结果进行统计学分析。所有的实验均独立重复3 次,计量资料以表示。各组间比较采用单因素方差分析,组内两两比较采用Tukey-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 DLD-1 细胞中RASSF1A 基因启动子区甲基化可导致表达沉默
首先采用BSP 方法检测结直肠癌DLD-1、HCT116、HT-29、LoVo 和SW480 细胞中RASSF1A基因的甲基化水平。结果(图1)显示,只有DLD-1 细胞中RASSF1A基因启动子区发生甲基化。
为了验证启动子区甲基化对RASSF1A基因转录的影响,本研究检测了DLD-1、HCT116 和HT-29 细胞中RASSF1A mRNA 的表达水平。结果(图2)显示,与HCT116 和HT-29 细胞相比,DLD-1 细胞中几乎检测不到RASSF1A mRNA的表达。
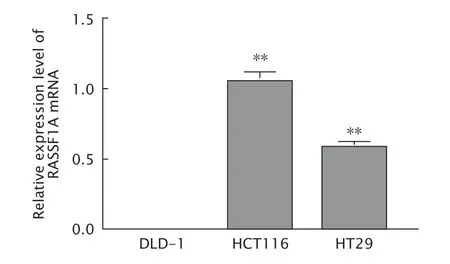
Fig.2 The expressions level of Ras-association domain family 1A (RASSF1A) mRNA in DLD-1,HCT116 and HT-29 cells was detected by real-time fluorescent quantitative PCR.**P<0.01,vs DLD-1 cells (n=3).图2 实时荧光定量PCR 法检测3 种结直肠癌细胞株(DLD-1、HCT116 和HT-29)中RASSF1A mRNA 的表达水平

Fig.3 The expression level of Ras-association domain family 1 A (RASSF1A) protein in DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A for 4,8,12,24 and 48 h was detected by Western blotting.DLD-1 cells were treated with only LipofectAMINETM 2000 as the control.图3 蛋白质印迹法检测转入RASSF1A 基因过表达重组质粒(pEAK13-RASSF1A)不同时间后对DLD-1 细胞中RASSF1A 蛋白表达水平的影响
随后构建了RASSF1A 过表达载体,并转入DLD-1 细胞。蛋白质印迹法检测结果(图3)显示,与对照组相比,转染RASSF1A 过表达载体8 h 后,DLD-1 细胞开始表达RASSF1A 蛋白。
2.2 RASSF1A 基因过表达促进DLD-1 细胞凋亡
为验证RASSF1A 是否参与了DLD-1 细胞的凋亡进程,本研究将RASSF1A 过表达载体转入DLD-1 细胞中以恢复其表达。在重组质粒PEAK13-RASSF1A 转 染24、48 和72 h 时,采用FCM 法检测细胞凋亡率。结果显示(图4)显示,相较于对照组,RASSF1A 过表达组在24、48 和72 h 时的DLD-1 细胞凋亡率明显提高(P均<0.05)。
进一步采用蛋白质印迹法检测了凋亡相关蛋白Bcl-2、Bax 和聚二磷酸腺苷核糖聚合酶(poly ADP-ribose polymeras,PARP)的表达水平。结果(图5A)显示,相较于对照组,24、48 和72 h时RASSF1A 过表达组中Bcl-2 和Bax 蛋白的表达量明显下调(P均<0.001),并出现剪切型-PARP的表达(P<0.05),进一步验证了RASSF1A 对DLD-1 细胞的促凋亡作用。
同时,本研究还进一步检测了与凋亡相关MST/LATS/YAP 通路。结果显示(图5B),72 h时LATS1(P<0.05)和YAP1(P<0.001)蛋白及其磷酸化p-LATS1(P<0.001)和p-YAP1蛋白(P<0.001)的表达水平均明显下调。这一结果提示YAP1 功能的下调,提示RASSF1A 也可通过此通路促进凋亡的发生。
2.3 RASSF1A 过表达促进DLD-1 细胞线粒体自噬
虽然本研究中观察到RASSF1A 过表达可促进DLD-1 细胞凋亡,但同时也观察到Bax 表达水平下调(图5A)。通过查找相关文献[10]发现,环-环间-环PRKN 能够使Bax 定位于线粒体膜上,并使其降解。PRKN 还可通过促进线粒体蛋白TOMM20、RHOT1/MIRO1 和USP30 的泛素化而促进功能失调的膜电位降低的线粒体自噬。因此,本研究使用携带有RASSF1A基因的重组质粒转染DLD-1 细胞48 h 后,采用DCFH-DA探针检测DLD-1 细胞中的ROS 水平,并使用JC-1 探针检测细胞的线粒体膜电位水平。
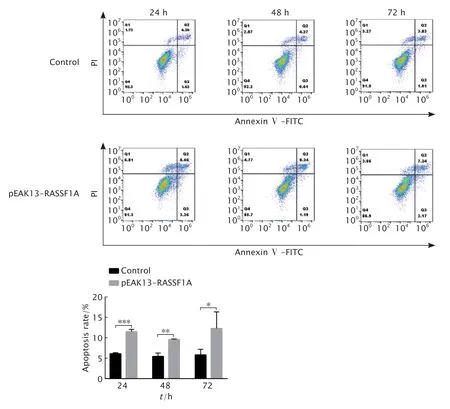
Fig.4 The effect of Ras-association domain family 1A (RASSF1A) overexpression on apoptosis of DLD-1 cells was detected by FCM method.pEAK13-RASSF1 group: DLD-1 cells were transfected with recombinant plasmid pEAK13-RASSF1A;Control group: DLD-1 cells were treated with LipofectAMINETM2000 alone.*P<0.05,**P<0.01,***P<0.001 (n=3).图4 FCM 法检测RASSF1A 过表达对DLD-1 细胞凋亡的影响
DCFH-DA 染色法检测结果(图6)显示,在H2O2刺激下,细胞内ROS 含量明显增多;与对照组相比,在H2O2的刺激下,DCFH-DA 荧光带右移(P<0.001),但RASSF1A 过表达组未发现DCFH-DA 荧光带明显右移(P<0.05),由此说明DLD-1 细胞中ROS 水平未发生变化。
JC-1 染色法检测结果(图7)显示,DLD-1细胞过表达RASSF1A 后,JC-1 的绿色荧光强度增强(P<0.05),说明细胞的线粒体膜电位下降。
蛋白质印迹法检测结果(图8)显示,转入RASSF1A 48 h 时,线粒体自噬蛋白PRKN 表达水平即上调(P<0.05)。检测DLD-1 细胞的自噬水平,发现24 h 时LC3-Ⅱ的表达水平明显上调(P<0.05),而p62 蛋白表达水平明显下调(P<0.01)。
2.4 RASSF1A 过表达抑制DLD-1 细胞增殖
鉴于RASSF1A 可促进DLD-1 细胞凋亡,本研究又检测了其对DLD-1 细胞增殖的影响。使用CCK-8 试剂盒检测RASSF1A 转染至DLD-1 后24、48 和72 h 时的细胞增殖情况。结果(图9)显示,从48 h 开始,RASSF1A 可明显抑制DLD-1 细胞的增殖(P<0.01)。
由于RASSF1A 是RAS 结合结构域蛋白家族成员,因此检测RAS/RAF 通路相关蛋白的表达情况。结果(图10)显示,在转染RASSF1A 后,RAS和RAF的表达水平均明显下调(P均<0.001)。随后,又检测了与增殖相关的PI3K/mTOR 通路相关蛋白的表达情况,结果(图11)显示从48 h 开始,PI3K 和p-PI3K 及其下游mTOR 和p-mTOR 的表达水平均明显下调(P均<0.01)。

Fig.5 The expression levels of apoptosis-related proteins Bcl-2,Bcl-2-associated X (Bax),poly ADPribose polymeras (PARP) and cleaved-PARP (A) as well as MST/LATS/YAP pathway-related proteins Yesassociated protein 1 (YAP1),phospho-YAP1 (p-YAP1),serine/threonine-protein kinase 1 (LATS1) and p-LATS1 (B) in DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A were detected by Western blotting.DLD-1 cells were treated with LipofectAMINETM 2000 alone as the control.*P<0.05,**P<0.01,***P<0.001,vs the control group (n=3).图5 蛋白质印迹法检测转入RASSF1A 基因过表达重组质粒(pEAK13-RASSF1A)不同时间后对DLD-1 细胞中凋亡相关蛋白(A)以及MST/LATS/YAP 信号通路中相关蛋白(B)表达水平的影响

Fig.6 The reactive oxygen species (ROS) level in DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A was detected by DCFH-DA method.DLD-1 cells were treated with LipofectAMINETM 2000 alone as the control;DLD-1 cells were treated with H2O2 as the positive control.***P<0.001 (n=3).图6 采用DCFH-DA 染色法检测RASSF1A 基因过表达对DLD-1 细胞中ROS 水平的影响
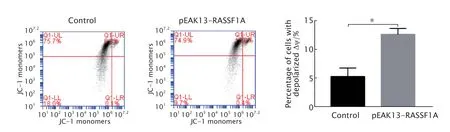
Fig.7 The mitochondrial membrane potential of DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A was detected by JC-1 method.DLD-1 cells were treated with only LipofectAMINETM 2000 as the control.*P<0.05 (n=3).图7 JC-1 探针法检测RASSF1A 基因过表达对DLD-1 细胞线粒体膜电位的影响
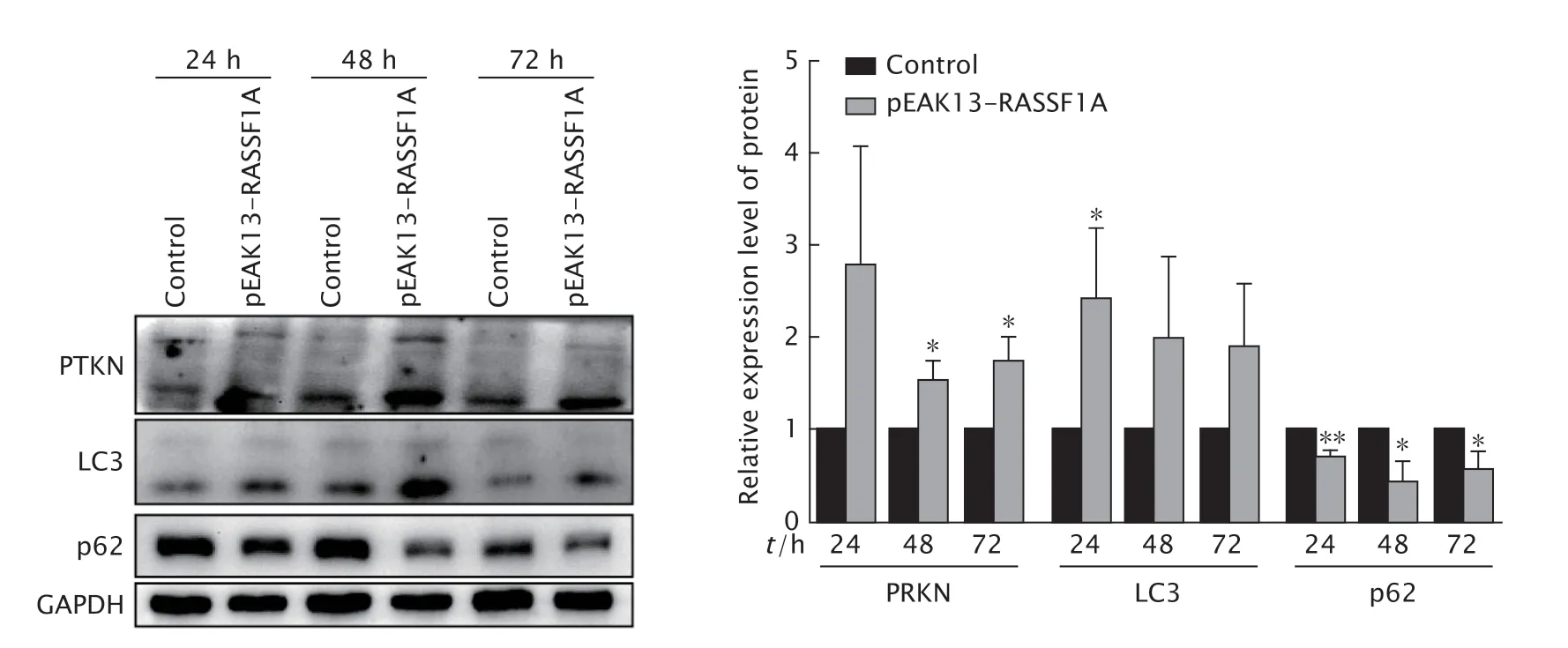
Fig.8 The expression levels of autophagy-related proteins PRKN,LC3 and p62 in DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A for 24,48 and 72 h were detected by Western blotting.DLD-1 cells were treated with LipofectAMINETM 2000 alone as the control.*P<0.05,**P<0.01,vs the control group(n=3).图8 蛋白质印迹法检测转入RASSF1A 基因过表达重组质粒(pEAK13-RASSF1A)后不同时间对DLD-1 细胞线粒体膜自噬相关蛋白表达水平的影响

Fig.9 The cell viabilities of DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A for 24,48 and 72 h were detected by CCK-8 method.DLD-1 cells were treated with LipofectAMINETM2000 alone as the control.**P<0.01,***P<0.01 (n=3).图9 CCK-8 法检测转入RASSF1A 基因过表达重组质粒(pEAK13-RASSF1A)不同时间后对DLD-1细胞增殖的影响
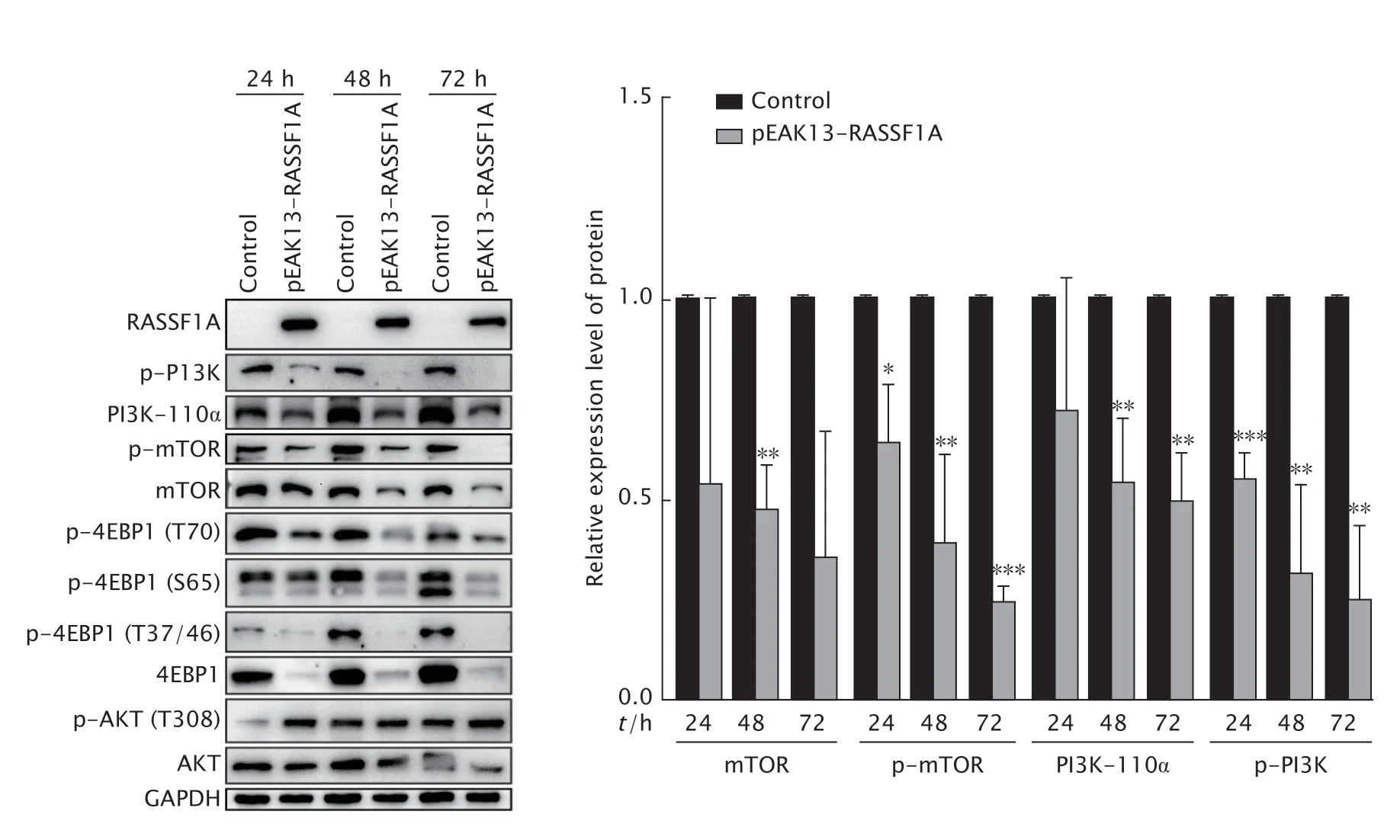
Fig.11 The expression levels of Ras/Raf pathway-related proteins phosphoinositide 3-kinase (PI3K),phospho-PI3K (p-PI3K),mammalian target of rapamycin (mTOR),p-mTOR,4EBP1,p-4EBP1,protein kinase B (PKB,also known as AKT) and p-AKT in DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A for 24,48 and 72 h were detected by Western blotting.DLD-1 cells were treated with LipofectAMINETM2000 alone as the control.*P<0.05,**P<0.01,***P<0.001,vs the control group (n=3).图11 蛋白质印迹法检测转入RASSF1A 基因过表达重组质粒(pEAK13-RASSF1A)不同时间后PI3K/mTOR 通路相关蛋白的表达情况
2.5 RASSF1A 过表达抑制DLD-1 细胞的黏附能力
蛋白质印迹法检测结果(图12A)显示,转入pEAK13-RASSF1A 48 h 后,DLD-1 细胞中β-actin 蛋白的表达水平下调(P<0.01)。通过检索文献[11]发现,β-actin 可能参与细胞的黏附过程。
随后,本研究检测了细胞黏附附相关蛋白,结果(图12B)显示转入pEAK13-RASSF1A72h后,细胞黏附相关蛋白β-catenin、vinculin 和CTTN 的表达水平均明显下调(P均<0.01)。这一结果表明,RASSF1A 可抑制黏附相关蛋白的表达。
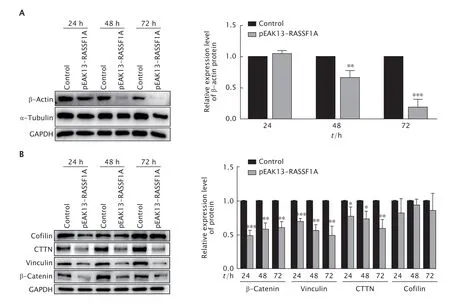
Fig.12 The expression levels of β-actin (A),adhesion protein cofilin,CTTN,vinculin and β-catenin (B)in DLD-1 cells transfected with recombinant plasmid pEAK13-RASSF1A for 24,48 and 72 h were detected by Western blotting.DLD-1 cells were treated with LipofectAMINETM2000 alone as the control.*P<0.05,**P<0.01,***P<0.001,vs the control group (n=3).图12 蛋白质印迹法检测转入RASSF1A 基因过表达重组质粒(pEAK13-RASSF1A)后不同时间对β-actin(A)和细胞黏附相关蛋白(B)表达水平的影响
3 讨论
本研究首先从结直肠癌细胞中筛选出RASSF1A基因启动子甲基化的DLD-1 细胞,随后将构建的RASSF1A 过表达载体转入DLD-1细胞中,使其恢复RASSF1A 的表达,并且从细胞凋亡、增殖、黏附和线粒体自噬等多个方面检测恢复RASSF1A 表达对DLD-1 细胞的影响。研究结果显示,RASSF1A 能够通过抑制YAP 和Bcl-2 通路而促进DLD-1 细胞的凋亡;同时,能够通过上调PRKN 表达水平促进线粒体自噬。此外,RASSF1A 还能够抑制PI3K/mTOR 和RAS/RAF-1 通路,从而抑制结直肠癌细胞DLD-1 的增殖,并且通过下调细胞黏附相关蛋白β-catenin和vinculin 等的表达而降低细胞的黏附能力。
一般认为,RASSF1A 能够通过磷酸化激活MST1/2,而MST1/2 磷酸后可进一步激活LATS1/2,激活的LATS1/2 可使下游的YAP1 磷酸化,从而阻止YAP 入核行使促癌功能,继而引发细胞凋亡。本研究发现,MST/LATS/YAP 通路中YAP 及其磷酸化蛋白的表达水平均有所下降,说明RASSF1A 在DLD-1 细胞中可能并非通过MST/LATS/YAP 通路来影响YAP1 的功能,而是通过其他机制抑制YAP1 的促癌功能。此外,对于YAP1 究竟发挥抑癌还是促癌作用,尚存在一定的分歧。YAP 在结直肠癌中既发挥促癌作用,又发挥抑癌作用[12]。除YAP 通路以外,本研究还从Bcl-2 和Bax 蛋白水平检测了细胞凋亡的发生情况。同时,本研究还观察到RASSF1A 可使DLD-1 细胞中线粒体自噬增加而引起膜电位改变,提示RASSF1A 还可能通过线粒体自噬促进细胞凋亡。
一些细胞黏附分子的高表达能够促进上皮-间质转 化(epithelial-mesenchymal transitions,EMT)的发生,使细胞的运动性和侵袭性增加,促进肿瘤发生,并且EMT 被认为是驱动肿瘤发生和转移的主要因素[13]。β-catenin 作为E-cadherin/catenin 复合物的成分,可能参与了细胞黏附性的调控,由此推测RASSF1A 也可能通过下调β-catenin 而进一步下调E-cadherin 的表达水平,从而在一定程度上抑制EMT 的发生。CTTN(cortactin)除了参与对β-actin 和细胞形态的调控以外,还能够促进癌细胞的侵袭和转移[14]。由此推测,RASSF1A 可能通过下调CTTN 的表达水平,抑制DLD-1 细胞的侵袭和转移能力,这为今后的研究提供了新的方向。本研究还通过蛋白质印迹法检测了LC3-Ⅱ的表达情况,从细胞水平验证自噬的发生,并且在细胞水平对细胞黏附进行了验证。
总之,RASSF1A 可以通过促进DLD-1 细胞的凋亡和线粒体自噬以及抑制细胞的增殖和黏附而发挥抑癌作用。今后有待开展进一步研究,更深入地探讨RASSF1A 在结直肠癌中的作用机制。
