沉默甲基转移酶样7B基因表达抑制肾母细胞瘤细胞的增殖、侵袭和迁移
2021-03-13王仲秋李承学郝希伟
王仲秋,耿 莉,李承学,郝希伟
肾母细胞瘤是儿童常见的恶性肿瘤之一,占所有儿童肾脏肿瘤的95%,其发病率约为1/10 万人[1]。临床上,约10%的肾母细胞瘤患者会发生转移或在术后出现复发,预后较差[1]。深入分析肾母细胞瘤的发生和发展机制,对指导临床诊疗具有重要的意义。甲基化转移酶与肾母细胞瘤密切相关,其基因多态性可能影响疾病易感性[2]。甲基转移酶样7B(methyltransferase-like 7B,METTL7B)是甲基转移酶样家族成员之一,其基因位于人类12 号染色体上,编码的蛋白广泛表达于人体各组织。既往研究发现,METTL7B与胶质瘤、甲状腺癌、乳腺癌和非小细胞肺癌的发生和发展有关[3-6]。既往鲜见METTL7B 与肾母细胞瘤相关的研究报道,因此本研究首先检测了肾母细胞瘤组织中METTL7B 的表达情况,并且分析了METTL7B 表达与临床病理特征和预后的关系,随后采用小RNA 干扰技术靶向沉默METTL7B基因,同时探讨其对肾母细胞瘤细胞生物学行为的影响。
1 材料与方法
1.1 细胞、试剂和仪器
人肾母细胞瘤SK-NEP-1 细胞和正常肾上皮细胞系(PCS-400-010、PCS-400-011 和PCS-400-012)均购于中国科学院上海生命科学研究院细胞资源中心。用含10%胎牛血清的DMEM 培养液,置于37 ℃、CO2体积分数为5%的培养箱中进行培养,每3 d 换液1 次,当SK-NEP-1 细胞融合度达80%时进行传代。
DMEM 培养液、胎牛血清、Tris/EDTA 修复液和SP 免疫组织化学检测试剂盒购自上海语纯生物科技有限公司。脂质体转染试剂LipoFiterTM购自美国Sigam 公司。兔抗人METTL7B 和GAPDH(内参照)单克隆抗体以及辣根过氧化物酶标记的羊抗兔IgG 购自英国Abcam 公司;反转录试剂盒、2×SYBR Green PCR Mastermix 试剂盒、BCA 蛋白定量检测试剂盒、SDS-PAGE 凝胶快速制备试剂盒、CCK-8 试剂盒、Transwell 小室和异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的Annexin Ⅴ(Annexin Ⅴ-FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒均购自生工生物工程(上海)股份有限公司。siMETTL7B 和阴性对照(negative control,NC)siRAN(siNC)均购自上海吉玛制药技术有限公司。
组织冷冻切片机(BL-800 W 型)和流式细胞仪(LSR Ⅱ型)为美国BD 公司产品,实时荧光定量PCR 仪(ABI7500 型)为美国赛默飞公司产品,化学发光成像分析系统(ChemiDoc XRS 型)为美国Bio-Rad 公司产品,光学显微镜(CX33 型)为日本奥林巴斯公司产品。
1.2 组织样本
以2008 年1 月—2013 年6 月山东第一医科大学附属济南人民医院儿科收治的72 例肾母细胞瘤患者为研究对象,其中男性29 例、女性43例;平均年龄为(3.62±1.03)岁(范围:10 月龄~12 岁);美国儿童肿瘤协作组(Children’s Oncology Group,COG)分期为I~Ⅱ期者40例,Ⅲ~Ⅴ期者32 例;病理分型为预后良好型(favorable histology,FH)者38 例,预后不良型(unfavorable histology,UFH)者34 例。所有患者均接受手术联合放化疗的综合治疗方法,并经术后病理确诊。将手术切除的肾母细胞瘤组织及其配对的癌旁正常肾组织(距离肿瘤组织边缘>5 cm)制作成石蜡标本,切片厚度为4 μm。
1.3 随访
术后对所有患者进行门诊和电话随访,记录生存情况。术后第1~2 年,每3 个月复查1 次;术后第3 年,每4 个月复查1 次;术后第4 年,每6 个月复查1 次;术后第5 年及以后,每年复查1 次。随访截止日期为2019 年6 月30 日。
1.4 免疫组织化学法检测METTL7B 的表达情况
取肾母细胞瘤组织及其配对的癌旁正常肾组织石蜡切片,70 ℃烤片30 min,常规脱蜡处理。用Tris/EDTA 修复液进行抗原修复,随后用含羊血清的封闭液封闭处理30 min;加入兔抗人METTL7B 单克隆抗体(体积稀释比例为1 ∶500),4 ℃孵育过夜;随后加入二抗和链霉素-卵白素工作液,37 ℃孵育30 min;最后用DAB 显色,并进行苏木精复染。经过脱水、透明和封片处理等步骤后,在光学显微镜下观察细胞染色情况。每一张切片随机选取10 个视野,每一个视野计数100 个细胞,根据细胞的染色强度及阳性细胞所占百分比判断METTL7B 蛋白的表达情况。染色强度评分:阴性为0 分、浅黄色为1 分、棕黄色为2 分、棕褐色为3 分;阳性细胞所占百分比评 分:0%~10% 为1 分、11%~50% 为2 分、51%~80%为3 分、81%~100%为4 分;将染色强度评分与阳性细胞所占百分比评分相乘,0~3 分代表低表达,4~12 分代表高表达[7]。
1.5 蛋白质印迹法检测细胞中METTL7B 蛋白的表达水平
取对数生长期的各组细胞(SK-NEP-1、PCS-400-010、PCS-400-011 和PCS-400-012),加入蛋白裂解液,冰上裂解25 min,12 000×g离心15 min 后收集上清液;用BCA 试剂盒检测蛋白浓度。取适量蛋白行10% SDS-PAGE 分离蛋白,并将分离后的蛋白转移至PVDF 膜上,用封闭液封闭处理1 h;加入一抗[兔抗人METTL7B单克隆抗体(体积稀释比例为1 ∶500)和兔抗人GAPDH 单克隆抗体(体积稀释比例为1 ∶1 000)],4 ℃孵育过夜。用TBST 洗膜3 次,随后加入二抗[辣根过氧化物酶标记的羊抗兔IgG(体积稀释比例为1 ∶500)],温室孵育2 h,再用TBST 洗膜3 次。最后加入电化学发光剂显影成像,用Image J 软件分析蛋白条带的灰度值。以目的蛋白条带灰度值与内参照蛋白条带灰度值的比值表示目的蛋白的相对表达量。
1.6 细胞转染
SK-NEP-1 细胞培养至融合度为80%时,除去培养液,用PBS 洗涤细胞2 次。加入1 mL胰蛋白酶消化处理1 min 后加入2 mL DMEM培养液,将细胞吹打成细胞悬液,以5×102个/mL 的密度将细胞接种至6 孔板中,置于37 ℃、CO2体积分数为5% 的条件下培养24 h;用无血清培养液分别稀释LipoFiter 和siMETTL7B(或siNC)后将2 者混匀,静置5 min;将混合物加入6 孔培养板中进行转染,6 h 后进行后续实验,具体流程参数参阅试剂盒提供的操作说明。siMETTL7B 正义链序列为5’-AUUAGAUCCAUAGUCAUACGG-3’,反义链序列为5’-GUAUGACUAUGGAUCUA AUUC-3’;siNC 正义链序列为5’-GAUGAUUC CUUCAGGGUUA-3’,反义链序列为5’-GCA CAAACCCAGGCUAUUU-3’。
1.7 实时荧光定量PCR 检测METTL7B 基因的沉默效率
采用TRIzol 法提取细胞中的总RNA,通过反转录获取cDNA,随后用实时荧光定量试剂盒进行PCR 扩增。PCR 扩增条件为95 ℃30 min;94 ℃ 15 s、55 ℃ 30 s、70 ℃ 30 s,共40 个循环。操作步骤严格按照试剂盒说明书进行,用2-△△Ct法计算METTL7B mRNA 相对表达量。METTL7B基因上游引物序列为3’-C GAGCTGAGTGCGTCCTGTC-5’,下游引 物序列为3’-TCGCTGGCCGTGAGTCTGT--5’;GAPDH基因(内参照)上游引物序列为5’-CTAC AATGAGCTGCGTGTGGC-3’,下游引物序列为5’-CAGGTCCAGACGCAGGATGGC-3’。
1.8 克隆形成实验和CCK-8 法检测细胞的增殖活力
克隆形成实验:使用胰蛋白酶消化转染后的SK-NEP-1 细胞,收集细胞接种于6 孔板中(3×103个/孔),置于37 ℃、CO2体积分数为5%的条件下培养3 周;当出现菌落时,停止培养[8];使用4%多聚甲醛溶液固定SK-NEP-1 细胞,30 min 后用结晶紫染色;将平皿倒置并叠加一张带网格的透明胶片,光学显微镜下计数>50 个细胞的克隆数。
CCK-8 实验:使用CCK-8 试剂盒检测SKNEP-1 细胞增殖活性;细胞培养24、48 和72 h时,向每一个培养孔中避光加入5 μL CCK-8 溶液,培养2 h,用酶标仪(490 nm 波长)读取吸光度值[9]。实验重复3 次。
1.9 FCM 法检测细胞凋亡情况
取对数生长期的SK-NEP-1 细胞,制成1×106个/mL 的细胞悬液,随后加 入5 μL FITC-Annexin Ⅴ,混匀后再加入5 μL PI,温室下避光孵育10 min 后,使用FACSCanto Ⅱ型流式细胞仪检测细胞凋亡率。实验重复3 次。
1.10 Transwell 小室实验检测细胞的侵袭能力
在Transwell 小室的上室膜上铺设matrigel,随后将细胞接种于Transwell 小室的上室中(1×103个/孔);下室中加入细胞培养液。培养48 h 后取出Transwell 小室,用棉签擦拭除去未穿过小室膜的细胞,使用多聚甲醛溶液固定黏附于下室微孔膜下面的SK-NEP-1 细胞,用结晶紫染色15 min,待干燥后,在光学显微镜(放大倍数为100 倍)下选取5 个视野,观察染色细胞的形态并计数。
1.11 细胞划痕实验检测细胞的迁移能力
取对数生长期的SK-NEP-1 细胞接种于细胞培养板中,待SK-NEP-1 细胞融合度达80%时,用无菌枪头进行划痕。分别于0 和24 h 时,在光学显微镜下测量划痕宽度并拍照。划痕愈合率(%)=(0 h 划痕宽度-24 h 划痕宽度)/0 h 划痕宽度×100%[10]。实验重复3 次。
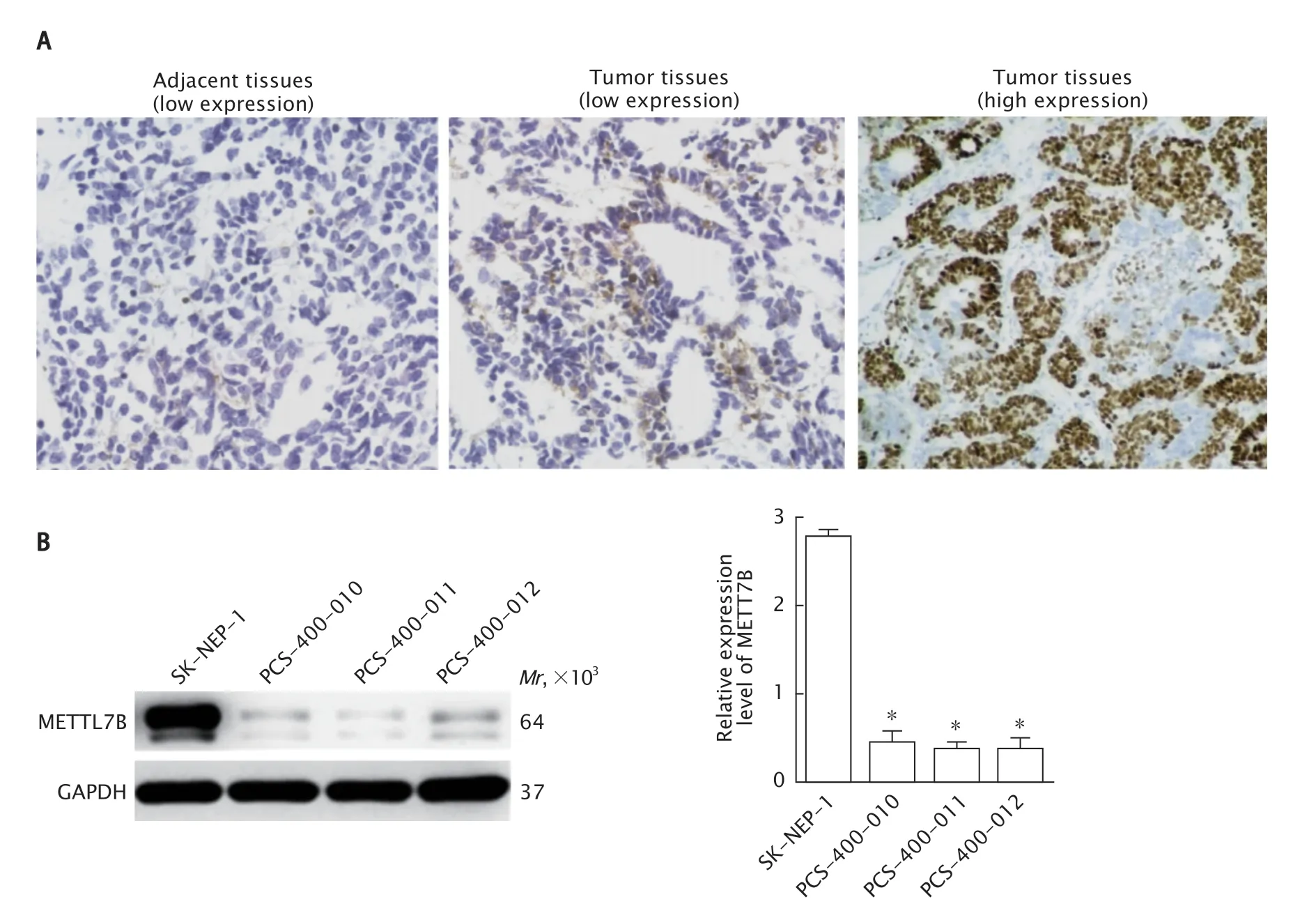
Fig.1 The expression levels of methyltransferase-like 7B (METTL7B) protein in nephroblastoma tissues and their normal adjacent kidney tissues (A) and nephroblastoma SK-NEP-1 cells and normal renal epithelial cells (PCS-400-010,PCS-400-011 and PCS-400-012) (B) were detected by immunohistochemistry(DAB staining,×200) and Western blotting,respectively. *P<0.05,vs SK-NEP-1 cells.图1 分别采用免疫组织化学法和蛋白质印迹法检测METTL7B 蛋白在肾母细胞瘤组织及其癌旁正常肾组织(A)和肾母细胞瘤细胞(B)中的表达水平
1.12 统计学方法
应用SPSS 20.0 软件对所有的实验数据进行统计学分析。组间计量资料比较采用t检验,计数资料比较采用χ2检验;多组间比较采用单因素方差分析(组内比较采用LSD-t检验);生存分析采用Kaplan-Meier 法,预后相关因素的单因素和多因素分析采用COX风险比例模型。P<0.05 为差异有统计学意义。
1.13 伦理学
本研究通过山东第一医科大学附属济南人民医院伦理委员会批准。患者及其家属均签署知情同意书。
2 结果
2.1 METTL7B 在肾母细胞瘤组织和细胞中的表达
免疫组织化学法检测结果(图1A)显示,METTL7B 阳性染色可见于细胞核和细胞质中。肾母细胞瘤组织中METTL7B 高表达,阳性表达率为68.06%(49/72),高于癌旁正常肾组织的16.67%(12/72)(χ2=38.937,P<0.001)。
蛋白质印迹法检测结果(图1B)显示,SK-NEP-1 细胞中METTL7B 蛋白的表达量为2.78±0.12,明显高于PCS-400-010 细胞的0.45±0.23、PCS-400-011 细胞中 的0.37±0.14以及PCS-400-012 细胞的0.38±0.24 细胞(F=39.090,P<0.001)。
2.2 METTL7B 与肾母细胞瘤患者临床病理特征和预后的关系
统计分析结果(表1)显示,METTL7B 与COG 分期有关(P<0.05),而与患者的性别、年龄、肿瘤部位、肿瘤直径和病理分型均无关(P均>0.05)。

表1 METTL7B 表达与肾母细胞瘤患者临床病理特征的关系Table 1 Relationship between methyltransferase-like 7B (METTL7B) expression and clinicopathological features of patients with nephroblastoma(N =72,n)
COX单因素和多因素分析结果(表2)显示,COG 分期为Ⅲ~Ⅳ期、病理分型为UFH 型和METTL7B 高表达是肾母细胞瘤不良预后的独立影响因素(P<0.05)。
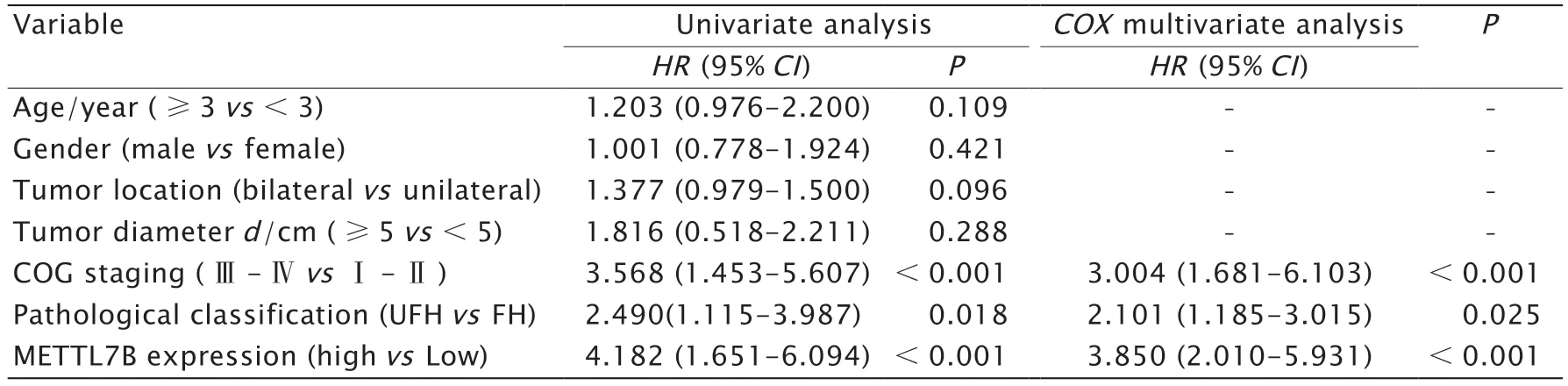
表2 肾母细胞瘤患者预后的单因素和COX 多因素分析Table 2 Univariate and COX multivariate analyses of prognosis of patients with nephroblastoma
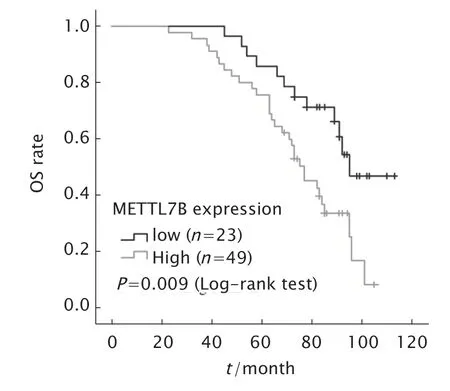
Fig.2 Kaplan Meier method was used to analyze the correlation between methyltransferase-like 7B(METTL7B) expression and overall survival (OS) of patients with nephroblastoma.图2 Kaplan-Meier 法分析METTL7B 表达与肾母细胞瘤患者生存的相关性
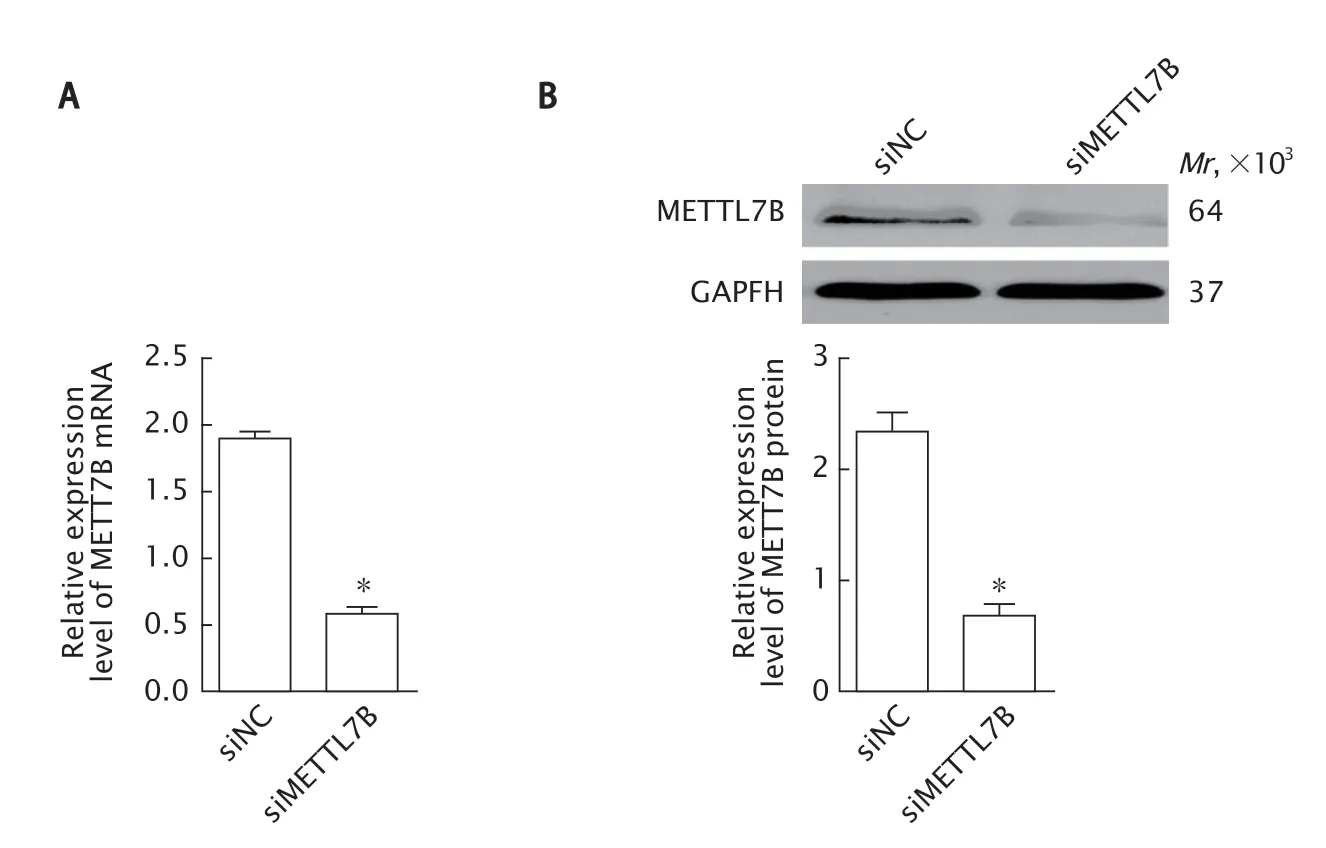
Fig.3 The expression levels of methyltransferase-like 7B (METTL7B) mRNA (A) and protein (B) in SK-NEP-1 cells transfected with siMETTL7B targeting METTL7B gene were detected by real-time fluorescence quantitative PCR and Western blotting,respectively.SK-NEP-1 cells were transfected with siRNA negative control (NC) (siNC) as the control.*P<0.05,vs siNC group (n=3).图3 分别采用实时荧光定量PCR 法和蛋白质印迹法检测SK-NEP-1 细胞中METTL7B mRNA(A)和蛋白(B)的表达水平
Kaplan-Meier 生存曲线分析结果(图2)显示,METTL7B 高表达患者的生存时间短于METTL7B 低表达的患者(P<0.05)。
2.3 沉默METTL7B 基因表达对SK-NEP-1 细胞增殖、凋亡、侵袭和迁移的影响
实时荧光定量PCR 检测结果(图3A)显示,在SK-NEP-1 细胞中,siNC 组和siMETTL7B组的METTL7B mRNA 表达量分别为1.89±0.11和0.57±0.12;与siNC 组相比,siMETTL7B组METTL7B mRNA 的表达水平明显下调(P<0.001)。
蛋白质印迹法检测结果(图3B)显示,在SK-NEP-1 细胞中,siNC 组 和siMETTL7B 组的METTL7B 蛋白表达量分别为2.34±0.34 和0.68±0.23;与siNC 组相比,siMETTL7B 组METTL7B 蛋白的表达水平明显下调(P<0.001)。
克隆形成实验检测结果(图4A)显示,siNC组和siMETTL7B 组SK-NEP-1 细胞的克隆形成数分别为(240.56±35.10)个和(123.12±27.80)个;与siNC 组相比,siMETTL7B 组的克隆细胞数明显减少(P=0.001)。
CCK-8 法检测结果(图4B)显示,72 h 时siNC 组和siMETTL7B 组SK-NEP-1 细胞的D值分别0.52±0.08 和0.28±0.07,96 h 时siNC组 和siMETTL7B 组SK-NEP-1细胞的D值分别0.74±0.09 和0.39±0.07;与siNC 组相比,siMETTL7B 组SK-NEP-1 细胞的增殖能力受到明显抑制(P均<0.001)。
FCM 法检测结果(图4C)显示,siNC 组和siMETTL7B 组SK-NEP-1 细胞的凋亡率分别为(9.80±3.11)%和(21.25±5.34)%;与siNC 组相比,siMETTL7B 组SK-NEP-1 细胞的凋亡率明显升高(P=0.006)。
Transwell 小室法检测结果(图4D)显示,siNC 组和siMETTL7B 组发生侵袭的SK-NEP-1细胞数分别为(312.90±78.89)个和(198.70±50.23)个;与siNC 组相比,siMETTL7B 组SKNEP-1 细胞的侵袭能力受到明显抑制(P=0.013)。
细胞划痕实验检测结果(图4E)显示,siNC组和siMETTL7B 组SK-NEP-1 细胞的划痕愈合率迁移率分别为(39.23±12.10)%和(19.34±7.11)%;与siNC 组相比,siMETTL7B 组SKNEP-1 细胞的迁移能力受到明显抑制(P=0.030)。

Fig.4 Effects of silencing methyltransferase-like 7B (METTL7B) gene on proliferation,apoptosis,invasion and migration of SK-NEP-1 cells.A: The proliferation of SK-NEP-1 cells was detected by clone formation experiment.B: The proliferation of SK-NEP-1 cells was detected by CCK-8 method.C: The apoptotic rate of SK-NEP-1 cells was detected by flow cytometry (FCM) method.D: The invasion ability of SK-NEP-1 cells was detected by Transwell assay.E: The migration ability of SK-NEP-1 cells was detected by scratch healing experiment.siMETTL7B group: SK-NEP-1 cells were transfected with siMETTL7B targeting METTL7B gene;siNC group: SK-NEP-1 cells were transfected with siRNA negative control (NC)as the control.*P<0.05,vs siNC group (n=3).图4 沉默METTL7B 基因表达对SK-NEP-1 细胞增殖(A 和B)、凋亡(C)、侵袭(D)和迁移(E)的影响
3 讨论
肾母细胞瘤是儿童常见的实体肿瘤之一,严重威胁患儿的生命健康。近年来,随着手术及放化疗技术的发展,肾母细胞瘤的预后已得到明显改善[11]。然而,侵袭性生长和远处转移仍然是影响肾母细胞瘤预后的主要因素,因此有必要对其机制进行深入探讨。
METTL7B 是甲基转移酶样家族成员之一。既往研究发现,甲基转移酶样家族成员具有多种生物学功能,例如METTL3、METTL16、METTL2B 和METTL8 属 于RNA 甲基转 移酶,其在结直肠癌和肝细胞癌等肿瘤的发生和发展中发挥重要作用[12-15]。METTL7B 属于高尔基体相关的甲基转移酶[6],可能在肿瘤进展中发挥重要作用,然而既往相关报道较少。有研究发现,METTL7B 能够通过诱导上皮-间质转化的发生,进而增强甲状腺癌细胞的增殖、侵袭和迁移[4]。LIU 等[6]研究发现,METTL7B 可以调控非小细胞肺癌的细胞周期,沉默METTL7B基因表达可诱导肿瘤细胞发生G0/G1期停滞。对乳腺癌的研究也发现,METTL7B 可作为RhoBTB1的靶分子,在乳腺癌细胞的增殖和侵袭中发挥作用[5]。
当前,有关METTL7B 在肾母细胞瘤中的表达及其机制的研究尚鲜有报道。本研究首先检测了72 例肾母细胞瘤组织及其配对的癌旁正常肾组织中METTL7B 的表达情况,结果显示肾母细胞瘤组织中METTL7B 的阳性表达率高达68.06%(49/72),高于癌旁正常肾组织中的16.67%(12/72)。此外,与人肾母细胞瘤SK-NEP-1 细胞相比,正常肾上皮细胞PCS-400-010、PCS-400-011 和PCS-400-012 中METTL7B 蛋白的表达水平均明显偏低,说明METTL7B可能作为癌基因在肾母细胞瘤的发生中发挥作用。与肾母细胞瘤预后相关的因素包括年龄、肿瘤分期、病理类型和肿瘤大小等[16-18]。本研究结果显示,METTL7B 与肾母细胞瘤COG 分期和不良预后相关,说明METTL7B 可能参与肾母细胞瘤的恶性进展。肿瘤细胞的增殖、侵袭、迁移和凋亡与肿瘤恶性进展密切相关[19-20]。为进一步明确METTL7B 在肾母细胞瘤中的作用,本研究采用小RNA 干扰技术靶向沉默METTL7B基因的表达,结果显示沉默METTL7B 表达后SK-NEP-1细胞的增殖、侵袭和迁移能力均明显受到抑制,而细胞凋亡率增加。
综上所述,METTL7B 在肾母细胞瘤组织和细胞中高表达,METTL7B 与肾母细胞瘤COG分期和不良预后相关。沉默METTL7B 表达可能会抑制肾母细胞瘤细胞的增殖、侵袭和迁移,并促进其凋亡。本研究也存在一些局限,例如未检测METTL7B 下游指标的变化,未分析METTL7B 对肾母细胞瘤细胞细胞周期的影响,未检测METTL7B 在肾母细胞瘤患儿血清中的表达情况。因此,有待进一步研究METTL7B 在肾母细胞瘤早期诊断中的价值。总之,METTL7B可能会成为肾母细胞瘤的分子生物学标志物,未来需要对其生物学机制进行深入探讨。
