硫酸右旋糖苷通过抑制M2型巨噬细胞极化以减弱M2型巨噬细胞对HGC-27胃癌细胞侵袭和迁移的促进作用
2021-03-13郭嘉欣李梦琪陶月佳徐远义黄允宁
郭嘉欣 ,李梦琪,赵 媛,陶月佳,李 冰,徐远义,黄允宁
胃癌是世界范围最常见的消化系统恶性肿瘤[1]。由于胃癌早期隐匿性强,患者就诊时往往已发展为晚期转移性胃癌,其死亡率高[2]。尽管已出现许多治疗胃癌的新兴疗法,如根除幽门螺旋杆菌、术前或术后辅助化疗、免疫疗法、靶向治疗以及一些小分子抑制剂治疗等[3],但是胃癌的进展、复发和转移导致其5 年总生存率仍低于35%[4]。
胃癌腹腔转移不仅是肿瘤进展的结果,更可能是肿瘤微环境内广泛的细胞间相互作用的结果[5]。有研究指出,肿瘤微环境中的M2 型巨噬细胞通过促进胃癌细胞的侵袭和迁移而促进胃癌进展[6]。近年来的研究指出,通过直接或间接抑制M2 型巨噬细胞的增殖或募集是抗肿瘤免疫疗法的潜在目标,并且一些靶向M2 型巨噬细胞的试剂正在进行临床前试验[7]。因此,研究靶向胃癌中的M2 型巨噬细胞,可能为胃癌腹腔转移的治疗提供一些新的思路。
硫酸右旋糖苷(dextran sulfate,DS)是一种相对分子质量为5×105的糖类,能够直接抑制胃癌细胞的侵袭和迁移以及裸鼠胃癌腹腔移植瘤的转移[8-9]。本课题组的前期研究发现,腹腔内注射DS 的裸鼠的转移瘤组织中M2 型巨噬细胞的浸润程度明显下降[10],表明DS 可能通过影响肿瘤免疫微环境而影响胃癌的发生和发展。
本研究首先通过体外实验检测DS 对M2 型巨噬细胞极化和募集的影响,以及DS 对M2 型巨噬细胞与胃癌细胞之间相互作用的影响,然后应用免疫组织化学法分析M2 型巨噬细胞与胃癌临床病理特征之间的关系,以期为DS 的抗肿瘤研究提供更多实验依据。
1 材料与方法
1.1 胃癌组织标本收集
收集宁夏回族自治区人民医院2018 年10 月—2019 年12 月经手术切除、术后病理确诊为胃癌的病理组织标本34 例,以及对应的癌旁正常组织(选取距肿瘤边缘>2 cm 的胃黏膜组织)标本12例。34 例患者中,男性20 例、女性14 例,年龄范围为44~81 岁。所有患者术前均未接受过放疗或化疗,并且不伴有其他恶性肿瘤。所有的组织标本均经常规固定和脱水处理后,石蜡包埋制作成蜡块;随后经切片机切成4 μm 厚度的连续切片以供后续研究。本研究获得宁夏医科大学医学伦理审查委员会批准(批准号:2020103)。
1.2 细胞、试剂及仪器
人胃癌细胞HGC-27 和人单核细胞THP-1购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。DS(货 号:D8906)和佛波 酯(phorbol 12-myristate 13-acetate,PMA)购自美国Sigma公司,白细胞介素4(interleukin-4,IL-4)和IL-13 购自美国PeproTech 公司。兔抗人CD163和CD206 单克隆抗体购自英国Abcam 公司,兔抗人CD68 单克隆抗体购自美国CST 公司,兔抗人N-钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)多克隆抗体购自北京博奥森生物技术有限公司,兔抗人基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)多克隆抗体和鼠抗人GAPDH 单克隆抗体购自武汉赛维尔生物科技有限公司;全蛋白提取试剂盒和BCA 检测试剂盒等购自江苏凯基生物技术股份有限公司,孔径为8.0 μm 的Transwell 小室购自广州洁特生物过滤股份有限公司,铺设有孔径为0.4 μm 预制胶的Transwell 小室购自美国Corning 公司。
荧光显微镜和倒置光学显微镜均为日本Olympus 公司产品,凝胶图像分析仪(Amersham Imager 600,GEL)为美国GE Healthcare 公司产品。
1.3 细胞培养及DS 的配制
HGC-27 胃癌细胞培养于含1%青链霉素和10%胎牛血清的RPMI 1640 培养液中,THP-1细胞培养于含1%青链霉素和15%胎牛血清的RPMI 1640 培养液中,细胞均置于37 ℃、CO2体积分数为5%、恒温恒湿的培养箱内进行培养。称取0.3 g DS 溶于10 mL PBS 中,配制获得浓度为3%的DS 母液,细胞培养时向培养液中加入相应体积的DS 母液,使DS 的终浓度为0.3%。
1.4 M0 和M2 型巨噬细胞的诱导及验证
1.4.1 M0 和M2 型巨噬细胞的诱导流程
取对数生长期的THP-1 细胞,离心收集细胞,用培养液重悬后,调整细胞密度为1×106个/mL,取3 mL THP-1 细胞悬液接种至直径为6 cm 的培养皿中,加入终浓度为200 ng/mL 的PMA 进行干预,诱导24 h 后厚获得M0 型巨噬细胞。将诱导获得的M0 型巨噬细胞除去培养液后,用PBS 清洗细胞2 次;加入质量浓度为100 ng/mL 的PMA以及20 ng/mL 的IL-4 和IL-13 诱导24 h 后获得M2 型巨噬细胞。
1.4.2 免疫细胞荧光法验证M0 和M2 型巨噬细胞的诱导结果
分别用免疫细胞荧光检测诱导的巨噬细胞上M0 型巨噬细胞表面标志物(CD68)和M2 型巨噬细胞表面标志物(CD206)的表达水平。将制备获得的M0 和M2 型巨噬细胞以1×105个细胞/片的密度爬片后,用100% 甲醇溶液固定细胞5 min,加入0.1% Tween-20 通透处理30 min,用含10%山羊血清的封闭液封闭处理30 min,加入一抗[兔抗人CD206 和CD68 单克隆抗体(体积稀释比例均为1 ∶1 000)] 4 ℃孵育过夜,再加入二抗[FITC-山羊抗兔IgG(体积稀释比例为1 ∶20)] 37 ℃孵育1 h,避光条件下用PBS浸泡5 min,清洗3 次,加入DAPI 进行细胞核染色,最后用抗淬灭处理后封片,荧光显微镜下观察荧光染色情况并拍照。
1.4.3 蛋白质印迹法检测THP-1 细胞、M0 型巨噬细胞和M2 型巨噬细胞中CD163 蛋白的表达水平
参照全蛋白提取试剂盒操作说明书,提取诱导获得的M0 型巨噬细胞、M2 型巨噬细胞及THP-1 细胞中蛋白,采用BCA 法进行蛋白定量。按40 μg/10 μL 的蛋白量进行上样,行10%SDS-PAGE 分离蛋白,并将分离后的蛋白转移至PVDF 膜上;用含5%脱脂牛奶的封闭液常温封闭1 h,加入一抗[兔抗人CD163 单克隆抗体(体积稀释比例为1 ∶1 000)] 4 ℃孵育过夜;洗膜后加入二抗[辣根过氧化物酶标记的山羊抗兔IgG(体积稀释比例为1 ∶5 000)]常温下孵育1 h,滴加电化学发光显影液,采用凝胶图像分析仪进行分析。应用Image J 软件对蛋白条带进行分析,以目的蛋白的灰度值与内参照蛋白灰度值的比值表示目的蛋白的相对表达量。
1.5 DS 对M0 和M2 型巨噬细胞诱导极化及趋化募集能力的影响
1.5.1 细胞分组
实验共分成4 组:M0 组、M0DS 组、M2组和M2DS 组。M0 组:M0 型巨噬细胞(通过诱导获得,见1.4.1 节)。M2 组:M2 型巨噬细胞(通过诱导获得,见1.4.1 节)。M0DS 组:在M0 型巨噬细胞诱导过程中,悬浮的THP-1 细胞经PMA 处理8~12 h 后开始贴壁生长,于12 h时加入DS(终浓度为0.3%)继续诱导12 h。M2DS 组:在M2 型巨噬细胞极化过程的起始阶段,用DS(终浓度为0.3%)和100 ng/mL 的PMA 合 并20 ng/mL 的IL-4 和IL-13 处 理M0型巨噬细胞24 h。
1.5.2 蛋白质印迹法检测各组巨噬细胞中CD163及CD206 的蛋白表达水平
收集4 组巨噬细胞(细胞分组及处理见1.5.1节),采用蛋白质印迹法检测巨噬细胞中CD163和CD206 蛋白的表达水平,蛋白检测流程同1.4.3节。其中,一抗为兔抗人CD163 和CD206 单克隆抗体(工作液体积稀释比例均为1 ∶1 000)。
1.5.3 Transwell 小室迁移实验检测巨噬细胞的趋化募集能力
实验同样分为4 组:M0 组、M0DS 组、M2组和M2DS 组。在置有Transwell 小室的24 孔板的下室中接种HGC-27 胃癌细胞(3×105个/600 μL),在上室中分别接种各组巨噬细胞(M0组、M0DS 组、M2 组和M2DS 组)1×105个/500 μL。待上下小室内细胞贴壁后共培养24 h,取出小室,用PBS 清洗后晾干,用4%多聚甲醛溶液固定细胞20 min,用棉签轻柔擦去小室内未穿过小室膜的残留细胞。用0.1%结晶紫染色15 min,流水下冲洗干净后,在光学显微镜下观察细胞形态并计数。随机选取5~10 个视野进行拍照计数,以此反映各组巨噬细胞的趋化能力。
1.6 DS 对巨噬细胞(M0 和M2 型)促 进HGC-27 胃癌细胞侵袭和迁移以及侵袭和迁移相关蛋白表达的影响
1.6.1 划痕愈合实验检测各组巨噬细胞(M0、M0DS、M2 和M2DS)对HGC-27 胃癌细胞迁移能力的影响
实验共设置5 组:对照组仅有HGC-27 胃癌细胞,M0 组、M0DS 组、M2 组和M2DS 组均为HGC-27 胃癌细胞与巨噬细胞(诱导获得,见1.5.1 节)共培养组。收集对数生长期的HGC-27 胃癌细胞,以2×106个/孔的密度接种于6 孔板下室,并提前将4 组巨噬细胞以1×106个/孔的密度接种于Transwell 小室上室中。待下室中HGC-27 胃癌细胞贴壁后取出6 孔板,用200 μL枪头水平划3 条直线,PBS 漂洗后,在光学显微镜下拍照。将上室放入6 孔板中,共培养系统中加入无血清培养液。共培养24 h 后,取出6 孔板,弃去上层小室,观察胃癌细胞划痕处细胞汇合情况,并拍照。细胞迁移率(%)=(0 h 划痕面积-24 h 划痕面积)/0 h 划痕面积。
1.6.2 Transwell 小室侵袭实验检测各组巨噬细胞(M0、M0DS、M2 和M2DS)对HGC-27 胃 癌细胞侵袭能力的影响
实验设置同1.6.1 节,共设置5 组。将HGC-27 胃癌细胞以1×105个/孔的密度接种于24 孔Transwell 小室(铺设有预制胶)中,再将4 组巨噬细胞以3×105个/孔的密度接种于24 孔板底部。将上室置于24 孔板中,共培养24 h 后,观察发生侵袭的细胞数,检测流程同1.5.3 节。
1.6.3 蛋白质印迹法检测共培养后HGC-27 胃癌细胞中侵袭和迁移相关蛋白的表达水平
提取HGC-27 胃癌细胞中的蛋白,蛋白检测流程同1.4.3 节。采用的一抗为兔抗人N-cadherin(体积稀 释比例 为1 ∶500)、Vimentin(体积稀释比例为1 ∶1 000)和MMP-2(体积稀释比例为1 ∶500)多克隆抗体以及鼠抗人GAPDH 单克隆抗体(体积稀释比例为1 ∶1 000)。
1.7 免疫组织化学法检测胃癌及癌旁正常组织中M2 型巨噬细胞的浸润情况
胃癌及癌旁正常组织切片经二甲苯溶液脱蜡后,梯度乙醇溶液复水,枸橼酸钠修复组织抗原,加入3% H2O237℃孵育20 min 后,用含10%山羊血清的封闭液37 ℃封闭30 min;加入一抗兔抗人CD163 单克隆抗体(体积稀释比例为1 ∶400)4 ℃孵育过夜,随后加入二抗[山羊抗兔IgG(北京中杉金桥生物技术有限公司产品)],二步法孵育。DAB 染色,苏木精复染细胞核,封片后,在光学显微镜下观察细胞染色情况。CD163 阳性细胞数判定标准参阅参考文献[11]提供的实验方法:在光学显微镜下(放大倍数为200 倍)观察染色结果,每张切片随机选择5 个不重叠的区域,收集图像并计数阳性细胞数,取其平均值作为该张切片的阳性细胞数。根据统计结果,以34 例胃癌组织染色结果的中位数,将34 例胃癌患者分为CD163 高表达组(>322 个/200 倍视野下)和低表达组(322 个/200 倍视野下)。
1.8 统计学方法
应用SPSS 22.0 软件对实验数据进行统计学分析。所有实验均独立重复3 次,数据以表示。临床病理特征分析采用χ2检验或Fisher 确切概率法。2 组间比较采用独立样本t 检验,多组间比较采用单因素方差分析,组内两两比较采用Turkey-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 体外诱导M2 型巨噬细胞
光学显微镜下观察发现(图1A),单核细胞THP-1 呈悬浮生长,外形为圆形且规则,细胞膜透亮且折光性良好。经PMA 诱导24 h 后,THP-1 细胞开始贴壁生长,细胞体积增大,细胞形态呈椭圆形或有突起,提示已分化为M0 巨噬细胞(M0 组)。M0DS 组(PMA 诱导12 h 时再加入终浓度为0.3%的DS 继续诱导12 h)细胞虽然仍贴壁生长,但是部分细胞膜仍透亮,提示细胞贴壁不完全,并且与M0 组细胞相比细胞体积较小。用IL-4 和IL-13 继续诱导培养M0 巨噬细胞24 h 后,细胞变为细长梭形且形态多样,提示M0 巨噬细胞极化为M2 型巨噬细胞(M2 组)。采用IL-4 和IL-13 继续干预M0 巨噬细胞的同时,加入终浓度为0.3%的DS,即为M2DS 组,M2DS 组中的巨噬细胞仅贴壁,细胞突起较少,无M2 型巨噬细胞的形态特征,与M0 巨噬细胞相似。
应用免疫细胞荧光法检测诱导是否成功。结果(图1B)显示,M0 巨噬细胞标志物CD68 在细胞膜和细胞质中均有表达,M2 型巨噬细胞标志物CD206 表达于细胞膜上,并且大部分细胞均有表达。
蛋白质印迹法检测结果(图1C)显示,THP-1 单核细胞基本不表达CD163,M0 巨噬细胞中的CD163 表达量低于M2 型巨噬细胞,上述结果表明M2 型巨噬细胞诱导成功。
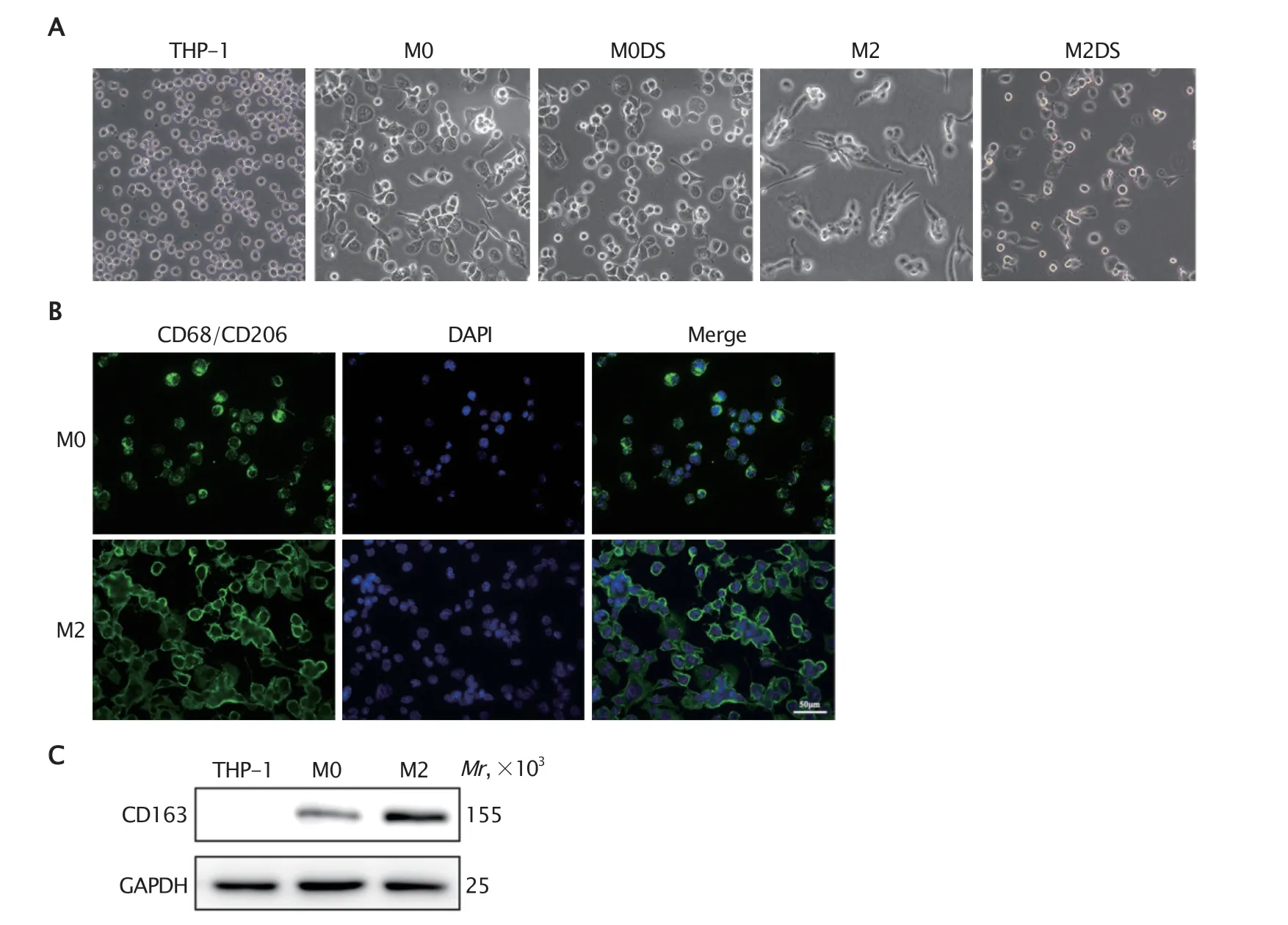
Fig.1 The morphology of M0-type and M2-type macrophages and dextran sulfate (DS)-treated M0-type and M2-type macrophages was observed under an inverted microscope (A,×400),and the expressions of macrophage surface markers (CD68 and CD206) were detected by immunocytofluorescence (B: fluorescent staining,×400) and Western blotting (C),respectively.THP-1 group: THP-1 cells were not treated with any drugs;M0 group: THP-1 cells were treated with phorbol 12-myristate 13-acetate (PMA);M0DS group: THP-1 cells were treated with PMA and DS;M2 group: M0-type macrophages were treated with PMA combined with interleukin-4 (IL-4) and IL-13;M2DS group: M0-type macrophages were treated with PMA combined with IL-4,IL-13 and DS.The expressions of M0-type macrophages surface marker CD68 and M2-type macrophage surface marker CD206 were detected by immunocytofluorescence.Western blotting was used to detect the expression levels of CD163 in THP-1 cells,M0-type macrophages and M2-type macrophages.图1 倒置光学显微镜下观察M0 和M2 型巨噬细胞以及DS 处理后M0 和M2 型巨噬细胞的形态(A:×400),分别采用免疫细胞荧光法(B:荧光染色×400)和蛋白质印迹法(C)检测巨噬细胞表面标志物的表达情况
2.2 DS 可抑制M2 型巨噬细胞极化
为检测DS 对M2 型巨噬细胞极化的影响,采用蛋白质印迹法检测M2 型巨噬细胞标志物CD163 和CD206 蛋白的表达水平。结果(图2)显 示,M0 组 和M0DS 组细胞 中CD163 和CD206 蛋白表达水平的差异均无统计学意义;M2 组细胞中CD163 和CD206 蛋白的表达水平均高 于M0DS 组(P<0.001 和P<0.01);M2DS 组中CD163 和CD206 蛋白的表达水平均较M2 组明显下调(P<0.001 和P<0.05)。
2.3 DS 抑制M2 型巨噬细胞的趋化募集能力
采用Transwell 小室迁移实验检测巨噬细胞响应胃癌细胞的趋化募集能力。结果(图3)显示,M2 组中穿过小室膜的细胞数为(646.1±116.5)个,较M0 组的(299±103.8)个、M0DS 组的(113.6±31.94)个和M2DS 组的(34.1±15.42)个均明显增多(P均<0.001),M0DS 组中发生迁移的巨噬细胞数较M0 组明显减少(P<0.001),M2DS 组中发生迁移的巨噬细胞数较M2 组明显减少(P<0.001)。
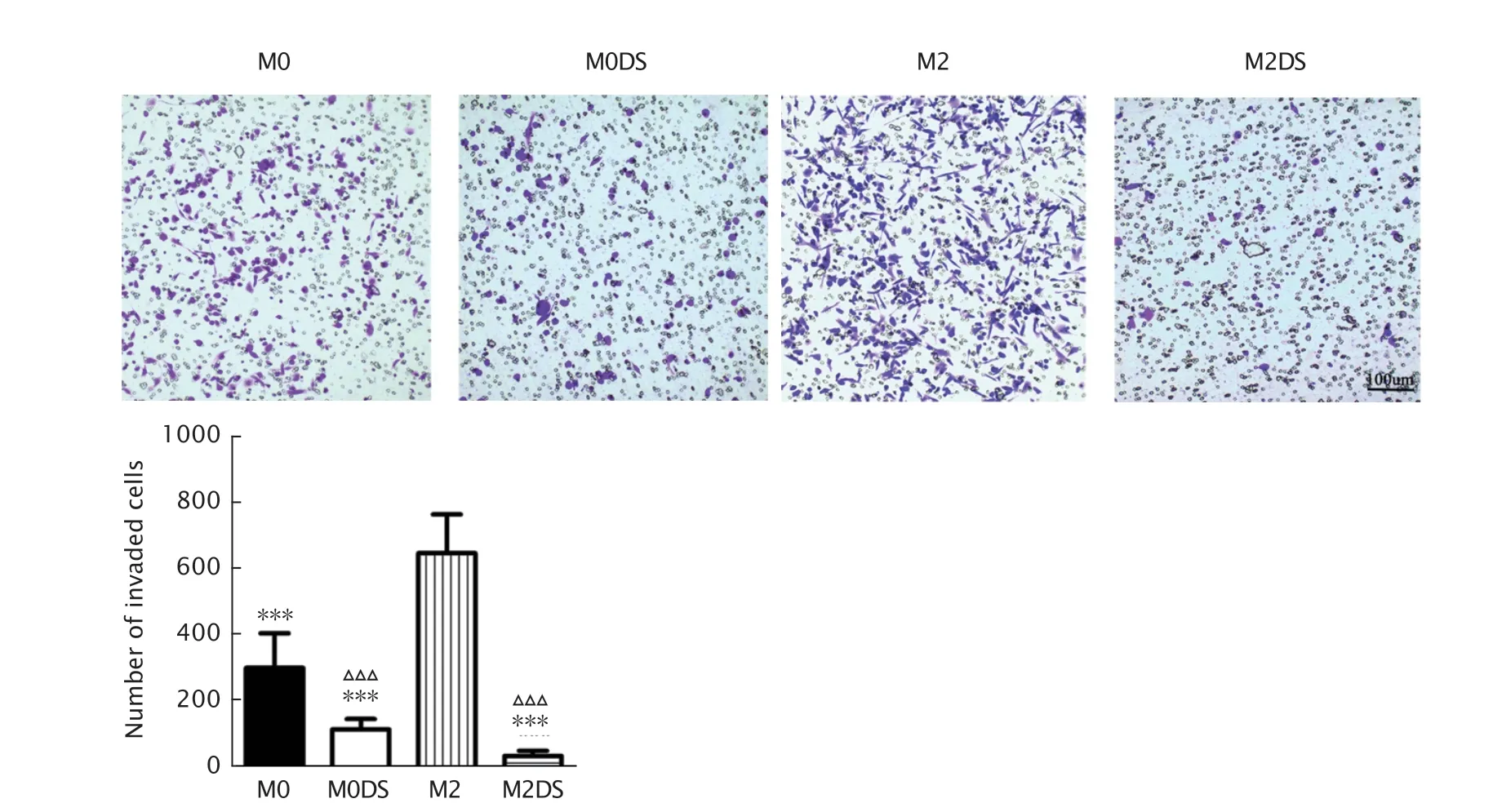
Fig.3 Trans well assay was used to detect the chemotaxis and recruitment abilities of macrophages cocultured with HGC-27 cells (crystal violet staining,×200).M0 group: THP-1 cells were treated with phorbol 12-myristate 13-acetate (PMA);M0DS group: THP-1 cells were treated with PMA and DS;M2 group: M0-type macrophages were treated with PMA combined with interleukin-4 (IL-4) and IL-13;M2DS group:M0-type macrophages were treated with PMA combined with IL-4,IL-13 and DS.***P<0.001,vs M2 group;△△△P<0.001,vs M0 group (n=3).图3 Transwell 小室实验检测巨噬细胞响应HGC-27 胃癌细胞的趋化募集能力
2.4 DS 干预巨噬细胞极化后对胃癌细胞迁移和侵袭能力的影响
采用划痕实验检测各组巨噬细胞对HGC-27胃癌细胞横向迁移能力的影响。结果(图4A)显示,对照组(仅有HGC-27 胃癌细胞)细胞培养24 h 时后的划痕愈合率为(23.33±4.04)%,而与M0 型巨噬细胞(M0 组)和M2 型巨噬细胞(M2组)共培养后的HGC-27 胃癌细胞的划痕愈合率分别为(54.33±5.89)% 和(79.00±7.55)%,M0 组和M2 组HGC-27 胃癌细胞的迁移能力均较对照组明显提高(P<0.01 和P<0.001),表明M0 和M2 型巨噬细胞均可促进HGC-27 胃癌细胞的迁移能力;与M0DS 或M2DS 组巨噬细胞共培养后,HGC-27 胃癌细胞的划痕愈合率分别为(48.00±3.00)% 和(56.00±5.29)%,M0DS 组和M2DS 组HGC-27 胃癌细胞的迁移能力均有明显下降(P<0.05 和P<0.001),表明DS 能够明显抑制M0 和M2 型巨噬细胞对HGC-27 胃癌细胞迁移能力的促进作用。
采用Transwell 小室侵袭检测各组巨噬细胞对HGC-27 胃癌细胞侵袭能力的影响。结果(图4B)显示,对照组中穿过小室膜的细胞数为(93.8±12.81)个,HGC-27 胃癌细胞与M0 巨噬细胞共培养后穿过小室膜的细胞数为(92.20±10.43)个,与M2 型巨噬细胞共培养后穿过小室膜的细胞数为(157.80±20.07)个,与M0DS 组共培养后穿过小室膜的细胞数为(29.20±9.01)个,与M2DS 组巨噬细胞共培养后穿过小室膜的细胞数为(60.00±10.65)个;与对照组相比,HGC-27 胃癌细胞与M2 型巨噬细胞共培养后,其侵袭能力明显提高(P<0.001),而与M0DS 组和M2DS 组细胞共培养后,其侵袭能力明显受抑(P均<0.001)。上述结果表明,DS 可以抑制M0 和M2 型巨噬细胞对胃癌细胞的趋化吸引作用。
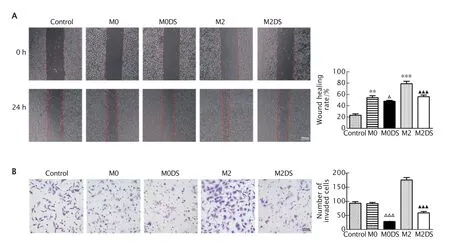
Fig.4 The invasion (A) and migration (B) abilities of HGC-27cells after co-culture with M0-type and M2-type macrophages and DS-treated M0-type and M2-type macrophages were detected by woundhealing assay (×40) and Transwell assay (crystal violet staining,×400),respectively.Control group: HGC-27 cells;M0 group: THP-1 cells treated with phorbol 12-myristate 13-acetate (PMA);M0DS group: THP-1 cells treated with PMA and DS;M2 group: M0-type macrophages treated with PMA combined with interleukin-4 (IL-4) and IL-13;M2DS group: M0-type macrophages treated with PMA combined with IL-4,IL-13 and DS.**P<0.01,***P<0.001,vs the control group;△P<0.05,△△△P<0.001,vs M0 group;▲▲▲P<0.001,vs M2 group (n=3).图4 划痕愈合实验(A)和Transwell 小室侵袭实验(B)检测巨噬细胞对HGC-27 胃癌细胞迁移和侵袭能力的影响
2.5 DS 干预巨噬细胞极化后对胃癌细胞侵袭和迁移相关蛋白表达的影响
采用蛋白质印迹法检测共培养后的HGC-27 胃癌细胞中侵袭和迁移相关蛋白N-cadherin、MMP-2 和Vimentin 的表达情况。结果(图5)显示,与M2 型巨噬细胞共培养后,HGC-27 胃癌细胞中N-cadherin、MMP-2 和Vimentin 蛋白的表达水平均明显上调(P<0.001 和P<0.01);而与M2DS 组巨噬细胞共培养后,HGC-27 胃癌细胞 中N-cadherin、MMP-2 和Vimentin 的表达水平均较M2 组明显下调(P<0.001 和P<0.01)。
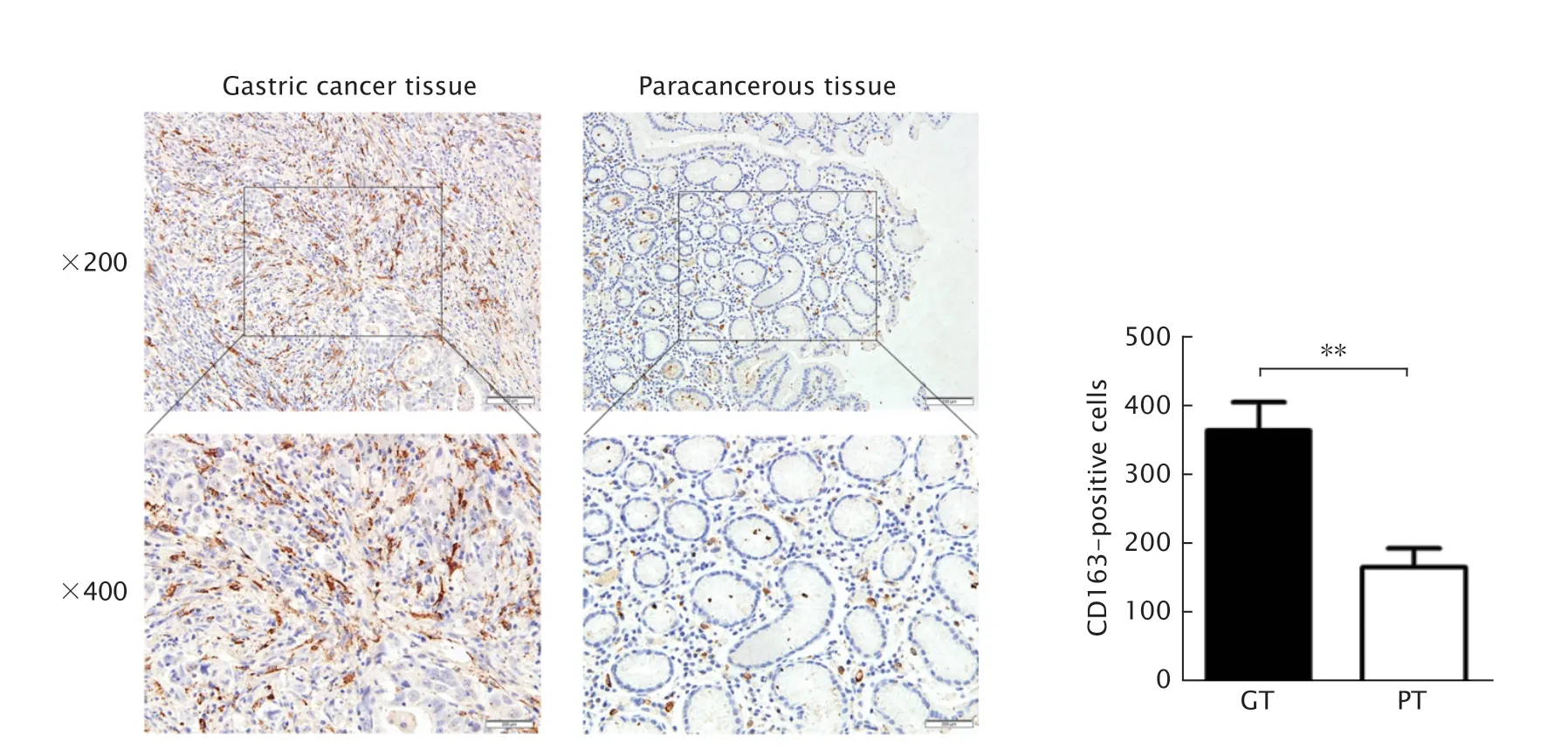
Fig.6 The infiltration degree of M2-type macrophages in 34 cases of gastric cancer tissues (GT) and the paracancerous tissues (PT) were detected by immunohistochemistry (DAB staining).**P<0.01.图6 免疫组织化学法检测34 例胃癌组织及癌旁正常组织中M2 型巨噬细胞的浸润情况
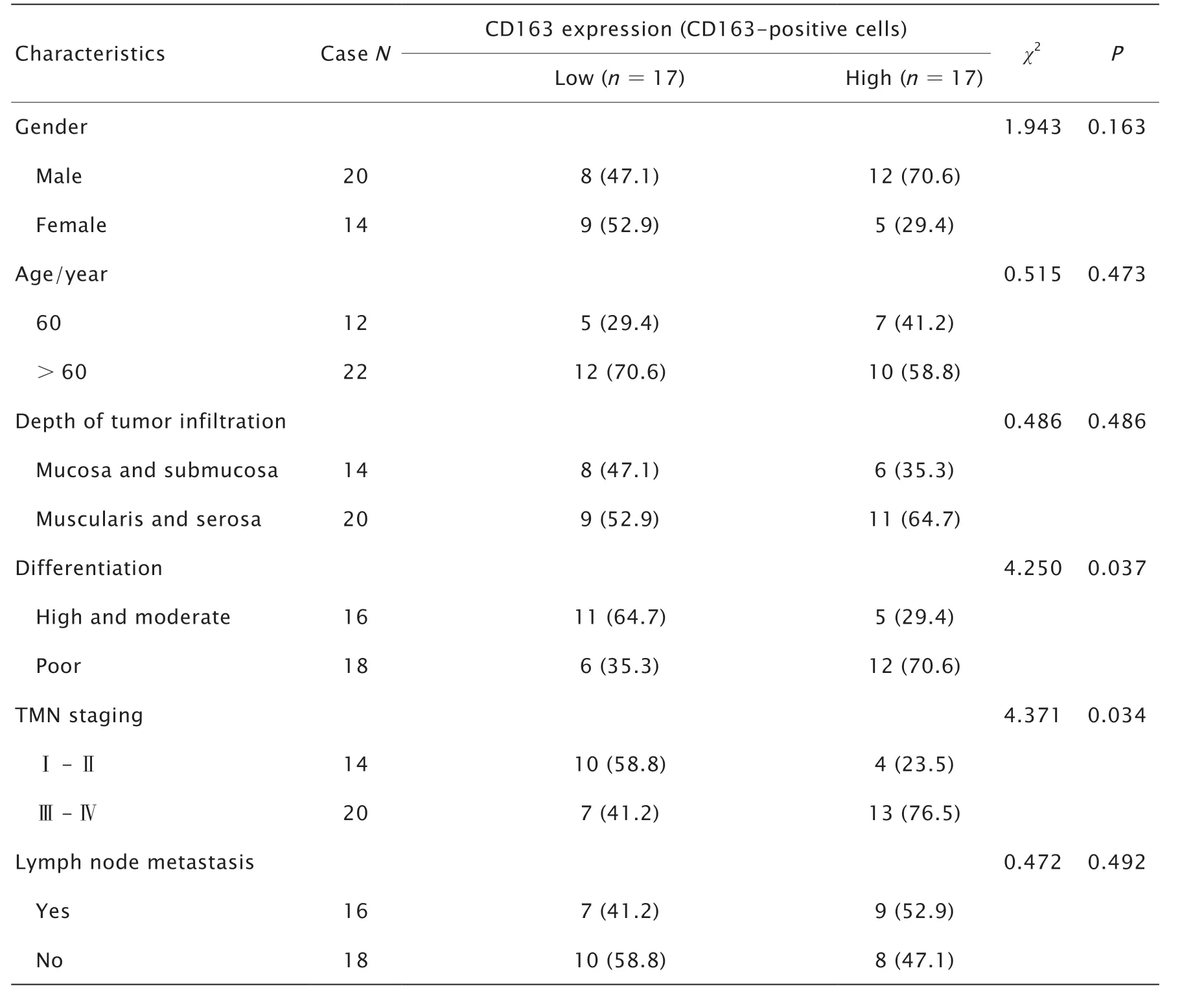
表1 胃癌组织中CD163 蛋白的表达与临床病理特征之间的关系Table 1 The relationship between CD163 expression and the clinicopathological characteristics in gastric cancer tissues[n (%)]
2.6 M2 型巨噬细胞在胃癌及正常胃黏膜组织中的浸润情况
免疫组织化学法检测结果(图6)显示,M2 型巨噬细胞为形态不规则有突起的棕黄色细胞,定位于肿瘤间质中;CD163 主要表达于M2 型巨噬细胞的细胞膜上,少量表达于细胞质中。胃癌组织间质中M2 型巨噬细胞的浸润程度[(365±198)个]明显高于癌旁正常组织[(167±93)个](P<0.01)。
2.7 胃癌组织中CD163 蛋白的表达与临床病理特征之间的关系
胃癌组织中CD163 蛋白的表达与患者的性别、年龄、肿瘤浸润深度以及是否有淋巴结转移之间无明显相关性(P均>0.05),但与胃癌的分化程度和临床分期有关(P均<0.05)。
3 讨论
世界范围内胃癌的发病率和致死率均很高[1]。胃癌的发生和发展不仅取决于癌细胞自身,也与肿瘤微环境的生理状态密切相关。越来越多的研究表明,胃癌微环境中的免疫细胞尤其是数量最多的M2 型巨噬细胞与胃癌细胞之间存在相互调节作用,可以促进胃癌的发生和发展[12-14]。有研究提示,肿瘤细胞通过分泌细胞因子或趋化因子以招募外周血和组织中驻留的单核细胞或巨噬细胞,诱导其极化为M2 型巨噬细胞;M2 型巨噬细胞可以通过抑制炎性反应、促进肿瘤细胞生长和转移以及调节免疫系统等,发挥促进肿瘤发生和发展的作用[15-16]。因此,本研究以M2 型巨噬细胞作为切入点,为探索M2 型巨噬细胞在抗肿瘤中的作用提供理论依据。
CD206和CD163是M2型巨噬细胞的2种表面标志物。TARIQ 等[17]的研究显示,用吉非替尼处理已经IL-13 处理的M2 型巨噬细胞72 h后,M2 型巨噬细胞中CD206 和CD163 蛋白的表达水平显著下调,表明吉非替尼可有效抑制IL-13 诱导的M2 型巨噬细胞的极化,因此M2型巨噬细胞中CD206 和CD163 蛋白的表达下调表明M2 型巨噬细胞的极化受到抑制。本课题组的前期研究证实,0.3% DS 是可以对胃癌细胞发挥作用的最低浓度,并且对M0 型和M2 型巨噬细胞的活性均无影响,对肝肾功能也无显著毒性。本研究发现,在单核细胞诱导成M0 巨噬细胞过程中加入DS 后,细胞不易贴壁且细胞体积变小;在M2 型巨噬细胞极化过程中加入DS 后,M2型巨噬细胞的形态不再呈现细长或梭形的多样化特征;蛋白质印迹法检测结果显示,经DS 处理后,M2 型巨噬细胞(M2DS)中CD163 和CD206蛋白的表达水平显著下降,表明DS 在M2 型巨噬细胞的极化过程中不仅影响其体积和细胞形态,还抑制M2 型巨噬细胞的极化。然而,DS抑制M2 型巨噬细胞极化所涉及的具体分子机制,仍有待进一步研究。
胃癌细胞有招募单核细胞或巨噬细胞进入胃癌微环境的能力。巨噬细胞进入肿瘤微环境后可极化为M2 型巨噬细胞,进而发挥促癌作用[18],而抑制胃癌细胞对M2 型巨噬细胞的招募有助于抑制肿瘤的恶性进展。为检测胃癌细胞对DS 干预后巨噬细胞募集趋化能力的影响,本研究进一步构建体外巨噬细胞与胃癌细胞共培养模型,发现M2 型巨噬细胞响应胃癌细胞的趋化募集能力强于M0 巨噬细胞,而DS 干预后的M2 型巨噬细胞的趋化募集能力明显减弱。这部分结果表明,DS 可能通过干预M2 型巨噬细胞的极化过程,阻止M0 巨噬细胞向M2 型巨噬细胞极化,从而降低M2 型巨噬细胞中CD206 和CD163 蛋白的表达水平,继而降低M2 型巨噬细胞的趋化募集能力,即抑制其向胃癌细胞移动。目前针对M2型巨噬细胞的靶向治疗措施包括巨噬细胞极化重编程、耗竭性治疗、阻断募集以及靶向M2 型巨噬细胞释放的生成因子等[7,14]。本研究结果表明,DS 对M2 型巨噬细胞的影响是多方面的,既能抑制其极化过程,又能削弱其募集能力。
研究结果表明,M2 型巨噬细胞有促进胃癌细胞侵袭和迁移的潜力[18]。本研究中的划痕及侵袭实验均表明,M0 型和M2 型巨噬细胞均可增强胃癌细胞的横向迁移能力,M2 型巨噬细胞能够增强胃癌细胞的侵袭能力;而DS 干预M2 型巨噬细胞极化过程后,这种促进能力均被弱化。N-cadherin、MMP-2 和Vimentin 在肿瘤细胞的侵袭和迁移中发挥重要作用,通过降解细胞外基质,引发肿瘤细胞的上皮-间质转化,从而促进肿瘤细胞的侵袭性,这在肿瘤转移的过程中尤为重要[19-20]。本研究中的蛋白质印迹法检测结果表明,M2 型巨噬细胞能够显著提高胃癌细胞中N-cadherin、MMP-2 和Vimentin 的表达水平,而M2DS 组的M2 型巨噬细胞对胃癌细胞中这些蛋白的表达无影响。上述结果显示,M2 型巨噬细胞能够促进胃癌细胞的侵袭和迁移能力,并且增加胃癌细胞中侵袭和迁移相关蛋白的表达水平,而DS 能够抑制M2 型巨噬细胞对胃癌细胞侵袭和迁移的促进作用以及侵袭和迁移相关蛋白的上调作用,表明DS 可以通过调控M2 型巨噬细胞间接抑制胃癌细胞的侵袭和迁移。
本研究首先通过细胞实验揭示DS 对M2 型巨噬细胞的极化及其与胃癌细胞相互作用的影响,随后对人胃癌组织中M2 型巨噬细胞的表达及其意义进行研究。免疫组织化学法检测结果显示,胃癌组织中M2 型巨噬细胞的数量较癌旁正常组织中明显增多;将34 例胃癌组织分为高表达组和低表达组,结果显示M2 型巨噬细胞的浸润程度与胃癌的分化程度和临床分期呈正相关,这与既往张伟杰[21]和ZHU 等[22]报道的结果基本一致。本研究结果表明,胃癌组织分化程度越低、临床分期越晚,M2 型巨噬细胞在胃癌组织中的浸润程度就越高。上述结果提示,M2 型巨噬细胞在胃癌的发生和发展中扮演重要角色,因此有望将其作为胃癌治疗的靶点而发挥抗肿瘤作用。
综上所述,本研究表明DS 能够干扰M0 巨噬细胞向M2 型巨噬细胞的极化,并削弱其趋化募集能力;DS 可以抑制M2 型巨噬细胞对胃癌细胞侵袭和迁移的促进能力以及侵袭和迁移相关蛋白的表达;胃癌组织中的M2 型巨噬细胞数量显著增多,并且与胃癌组织的分化程度和临床分期呈正相关。关于DS 干预M2 型巨噬细胞极化的具体机制尚待进一步研究,以期为DS 抗肿瘤研究提供更多的实验室证据。
