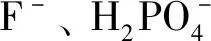2-羟基-1-萘醛缩2-氨基-4-硝基苯酚亚胺的合成及其阴离子识别性能
2021-03-13籍向东李守博彭丽萍岳国仁
籍向东,李守博,彭丽萍,岳国仁,曹 成
(河西学院 化学化工学院 甘肃省河西走廊特色资源利用重点实验室,甘肃 张掖 734000)
阴离子因在化工、医药及生物等诸多领域扮演了极其重要的角色而受到广泛关注。研究人员已经合成了多种具有高选择性、高灵敏度的阴离子识别器,并且应用于选择性识别阴离子,取得了良好的识别效果[1-3]。氟离子是多种药物的主要成分、对牙齿有保护作用等[4]。当饮用水中氟离子的含量高于正常标准时,会导致氟中毒、肾脏损害或骨质疏松等病症[5-6]。醋酸根离子在生物体内是非常重要的组成成分,可以制备乙酰辅酶A、维他命等多种人体所需物质,同时在新陈代谢产物和细胞讯号传递方面也具有一定的决定性作用,并且多种醋酸盐已经成为药物生产和研究的核心原料[7-8]。同样,磷酸根因其在许多生化反应中的重要作用以及作为生物分子的主要成分而备受研究人员的关注。尽管磷酸根离子已成为人类生产和生活不可或缺的一部分,但生活中过度使用磷酸根将会导致水生生态系统的富营养化和土壤污染等诸多问题[9-10]。因此,发展具有高选择性、高灵敏度的新型阴离子识别器仍然是一个极具挑战性的课题。
阴离子结合单元和信号单元是构成阴离子识别器的主要成分,其中,具有发色效应的硝基芳环结构是常见的一种信号单元,这类阴离子识别受体一般称之为比色传感器[11]。此外,受体的结合单元一般是含有可以形成氢键的活泼酸性质子,实现分子内电荷转移(ICT),通常包含脲[12]、硫脲[13]、氨基[14]和酚羟基[15]等基团。其中,亚胺类受体以其合成简单、结构可控性好等优点被广泛研究,并且此类受体含有可以与阴离子形成稳定氢键的OH或NH基团,少许此类受体在阴离子选择性识别上显示了特有的单一识别效应[16-17]。阴离子的识别性质研究不仅仅局限于紫外或荧光波长的变化,而更重要的是发展设计不需任何昂贵设备即可实现对阴离子裸眼识别的受体分子[18]。因此,亚胺类受体已经成为识别阴离子的一类重要配体[19-20]。
鉴于此,本论文在实验室前期研究的基础上[21],通过缩合反应合成了阴离子识别受体2-羟基-1-萘醛缩2-氨基-4-硝基苯酚亚胺(R,Scheme 1),其结构经1H NMR,13C NMR和IR表征。采用UV-Vis和1H NMR等研究了受体R对阴离子的识别性能。并通过核磁滴定、紫外滴定、络合常数及Job曲线等对受体R的识别机理进行了研究。

Scheme 1
1 实验部分
1.1 仪器与试剂
SGW X-4B型显微熔点仪;Bruker-NMR 400 MHz型核磁共振仪(TMS为内标);Thermo Scientific Nicolet iS50型红外光谱仪(KBr压片);Hitachi U-3900H型紫外-可见分光光度计。
2-氨基-4-硝基苯酚、2-羟基-1-萘甲醛、阴离子(四正丁基铵盐),上海阿拉丁生化科技股份有限公司;其余所用试剂均为分析纯或化学纯。
1.2 合成[22]
在圆底烧瓶中依次加入2-氨基-4-硝基苯酚0.31 g(2 mmol)和2-羟基-1-萘甲醛0.34 g(2 mmol),搅拌下加入乙醇20 mL,冰醋酸0.5 mL,超声反应20 min。倒入冰水中,搅拌至出现絮状沉淀,过滤,滤饼用冷乙醇(3×10 mL)洗涤,真空干燥得深黄色固体R0.46 g,产率75.5%.m.p.279~281 ℃;1H NMR(DMSO-d6,400 MHz)δ:15.72(s,1H),11.89(s,1H),9.72(s,1H),8.86(d,J=8.0 Hz,1H),8.54(d,J=8.0 Hz,H),8.05(dd,J=4.0 Hz,1H),7.87(d,J=8.0 Hz,1H),7.72(d,J=8.0 Hz,1H),7.53(t,J=4.0 Hz,1H),7.32(t,J=4.0 Hz,1H),7.15(d,J=8.0 Hz,1H),6.85(d,J=8.0 Hz,1H);13C NMR(DMSO-d6,100 MHz)δ:175.90,155.70,152.93,140.80,138.59,134.04,130.97,129.45,128.60,126.78,124.37,124.00,123.10,121.01,116.13,114.29,109.11;IRν:3442,3046,1622,1504,1338。
2 结果与讨论
2.1 紫外光谱响应
(1) 受体R对阴离子紫外光谱响应
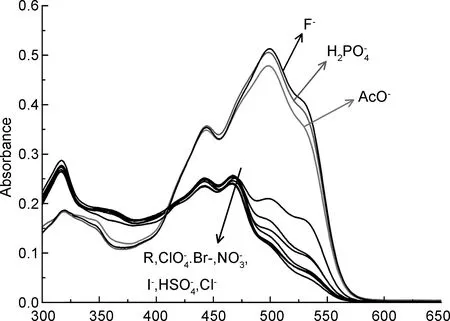
λ/nm图1R在乙腈溶液中对各种阴离子的UV-Vis谱图Figure 1 UV-Vis spectra of R in CH3CN against different guest anions
(2) 受体R对阴离子的紫外滴定

2.2 受体R试纸检测实验及裸眼识别性能
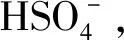
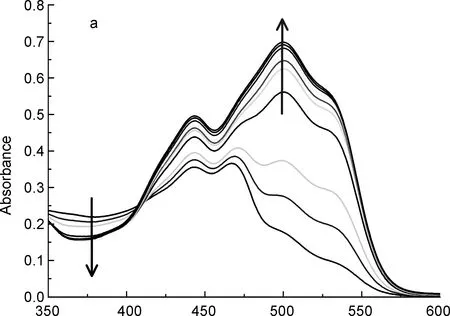
λ/nm图2受体R在乙腈溶液中对和AcO-(c)的UV-Vis谱图Figure 2UV-Vis titration spectra of receptor R in CH3CN against F-(a), and AcO-(c)

图3受体R的乙腈溶液加入阴离子后的颜色变化(左)和不同浓度F-(0.01和0.1 mol/L)对受体R的试纸检测(右)Figure 3Colorimetric response upon addition of different anions into receptor R CH3CN solution(left) and photograph of the test papers(right) with receptor R for different concentration F-(0.01 and 0.1 mol/L)
2.3 受体R的氟离子核磁滴定
仅仅通过光谱信息和试纸试验,仍然难以解释受体与阴离子的结合情况。通常情况下,受体与氟离子的结合机制一般利用活泼氢在核磁氢谱中的显著变化解释说明[7]。如图4所示,得到了受体R分别与不同倍数的氟离子在DMSO-d6(c=2.0 mM)中的1H NMR谱图。加入氟离子之前,受体R中OH质子的δ分别位于11.90和15.70。通过向受体R中逐渐加入氟离子,可以观察到芳香环上的氢原子信号向高场发生位移且OH质子信号逐渐减弱甚至消失。当加入1 eq.氟离子时,δ11.90处OH质子信号彻底消失,说明受体与氟离子以比例1/1形成氢键。将氟离子的用量增加到5 eq.时,δ15.70处OH质子信号强度下降,这主要是由于过量的氟离子与另外一个OH形成氢键所致。此外,逐渐增多氟离子用量时(0~5 eq.),受体R中芳环氢均发生不同程度的高场位移现象,如δ7.2处芳香氢位移至δ6.9,这主要是由于受体中羟基与氟离子形成氢键以后,p-π共轭体系形成的场效应使整个分子发生负电荷转移,从而引起苯环上电子云密度增大,致使芳香氢化学位移减小[24]。

δ图4受体R在DMSO-d6中的F-核磁滴定图Figure 4 1H NMR titration of receptors R with F- in DMSO-d6
2.4 识别机理研究
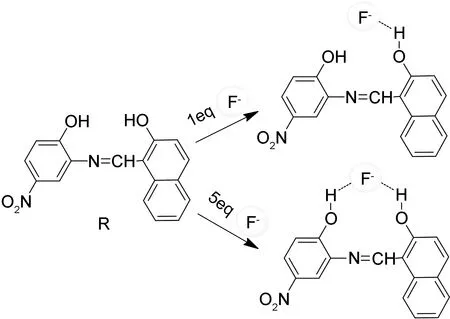
R/R+F图5受体R对F-可能的识别机理和Job曲线Figure 5The possible binding mode receptor R with F- and the stoichiometry analysis of receptor 1 by Job’s plot with F- in the CH3CN solution