外源激素对日本落叶松体细胞胚发生不同阶段的影响*
2021-03-13吴晓雪张艾婧蒋湘宁
吴晓雪 张艾婧 盖 颖 蒋湘宁
(北京林业大学生物科学与技术学院 北京 100083)
体细胞胚胎发生具有繁殖系数高和植株再生率高以及不受季节限制等特点,是落叶松(Larix)遗传改良的有利工具。近年来,由于日益严重的环境问题损害了落叶松的生长环境,导致落叶松在我国适宜的生长范围不断缩小,并且已经出现了落叶松等木材的生产供应短缺等问题。因此,利用落叶松的体细胞胚发生技术进行遗传改良从而繁育出具有良好的环境适应性的落叶松具有重要意义。Aderkas等(1987)首次用欧洲落叶松(Larixdecidua)雌配子体为外植体在LM基本培养基上诱导出胚性胚柄团,诱导率达90%,但未获得植株再生;Klimaszewska(1989)利用杂种落叶松(Larix×eurolepis)的原生质体成功诱导出体细胞胚,并获得再生植株;齐力旺(2000)成功诱导出华北落叶松(Larixprincipis-rupprechtii)的体细胞胚。到目前为止,欧洲落叶松、欧日杂种落叶松(Larix×leptoeuropaea)、美洲落叶松(Larixlaricina)、西方落叶松(Larixoccidentalis)、日本落叶松(Larixkaempferi)、华北落叶松、新疆落叶松(Larixsibirica)等落叶松属树种均已成功诱导出体细胞胚(Korlachetal., 1995; Lelu-Walteretal., 2009; Klimaszewskaetal., 1997; Thompsonetal., 1992; 吕守芳等, 2005; 齐力旺, 2000; Belousovaetal., 2008)。但是,落叶松体细胞胚胎发生仍然存在很多问题,例如胚性胚柄团的诱导受外植体类型的限制(仅子叶前期的未成熟合子胚诱导胚性胚柄团的效果好)、胚性胚柄团增殖率低、体细胞胚成熟率低等,并且悬浮细胞培养作为一种可以有效获得快速增殖的胚性胚柄团的培养方式,目前在落叶松属植物中的研究仍然非常有限(宋跃等, 2018; 吕守芳等, 2005)。
合适的外源激素可以有效提高胚性胚柄团和悬浮细胞的增殖率,提高成熟子叶胚的数量。2,4-D(2,4-二氯苯氧乙酸)、6-BA(6-苄基腺嘌呤)、ABA(脱落酸)、IAA(吲哚-3-乙酸)、GA3(赤霉素)是植物体细胞胚发生过程中常用的激素。胚性胚柄团的增殖和悬浮细胞培养通常将2,4-D和6-BA配合使用,已有研究证实2,4-D和6-BA的相互作用可以有效维持细胞内在环境的稳定,从而影响胚性胚柄团的增殖和悬浮细胞的生长(崔凯荣等, 2017)。但王伟达等(2008)发现6-BA对杂种落叶松(Larixkaempferi×L.olgensis)胚性胚柄团增殖的影响并不显著。另外,除2,4-D和6-BA这2种激素,齐力旺(2000)还发现在胚性胚柄团增殖阶段添加少量的ABA有助于胚性的保持。在体细胞胚诱导与成熟阶段,ABA与PEG(聚乙二醇)和AgNO3的组合使用可以为体细胞胚发生提供合适的脱水环境和气态环境,但是部分诱导出的体细胞胚无法发育为正常的子叶胚;进一步的研究发现内源IAA和GA3可以有效调节体细胞胚向成熟子叶胚的正常发育(孙丹等, 2013),而外源IAA和GA3是否具有相同的作用还有待进一步验证。
外源激素对体细胞胚发生的影响十分复杂,因此本研究以日本落叶松胚性胚柄团为材料,研究外源激素对胚性胚柄团增殖和悬浮细胞生长的影响,IAA、GA3对体细胞胚诱导与成熟的影响。试验结果为通过调节外源激素的方式促进胚性胚柄团增殖、悬浮细胞生长和体细胞胚发生提供数据支持,为落叶松的规模化繁育奠定基础。
1 材料与方法
1.1 试验材料
以实验室保存的生长状态良好、外观白嫩的日本落叶松胚性胚柄团为试验材料。胚性胚柄团由子叶前期的未成熟合子胚诱导而来。供试胚性胚柄团诱导培养基:1/2DCR(含谷氨酰胺400 mg·L-1+水解酪蛋白500 mg·L-1+蔗糖30 g·L-1);凝固剂:琼脂 5 g·L-1;外源激素:2,4-D 1.5 mg·L-1+6-BA 0.50 mg·L-1。培养条件:(24±1)℃,暗培养。
1.2 胚性细胞生长曲线的绘制
1.2.1 胚性胚柄团增殖的生长曲线 首先将生长状态良好的约0.5 g胚性胚柄团接种至1/2DCR+2,4-D 0.15 mg·L-1固体增殖培养基上,(24±1)℃,暗培养。在每个培养皿中接种3块,每次3皿,每2天测定1次鲜质量,试验重复3次,以绘制日本落叶松胚性胚柄团的生长曲线。然后,用FDA(荧光素双醋酸酯)染色观察对数期胚性胚柄团在光学显微镜下的活性和细胞的形态结构。
1.2.2 悬浮细胞培养的生长曲线 先将生长状态良好的约1 g胚性胚柄团按质量体积比0.25%接种至1/2DCR+2,4-D 0.15 mg·L-1液体培养基中,(24±1)℃,黑暗条件下120 r·min-1震荡培养。接着每2天测定1次鲜质量,试验重复3次,绘制日本落叶松悬浮细胞的生长曲线。最后,用FDA染色观察对数期悬浮细胞在光学显微镜下的活性和细胞的形态结构。
1.3 体细胞胚诱导与成熟
首先将胚性胚柄团接种至1/2DCR+ABA 20 mg·L-1+AgNO310 mg·L-1+PEG4000 120 g·L-1固体体细胞胚诱导培养基中,(24±1)℃,暗培养。然后,在光学显微镜下观察诱导出的体细胞胚在各发育时期的形态,培养42天后得到成熟子叶胚。
1.4 胚性胚柄团增殖培养中2,4-D、6-BA、ABA浓度的选择
选择2,4-D、6-BA、ABA各 3个浓度采用正交设计L9(34)(表1)进行试验。首先将约0.5 g胚性胚柄团接种至含不同激素组合(表1)的1/2DCR固体培养基中,每个培养皿中接种3块,每次3皿,(24±1)℃,暗培养。然后根据1.2.1生长曲线结果在接种后7、14、21天分别对胚性胚柄团称重,统计鲜质量变化。最后将在9个处理下(表1)增殖培养14天的胚性胚柄团称重后转接到1.3中固体体胚诱导培养基(1/2DCR+ABA20 mg·L-1+AgNO310 mg·L-1+PEG4000 120 g·L-1)中,42天后统计每g胚性胚柄团成熟子叶胚的数量。以上试验均重复3次。
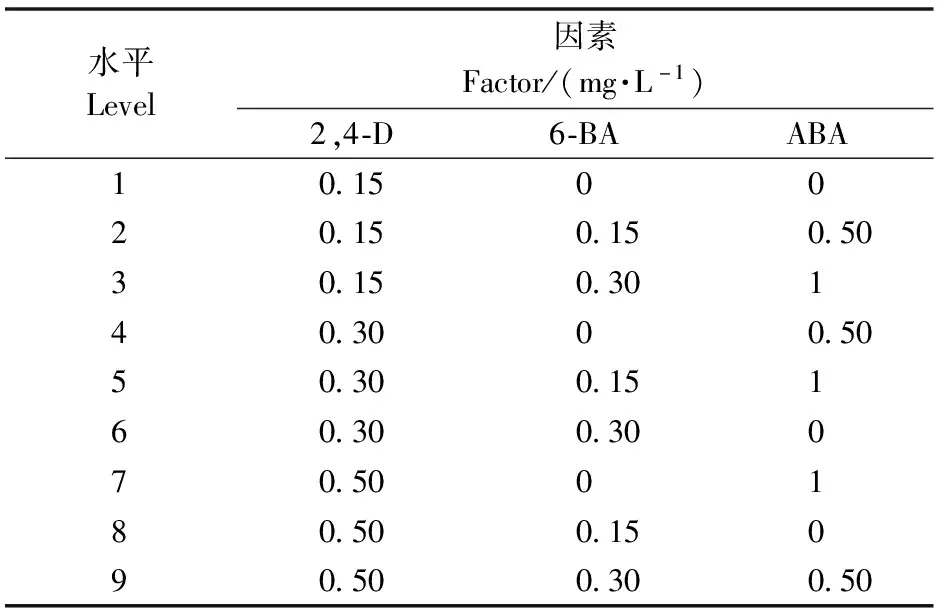
表1 日本落叶松胚性胚柄团增殖培养正交试验因素及水平L9(34)
1.5 悬浮细胞培养中2,4-D、6-BA浓度的选择
选择2,4-D、6-BA各3个浓度采用析因设计(表2)进行试验。先将约1 g胚性胚柄团按质量体积比0.25%接种至含2,4-D和6-BA不同浓度组合(表2)的1/2DCR液体培养基中,(24±1)℃,黑暗条件下120 r·min-1震荡培养。再根据1.2.2生长曲线的结果取培养7、14、21天的悬浮细胞测定细胞鲜质量。最后,将在9个处理(表2)下培养14天的悬浮细胞称重后转接到1.3中固体体胚诱导培养基(1/2DCR+ABA20 mg·L-1+AgNO310 mg·L-1+PEG4000 120 g·L-1)上,42天后统计每g悬浮细胞的成熟子叶胚的数量。以上试验均重复3次。
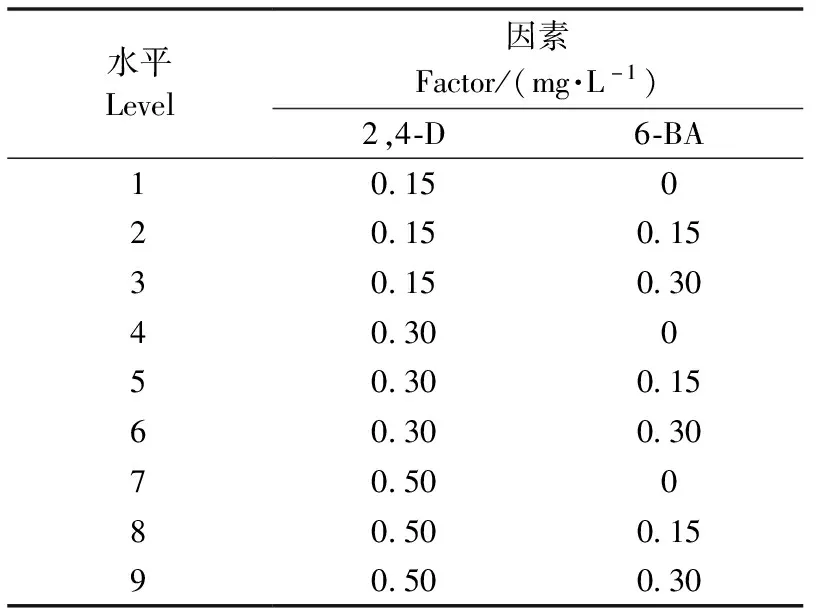
表2 日本落叶松悬浮细胞培养试验因素及水平
1.6 体细胞胚诱导与成熟中GA3、IAA浓度的选择
将胚性胚柄团称重后接种在分别添加0、10、20、30、40 mg·L-1的GA3和IAA的固体体胚诱导培养基(1/2DCR+ABA 20 mg·L-1+AgNO310 mg·L-1+PEG4000 120 g·L-1)中,每个培养皿中接种3块,每次3皿,(24±1)℃,暗培养。以添加0 mg·L-1的GA3和IAA分别作为对照组,培养42天后统计每g胚性胚柄团成熟子叶胚的数量,研究GA3和IAA对体细胞胚诱导与成熟的影响,试验重复3次。
1.7 数据统计
每g胚性胚柄团成熟子叶胚的数量=成熟子叶胚的数量/诱导前胚性胚柄团鲜质量;
每g悬浮细胞成熟子叶胚的数量=成熟子叶胚的数量/诱导前悬浮细胞鲜质量。
数据采用SPSS软件对胚性胚柄团生长曲线、悬浮细胞生长曲线、GA3和IAA对体细胞胚发生的影响进行单因素方差分析;对正交设计和析因设计试验结果进行多因素方差分析,LSD法对分析结果进行多重比较。
2 结果与分析
2.1 胚性细胞的生长曲线
日本落叶松胚性胚柄团增殖和悬浮细胞培养均符合Logistic函数,生长曲线呈“S”型(图1)。胚性胚柄团增殖在前8天内为延迟期,8~16天内为对数期,16天后进入平台期(图1A)。对数期的日本落叶松胚性胚柄团呈现白色半透明状(图2A),FDA染色后的胚性胚柄团置于光学显微镜下观察到有绿色荧光产生(图2B),这证明胚性胚柄团具有较好的细胞活性,通过观察还发现胚性胚柄团的细胞团排列紧密并且具有由胚柄细胞及其顶端胚团细胞组成的原胚团结构(图2B)。悬浮细胞的生长曲线与胚性胚柄团相似,悬浮细胞生长在前8天内为延迟期,8~18天内为对数期,18天之后是平台期(图1B)。对数期悬浮细胞在培养基内均匀分布(图2F),将悬浮细胞用FDA染色后在光学显微镜下观察到有绿色荧光(图2G),证明对数期悬浮细胞具有较好的细胞活性;悬浮细胞的细胞形态结构与胚性胚柄团不同,悬浮细胞的细胞团排列松散,虽同样具有原胚团结构,但是部分胚柄细胞与顶端胚团细胞发生分离,且细胞更加饱满(图2G)。
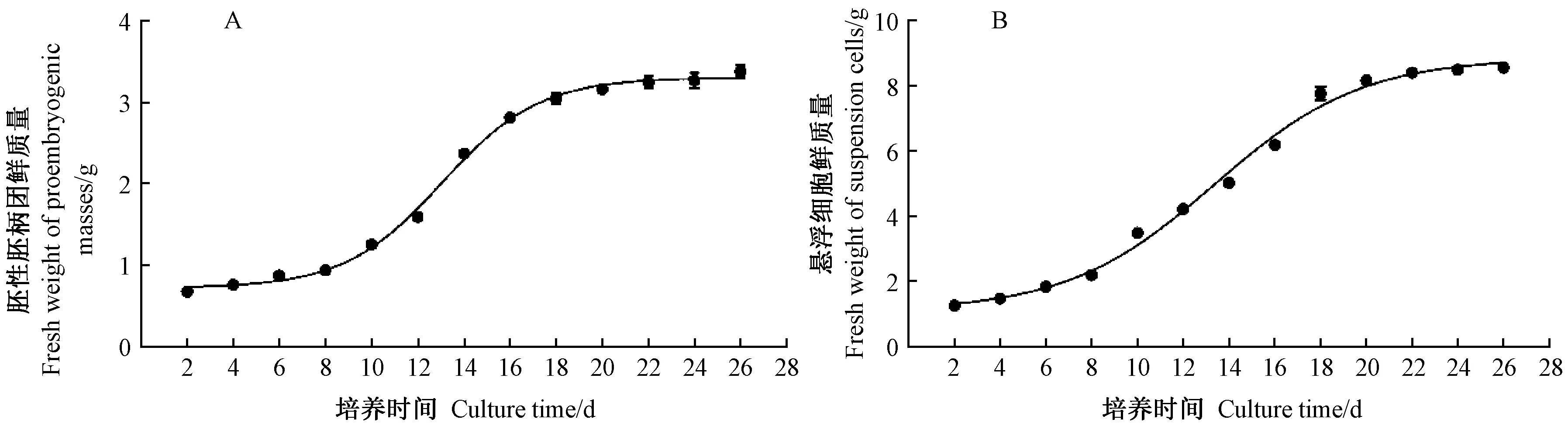
图1 日本落叶松胚性细胞鲜质量生长曲线
根据以上结果可以选择7、14、21天3个时间点分别代表胚性胚柄团增殖和悬浮细胞生长的延迟期、对数期和平台期。虽然对数期的胚性胚柄团和悬浮细胞的形态略有差异,但二者都具有较好的细胞活性和原胚团结构,具备体细胞胚发生的潜力。因此,胚性胚柄团增殖和悬浮细胞培养具有进一步研究的价值,胚性细胞增殖曲线的建立为后续研究外源激素对胚性胚柄团增殖和悬浮细胞培养的影响提供了依据。
2.2 体细胞胚诱导与成熟
诱导出的体细胞胚先经历球形胚早、中、晚期(图2 C-E)再经历子叶胚早、中、晚期(图2 H-J)的发育,最终形成成熟子叶胚。早期球形胚在接种1~5天形成,这一时期的体胚具有光滑的圆丘状突起,胚头部分呈淡黄色(图2C);中期球形胚在接种5~14天形成,体胚体积增大,颜色加深(图2D);晚期球形胚在接种14~21天形成,胚的顶部光滑并且略显凹陷(图2E)。早期子叶胚在接种21~28天形成,胚顶端出现子叶结构(图2H);中期子叶胚在接种28~35天形成,此时体胚子叶伸长(图2I);接种35~42天,形成晚期子叶胚,体胚子叶逐渐张开(图2J),然后逐渐发育为成熟子叶胚。经历42天的培养,体细胞胚经一系列形态变化后最终发育成熟。
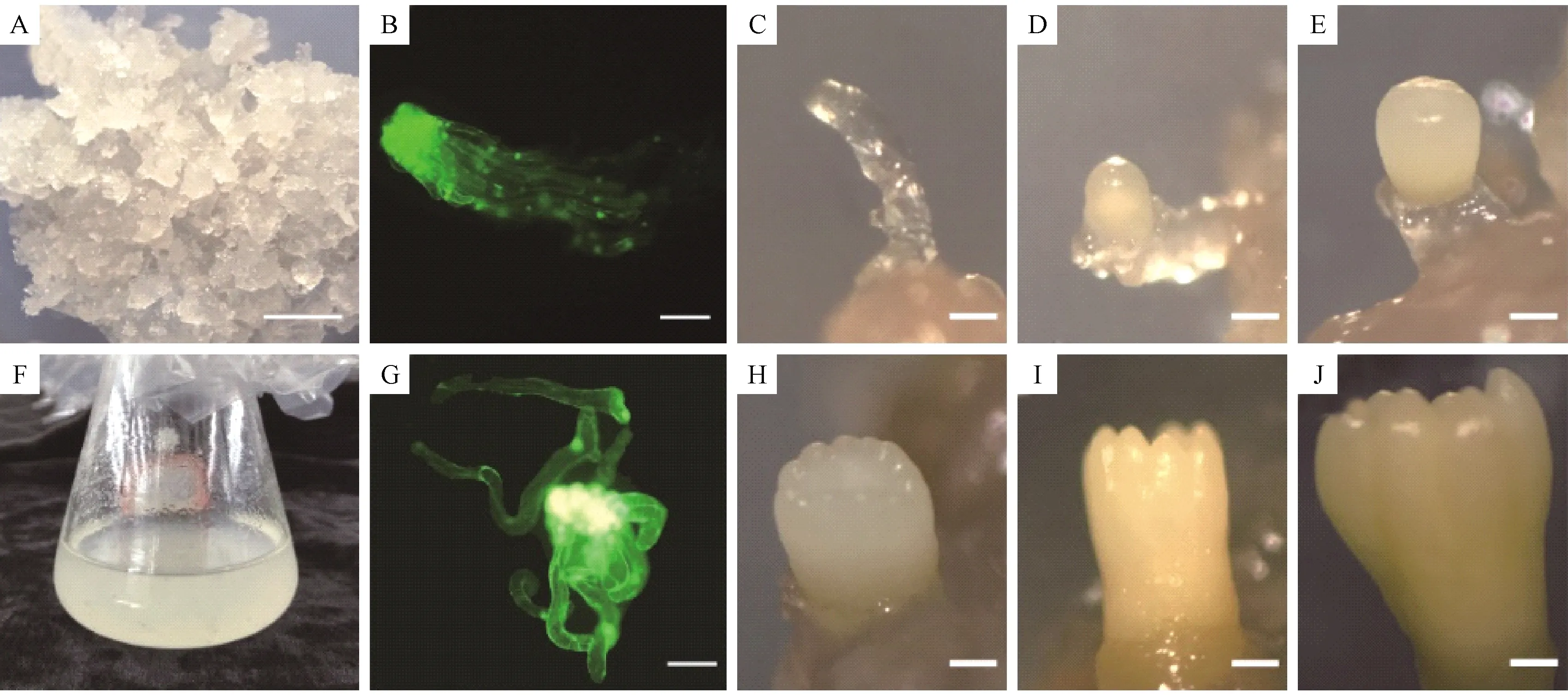
图2 日本落叶松体细胞胚发生过程的形态学观察
2.3 2,4-D、6-BA、ABA对胚性胚柄团增殖的影响
根据生长曲线结果分析第7、14、21天所代表的延迟期、对数期、平台期的正交设计试验结果。首先由图3A可知7~21天胚性胚柄团的鲜质量随着培养时间增加总体呈增加趋势,2,4-D 0.15 mg·L-1(水平1)与原始生长曲线符合并且是第14天(对数期)时鲜质量最高的组合。图中的各个水平在第14天均低于水平1,可能是6-BA和ABA与2,4-D组合抑制了鲜质量的增长,甚至有些组合改变了胚性胚柄团鲜质量的生长曲线。根据表3结果可以发现2,4-D、6-BA、ABA对胚性胚柄团在第7、14、21天增殖的影响均显著(P<0.05),且7、14、21天的极差分析结果表明影响胚性胚柄团增殖因素的主次顺序为2,4-D>6-BA>ABA。此外,对数期是胚性胚柄团旺盛生长的阶段,表3结果还表明在14天最佳的组合为2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1,这与图3A结果不一致。因此,为验证最佳激素浓度,将0.5 g胚性胚柄团在含2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1(记为水平10)培养基和2,4-D 0.15 mg·L-1(水平1)的培养基上同时接种,试验结果证实第14天(对数期)时水平10鲜质量为2.63 g,高于水平1的2.46 g,因此增殖培养基含2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1时最有利于鲜质量增长。
得到上述结论后,进一步验证激素对胚性胚柄团体胚发生能力的影响。图3B结果表明在不同激素组合的增殖培养基中增殖14天的胚性胚柄团再转接至体胚诱导培养基中诱导体胚,体胚发生能力差异显著(P<0.05),2,4-D 0.15 mg·L-1(水平1)培养的胚性胚柄团体胚发生能力最好。根据极差结果首先获得影响体胚发生能力的因素主次顺序为2,4-D>6-BA>ABA,然后据均值的结果得到了在试验限定范围内最优水平为2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1(表3)。表3最优水平的结果与图3B结果不同,为了进一步验证,将同时接种在2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1(记为水平10)培养基和2,4-D 0.15 mg·L-1(水平1)培养基的14天的胚性胚柄团转接到体胚诱导培养基中培养42天,结果表明胚性胚柄团在2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1(水平10)增殖培养后诱导的成熟子叶胚数量为每g 104.38个,高于99.47个(水平1),因此选择含2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1的增殖培养基有利于体细胞胚发生。体胚发生能力的试验结果与鲜质量结果一致,综合2个试验,选择2,4-D 0.15 mg·L-1+ABA 0.50 mg·L-1为胚性胚柄团增殖的最佳激素组合。
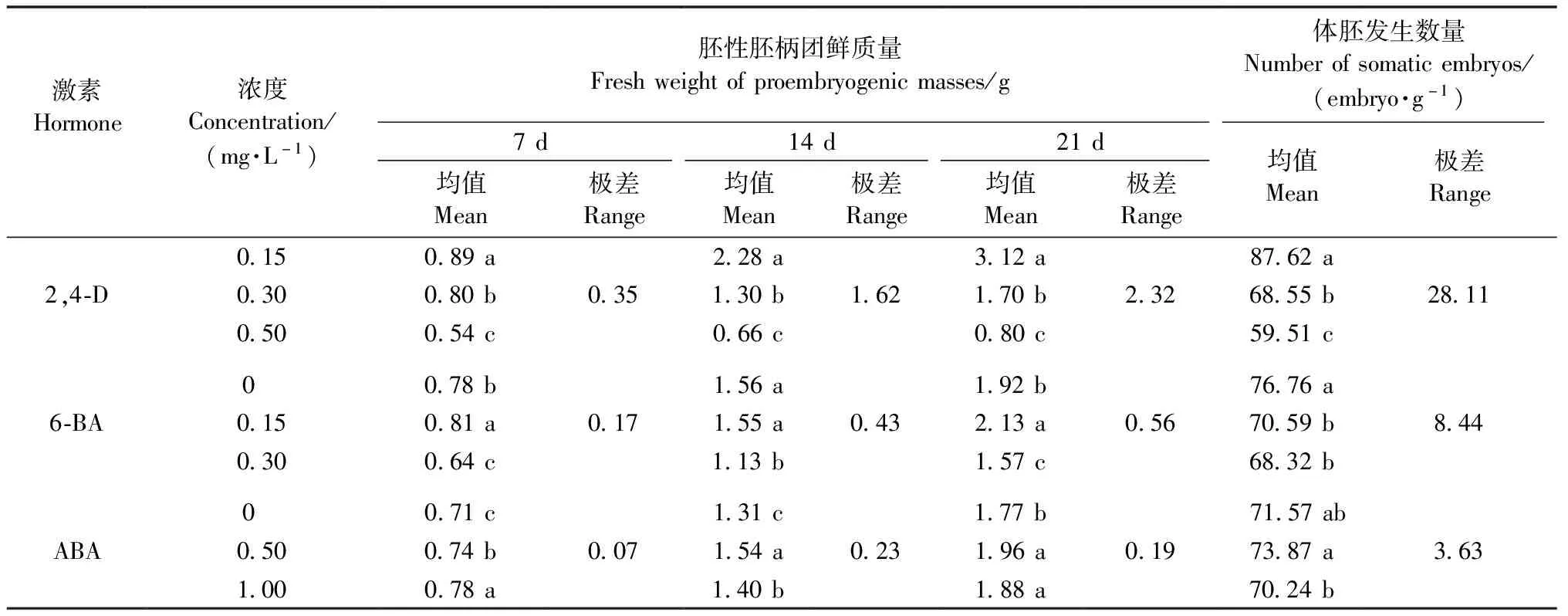
表3 外源激素对日本落叶松胚性胚柄团增殖和体胚发生的影响①
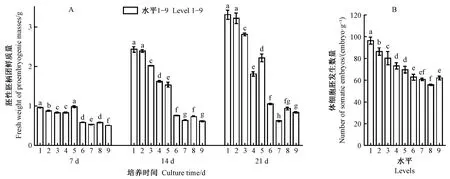
图3 不同激素处理的日本落叶松胚性胚柄团的增殖及体胚发生
2.4 2,4-D、6-BA对悬浮细胞生长的影响
根据生长曲线分析第7天、14天、21天所代表的延迟期、对数期、平台期的析因设计试验结果。据图4A结果首先可知7~21天悬浮细胞的鲜质量随时间增加总体呈增加趋势,其次虽然2,4-D 0.15 mg·L-1(水平1)与原始生长曲线符合,但是在第14天时2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1(水平2)的鲜质量最高。与水平1相比,水平2的鲜质量在第7天和第14天高于水平1,第21天时与水平1没有显著差异,并且因为水平2的鲜质量在第14天远低于其在第21天的鲜质量,所以水平2在14天仍处于对数期,这可能是由于水平2中6-BA与2,4-D配合使用促进了细胞鲜质量的增加。此外,由表4发现2,4-D和6-BA对悬浮细胞在14天时的鲜质量增长影响显著(P<0.05),且根据极差结果影响作用表现为2,4-D>6-BA。根据均值结果,14天最优组合为2,4-D 0.15 mg·L-1+6-BA 0.30 mg·L-1,这与图4A中水平3浓度一致,但在图5中水平3鲜质量低于2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1(水平2),因此14天最佳激素组合为2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1。表4与图4A结果的差异可能是由于均值的估算结果是以不考虑激素间的交互作用和主次顺序为前提进行的。
在得到有利于悬浮细胞鲜质量增长的激素组合后,研究不同激素处理14天的悬浮细胞在同一体胚诱导培养基条件下的体胚发生能力。根据图4B结果发现不同激素处理14天的悬浮细胞体胚发生能力差异显著(P<0.05),2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1(水平2)培养的悬浮细胞体胚发生能力最好。根据表4极差结果首先可以得到影响悬浮细胞体细胞胚发生的主次顺序为2,4-D>6-BA。然后,表4的均值结果表明在试验限定范围内最优水平为2,4-D 0.15 mg·L-1+6-BA 0.30 mg·L-1,这一激素组合与图4B中水平3一致。在图4B中2,4-D 0.15 mg·L-1+6-BA 0.30 mg·L-1(水平3)低于2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1(水平2),因此2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1有利于悬浮细胞的体细胞胚发生。综合鲜质量和体胚发生能力的结果,认为悬浮细胞培养最佳激素组合为2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1。
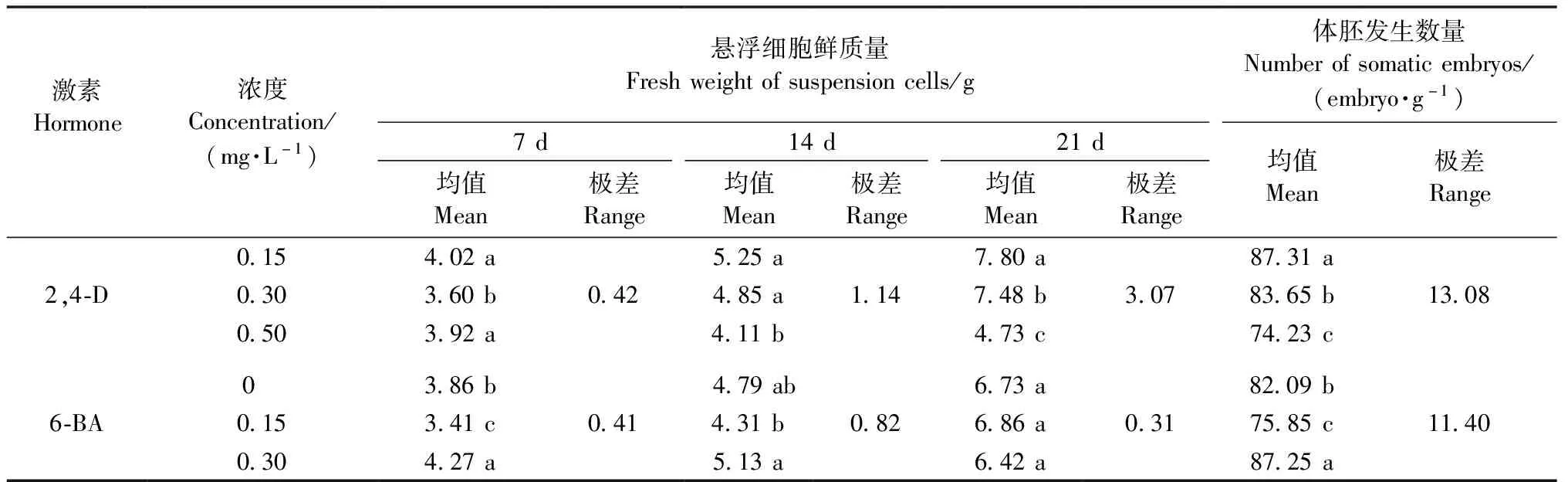
表4 外源激素对日本落叶松悬浮细胞鲜质量及体胚发生的影响
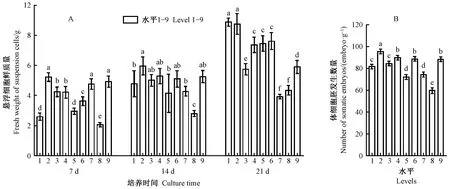
图4 不同激素处理的日本落叶松悬浮细胞的鲜质量及体胚发生
2.5 GA3、IAA对体细胞胚诱导与成熟的影响
GA3和IAA对成熟子叶期体细胞胚数量的影响显著(P<0.05)(图5A、B),添加10~20 mg·L-1GA3或IAA时诱导出的成熟子叶胚数量显著升高,但高水平的IAA和GA3会使体胚发生受到抑制。因此,添加 10~20 mg·L-1GA3或IAA 进行体细胞胚诱导与成熟为最佳选择。
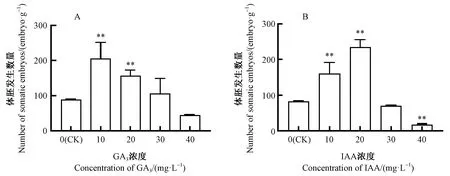
图5 外源激素对日本落叶松成熟子叶期体细胞胚数量的影响
3 讨论
3.1 外源激素与胚性胚柄团的增殖
2,4-D和6-BA是胚性胚柄团增殖培养中常用激素,这2种激素可以通过对细胞周期的调控来调节细胞分裂从而影响胚性胚柄团鲜质量(Tangetal., 2004; 宋建, 2008; Biswasetal., 2019)。另外,增殖培养中2,4-D和6-BA的配合使用还可以调控体细胞胚内储藏蛋白质的积累、氮代谢和IAA水平等方面,从而影响胚性胚柄团的体胚发生能力(王伟达等, 2008; 宋建, 2008)。王伟达等(2008)发现在含有2,4-D 0.10 mg·L-1+6-BA 0.10 mg·L-1+KT 0.05 mg·L-1的BM培养基中培养的杂种落叶松(Larixkaempferi×L.olgensis)的增殖率最高,胚性胚柄团的增殖速率随2,4-D浓度的升高而降低,6-BA的浓度对胚性胚柄团增殖的影响不明显。在本研究中2,4-D浓度在0.15 mg·L-1时日本落叶松胚性胚柄团鲜质量在对数生长期最高,在0.50 mg·L-1时胚性胚柄团鲜质量较低,而6-BA浓度在0~0.15 mg·L-1时胚性胚柄团鲜质量差异不显著。
ABA作为一种重要的植物激素,参与调节落叶松的体细胞胚发生。有研究认为ABA与胚性能力的启动或表达有关(Kanniahetal., 1987),在增殖阶段添加外源ABA不仅可以使内源游离氨基酸和蛋白质含量发生变化,提高胚性胚柄团的胚性(Ronaldetal., 1990),还可以通过调控内源生长素的合成及细胞周期蛋白的表达来影响细胞分裂(Wangetal., 2008; 袁冰剑等, 2014)。在华北落叶松胚性胚柄团增殖研究中,在S+B培养基中加入0.10 mg·L-1ABA,加快了胚性胚柄团的增殖(齐力旺, 2000),但后续有关ABA对落叶松胚性胚柄团在增殖过程中体细胞胚发生能力影响的研究和应用较少。在本研究中发现添加ABA 0.50 mg·L-1可以提高日本落叶松胚性胚柄团对数期的鲜质量,显著影响了胚性胚柄团的增殖和体细胞胚发生能力。
本研究结果表明了ABA对胚性胚柄团的增殖影响显著,而在增殖过程中所需要的2,4-D均处于较低浓度,这一结果与齐力旺(2000)和王伟达等(2008)的研究结果一致。但是,试验得到的具体浓度有所不同,这可能是由于多种原因导致的。首先,试验中使用的基本培养基存在差异,本试验中使用的培养基为1/2DCR培养基,而王伟达等(2008)和齐力旺(2000)使用的培养基分别为BM培养基和S+B培养基,不同培养基会对胚性胚柄团的增殖产生影响(梁文斌等,2011)。其次,落叶松属不同种之间存在着物种差异性,所研究的树种不同导致胚性胚柄团对激素的响应不同(张海峰, 2016)。此外,本研究在试验中选择的几种激素较以往有所差异,王伟达等(2008)在增殖培养基中添加了KT而非本试验中的ABA,由于激素间存在复杂的相互作用(袁晶等,2005;Vanstraelenetal.,2012),这一条件的不同可能也会影响了其他激素最合适的用量,导致试验结果存在差异。过去对于胚性胚柄团增殖的研究,通常只测定其鲜质量的变化,本研究中补充了胚性胚柄团的体细胞胚发生能力受激素的影响,并在结果中发现有利于体胚发生和鲜质量增加的激素浓度一致,但此研究结果仅限于日本落叶松,在落叶松属其他种中有利于体胚发生和鲜质量增加的激素浓度是否与此一致尚需通过试验来进一步确定。
3.2 外源激素与悬浮细胞培养
悬浮细胞培养中适宜的激素水平是实现细胞连续稳定增殖的前提。2,4-D和6-BA对悬浮细胞生长调控的机制与对胚性胚柄团增殖的机制相似(Tangetal., 2004; 宋建, 2008; Biswasetal., 2019; 王伟达等, 2008; 夏启中等, 2005a; 2005b; Heetal., 2018)。唐巍等(1996)在含有 2,4-D 1 mg·L-1+6-BA 0.50 mg·L-1+ IBA 0.20 mg·L-1的DCR液体培养基中培养出火炬松(Pinustaeda)悬浮细胞。宋跃等(2018)在2,4-D 0.15 mg·L-1+6-BA 0.05 mg·L-1+KT 0.05 mg·L-1的BM培养基中成功获得了长白落叶松(Larixolgensis)和2种杂种落叶松胚性悬浮细胞,但并未研究外源激素对悬浮细胞的影响。本试验中发现日本落叶松悬浮细胞在2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1增殖培养基培养14天后对数期的鲜质量最高,再转入体细胞胚诱导培养基体细胞胚发生能力最高。
本研究得到的2,4-D和6-BA浓度与唐巍等(1996)的结果差异较大,约是其使用外源激素水平的1/10,而与宋跃等(2018)所使用的外源激素总体水平相近;造成这一现象的主要原因应是物种间的差异,宋跃等(2018)培养的悬浮细胞同为落叶松属,而唐巍等(1996)培养的是火炬松。此外,本试验中使用的基本培养基和激素与已报道的研究(赵德修等,2000;袁晶等,2005;Vanstraelenetal.,2012)并不完全相同,同样会造成差异的存在。由于本试验仅考虑了2,4-D和6-BA 2种激素对日本落叶松悬浮细胞的影响,得到的试验结果有一定的局限性,因此在后续研究中可以增加如IBA、NAA、KT等其他激素对日本落叶松悬浮细胞的影响,以得到鲜质量增长和体胚发生能力更高的悬浮细胞。
3.3 外源激素与体细胞胚成熟
目前,针对外源GA3和IAA对针叶树体细胞胚发生影响的研究较少。落叶松的体细胞胚诱导同样受物种差异和培养基的影响(宋跃等,2018;孙婷玉等,2019),因此,本试验得到的 GA3和IAA最佳浓度与梁芬(2016)和王俊英等(2001)的结果不同。本研究基于日本落叶松所得的研究结果GA3或IAA 10~20 mg·L-1有利于体细胞胚发生,是否适用于落叶松属其他树种,还需要进一步通过试验来确定。
4 结论
外源激素对日本落叶松胚性胚柄团的增殖、悬浮细胞培养、体细胞胚诱导与成熟具有重要的调节作用。胚性胚柄团的增殖和悬浮细胞的生长均符合“S”型生长曲线,适宜胚性胚柄团增殖和悬浮细胞生长的激素浓度分别为2,4-D 0.15 mg·L-1+ ABA 0.50 mg·L-1和2,4-D 0.15 mg·L-1+6-BA 0.15 mg·L-1,证实了ABA应用于胚性胚柄团增殖阶段的可行性,为胚性胚柄团快速增殖提供了固体增殖培养和悬浮细胞培养2种方式。在体细胞胚成熟阶段,证明了GA3和IAA对日本落叶松体细胞胚成熟的影响,并且证实10~20 mg·L-1GA3或IAA可以显著提高成熟子叶胚的数量,随GA3或IAA浓度升高对体细胞胚发生具有抑制作用。本研究通过研究外源激素对体细胞胚发生的影响,不仅提升了体细胞胚的质量,还为今后研究外源激素调控落叶松体细胞胚发生的生理机制提供了数据支持。
