山新杨钾离子通道基因PdbSKOR的克隆与功能分析*
2021-03-13王力敏陈亚辉杨庆山曲日涛张金池张洪霞宋志忠
王力敏 陈亚辉 杨庆山 曲日涛 姜 姜 张金池 张洪霞 宋志忠,7
(1.鲁东大学农林工程研究院 烟台 264025; 2.南京林业大学林学院 南京 210037; 3.山东省林业科学研究院 济南 250014;4.山东省高等学校重点实验室“作物高产抗逆分子模块育种实验室” 烟台 264025; 5.烟台市农业技术推广中心 烟台 264001;6.海南省南繁生物安全与分子育种重点实验室 海口 570100; 7.剑桥大学植物系 英国剑桥 CB2 3EA)
钾离子(K+)是植物细胞中含量最为丰富的阳离子之一,参与光合作用、气孔运动、蒸腾作用、信号传导和植物抗逆等生命活动。缺钾阻碍植物生长和发育,影响产量和品质(宋志忠等,2015;Lebaudyetal., 2007; Wardetal., 2009; Véryetal., 2014; Wangetal., 2017)。
植物通过根部能从土壤中吸收足量的K+,并有效分配到不同组织部位,进而满足正常的生长和发育(Gaymardetal., 1998; Lebaudyetal., 2007; Wardetal., 2009; Véryetal., 2014; Demidchiketal., 2014; Wangetal., 2017)。前人通过研究根部K+吸收动力学证实了植物体内存在2种K+吸收机制:机制Ⅰ,主要在外界K+浓度低于200 μmol·L-1时起作用,是一个典型的主动吸钾过程,即高亲和K+吸收系统;机制Ⅱ,主要在外界K+浓度高于1 mmol·L-1时起作用,是一个典型的被动吸钾过程,即低亲和K+吸收系统(Epsteinetal., 1963; Kochianetal., 1982; Véryetal., 2003)。特别地,定位于细胞质膜的各类K+通道主要介导植物体内K+的长距离运输和分配,根据蛋白结构特征及功能方式的不同,这些K+通道可分为3大类:Shaker家族通道、TPK家族通道和其他钾离子通道(Gaymardetal., 1998; Lebaudyetal., 2007; Véryetal., 2014; Wangetal., 2017)。其中,Shaker类K+通道是研究最为透彻的,其对K+的亲和常数约在几十mmol,属于典型的高通量、低亲和的K+通道,在植物钾素营养高效中起至关重要的作用(Grabov, 2007; Lebaudyetal., 2007; Wardetal., 2009; Demidchiketal., 2014; Wangetal., 2017)。
自Anderson等(1992)和Sentenac等(1992)分别在拟南芥(Arabidopsisthaliana)中揭示了植物Shaker类K+通道KAT1和AKT1,此后30年内,陆续从不同植物中报道了40多个Shaker类K+通道(Lebaudyetal., 2007; Wardetal., 2009; Hedrich, 2012; Limetal., 2019),包括拟南芥中9个(Hedrich, 2012; Limetal., 2019),马铃薯(Solanumtuberosum)SKT1(Zimmermannetal., 1998),番茄(Solanumlycopersicum)LKT1(Hartjeetal., 2000),胡萝卜(Daucuscarota)KDC1(Downeyetal., 2000)和DKT1(Formentinetal., 2004),玉米(Zeamays)KZM1、KZM2、ZMK1和ZmK2.1(Baueretal., 2000; Philipparetal., 2003; Suetal., 2005; Büchsenschützetal., 2005),水稻(Oryzasativa)OsAKT1、OsKAT1(Otabaetal., 2007; Lietal., 2014)和大麦(Hordeumvulgare)HvAKT1、HvAKT2(Boscarietal., 2009)。根据电压依赖性和K+在跨膜时不同的运动方向,又可将Shaker型K+通道分为3类:内向整流、外向整流和弱向整流(即双向整流)。模式植物拟南芥中,内向整流型的K+通道包括AKT1、SPIK、KAT1和KAT2(Caoetal., 1995;Véryetal., 1995;Gaymardetal., 1996;Pilotetal., 2001;Moulineetal., 2002),外向整流型的K+通道有SKOR和GORK(Gaymardetal., 1998; Acheetal., 2000; Hosyetal., 2003; Corratgé-Faillieetal., 2017; Limetal., 2019),弱向整流型K+通道有AKT2/3(Lacombeetal., 2000;Dreyeretal., 2004)。
特别地,SKOR编码一类外向整流型Shaker型K+通道。模式植物拟南芥中,SKOR通道生理功能的分子机制研究较为详尽:AtSKOR定位于拟南芥根的中柱鞘和中柱薄壁细胞,主要负责将韧皮部的K+分泌到木质部,进而经由木质部实现K+的根-茎长距离运输,同时发现缺失该通道功能可导致地上部含钾量降低约50%,在植物生长发育过程中起重要作用(Gaymardetal., 1998)。近年来,陆续在小花碱茅(Puccinelliatenuiflora)(段丽婕等,2015)、水稻(Kimetal., 2015)、霸王(Zygophyllumxanthoxylum)(Huetal., 2016)、黑果枸杞(Lyciumruthenicum)(刘丽萍等,2018)、甜瓜(Cucumismelo)(Huangetal., 2018)、葡萄(Vitisvinifera)(沈静沅等,2020)等多种植物中报道了SKOR通道基因,且具有相似的蛋白结构特征,有6个跨膜结构域和1个K+通道孔(P-loop),其中最为保守的K+通道标签序列为GYGD(刘丽萍等,2018; Lebaudyetal., 2007; Wardetal., 2009; Huangetal., 2018)。
虽然植物基因数据库中能搜索到少数木本植物中Shaker类K+通道蛋白序列,但是,木本植物SKOR的功能仍然未知。本研究以山新杨(Populusdavidiana×P.bolleana)为材料,克隆PdbSKOR,明确其组织特异表达模式和电生理功能,为研究林木钾素营养高效的分子机制奠定理论基础,并提供基因资源和技术支撑。
1 材料与方法
试验于2017年1月—2019年10月,分别在南京林业大学林木遗传与生物技术省部共建教育部重点实验室、鲁东大学农林作物遗传改良中心和剑桥大学植物系离子运输研究室完成。
1.1 试验材料与胁迫处理
供试材料为南京林业大学林木遗传与生物技术省部共建教育部重点实验室培育的3年生山新杨(雄性株),露地生长,常规田间管理。分别于2019年不同日期采集山新杨盛开期的花(4月25日)、新生展叶(5月9日)、成熟叶片(6月20日)、1年生韧皮部(5月9日)、根(5月9号)、果絮(5月9号)组织材料,在液氮中冷冻后保存于-80 ℃冰箱。非生物胁迫处理所用材料为鲁东大学农林作物遗传改良中心培育的山新杨组培幼苗。根据王壮伟等(2018)的描述进行胁迫处理:在人工气候箱中,将幼苗在1/2MS营养液(Murashigeetal., 1962)预培养3天,然后分别进行缺钾(MS营养基配方中的KH2PO4和KNO3分别用NaH2PO3和NaNO3代替)、高钾(60 mmol·L-1KCl)、干旱(15 g·L-1PEG6000)、低温(4 ℃)处理,每个处理9株幼苗,分别在处理4、24、48、72 h,采集幼苗根部材料,液氮冷冻后保存于-80 ℃冰箱。
1.2 杨树PdbSKOR检索与克隆
以拟南芥AtSKOR(Gene ID: AT3G02850)编码蛋白的序列为参考,在Phytozome毛果杨(Populustrichocarpa)基因组(http:∥www.phytozome.net)中检索获得1个SKOR同源蛋白,下载毛果杨SKORCDS序列后,设计上下游引物(表1),提取山新杨组培幼苗整株总RNA,反转录获得第1链cDNA模板,利用Prime STARTMHS DNA聚合酶(TaKaRa,大连)对山新杨PdbSKOR的CDS进行PCR扩增,下载毛果杨SKOR起始密码子ATG上游2.0 kb的启动子区域的序列,设计上下游引物,PCR扩增山新杨PdbSKOR的启动子区域;扩增产物送生工生物工程(上海)股份有限公司测序验证。利用在线服务器Pfam(http:∥pfam.xfam.org/search)分析PdbSKOR蛋白的功能结构域,利用在线服务器Phyre2(http:∥www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测PdbSKOR蛋白的三级结构。
1.3 14种木本植物SKOR系统发育树
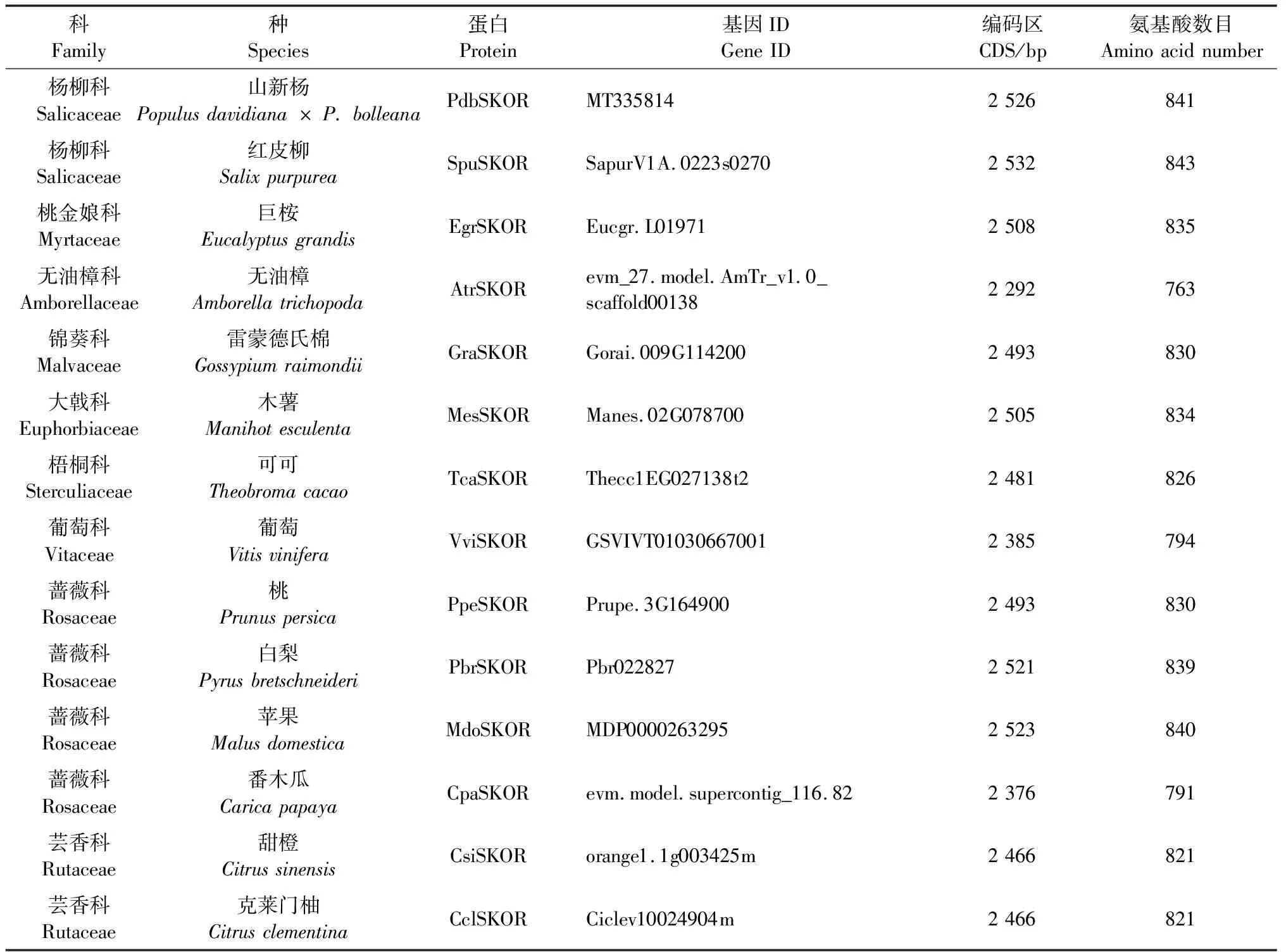
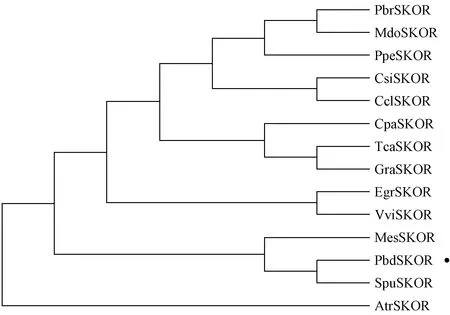
在Phytozome基因组数据库中下载红皮柳(Salixpurpurea)、巨桉(Eucalyptusgrandis)、无油樟(Amborellatrichopoda)、雷蒙德氏棉(Gossypiumraimondii)、木薯(Manihotesculenta)、可可(Theobromacacao)、葡萄、桃(Prunuspersica)、白梨(Pyrusbretschneideri)、苹果(Malusdomestica)、番木瓜(Caricapapaya)、甜橙(Citrussinensis)和克莱门柚(Citrusclementina)13种不同木本植物SKOR同源蛋白的氨基酸序列,利用ClustalX 2.0软件对山新杨和这13种植物同源蛋白SKOR进行氨基酸序列一致性分析,并借助MEGA 7.0软件构建SKOR同源蛋白系统发育树。
1.4 实时荧光定量PCR分析
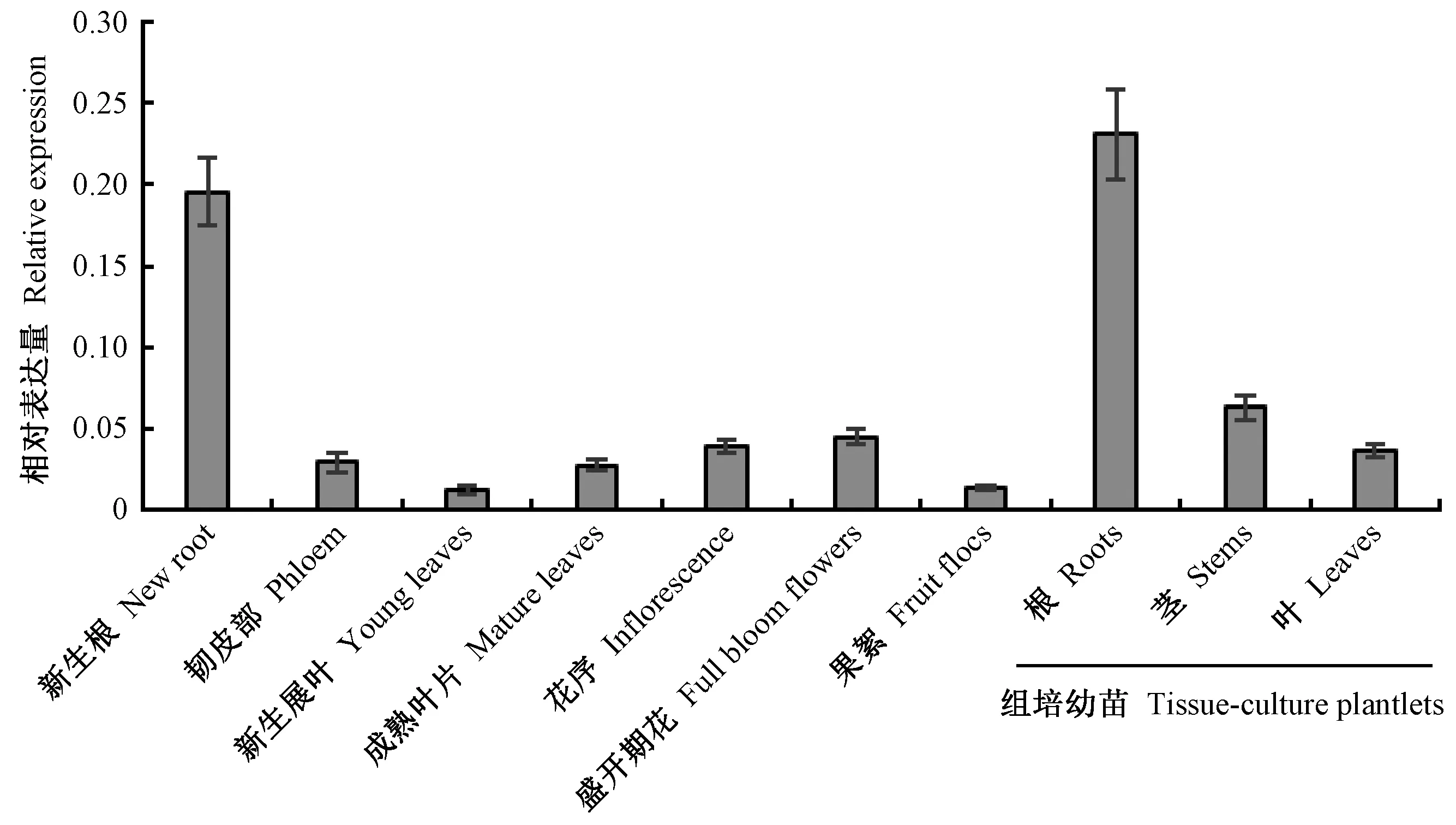
通过MiniBEST Plant RNA提取试剂盒(TaKaRa,大连)分别提取山新杨3年生植株和组培幼苗不同组织的总RNA,利用PrimeScriptTM RT reagent Kit(TaKaRa,大连)试剂盒反转录获得第1链cDNA,作为PCR反应的模板。利用NCBI/Primer-BLAST在线服务器,设计PdbSKOR基因的特异性表达引物(表1),以山新杨EF1β(elongation factor gene)(Yangetal., 2015)作为内参基因,利用SYBR Green荧光染料(TaKaRa,大连),借助ABI 7500荧光定量PCR仪(纽约,美国)进行实时荧光定量PCR,所得的Ct值经内参基因EF1β均一化后,利用2-ΔΔCt法(Livaketal., 2001)计算目的基因的相对表达量。每个样品设置3次生物学重复。
1.5 pTracer-CMV3-SKOR表达载体构建
分析PdbSKOR的限制性酶切位点,设计特异性扩增引物,构建表达载体pTracer-CMV3-SKOR:上游添加KpnⅠ(New England Biolabs,美国)酶切位点,下游添加NotⅠ(New England Biolabs,美国)酶切位点(表1,下划线标注),扩增产物经KpnⅠ/NotⅠ双酶切作用后,利用T4DNA连接酶(New England Biolabs,美国),构建到经由KpnⅠ/NotⅠ双酶切的pTracer-CMV3的多克隆位点中,即重组表达载体pTracer-CMV3-SKOR。

表1 本文所用特异性引物
1.6 膜片钳电生理研究
利用Su等(2005)报道的方法,利用膜片钳系统研究PdbSKOR的电生理功能:以转染pTracer-CMV3空载体作为对照,将浓缩纯化的pTracer-CMV3-SKOR质粒转染HEK293-T细胞(ATCC公司,美国),筛选绿色荧光标记成功的细胞,利用pCLAMP 10.0设备(Axon,美国)采集并记录通道电流信号,借助pCLAMP 10.0软件采集图像和分析数据。每个K+浓度条件下均选择6个细胞作为生物学重复。
1.7 数据显著性分析
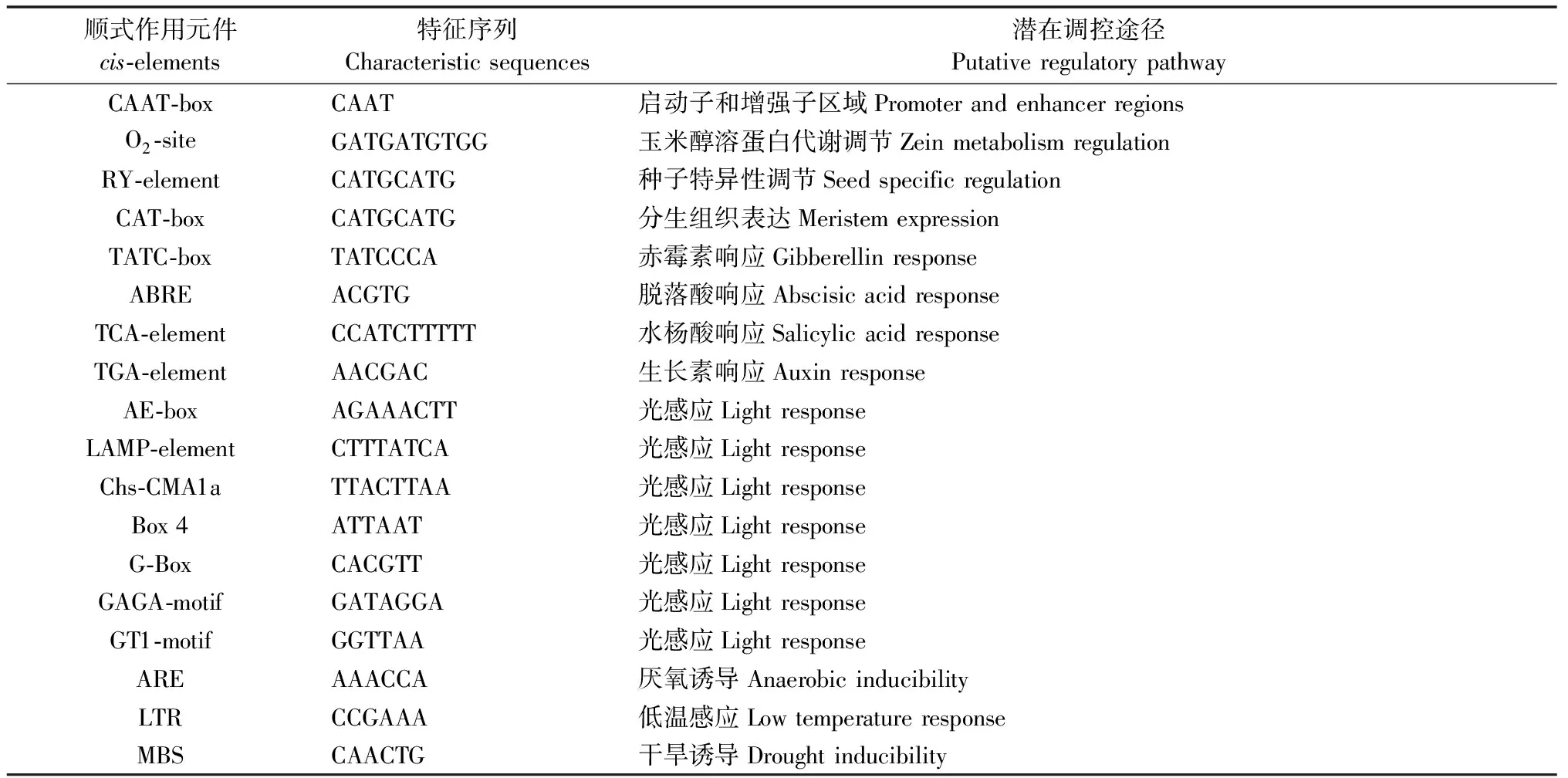
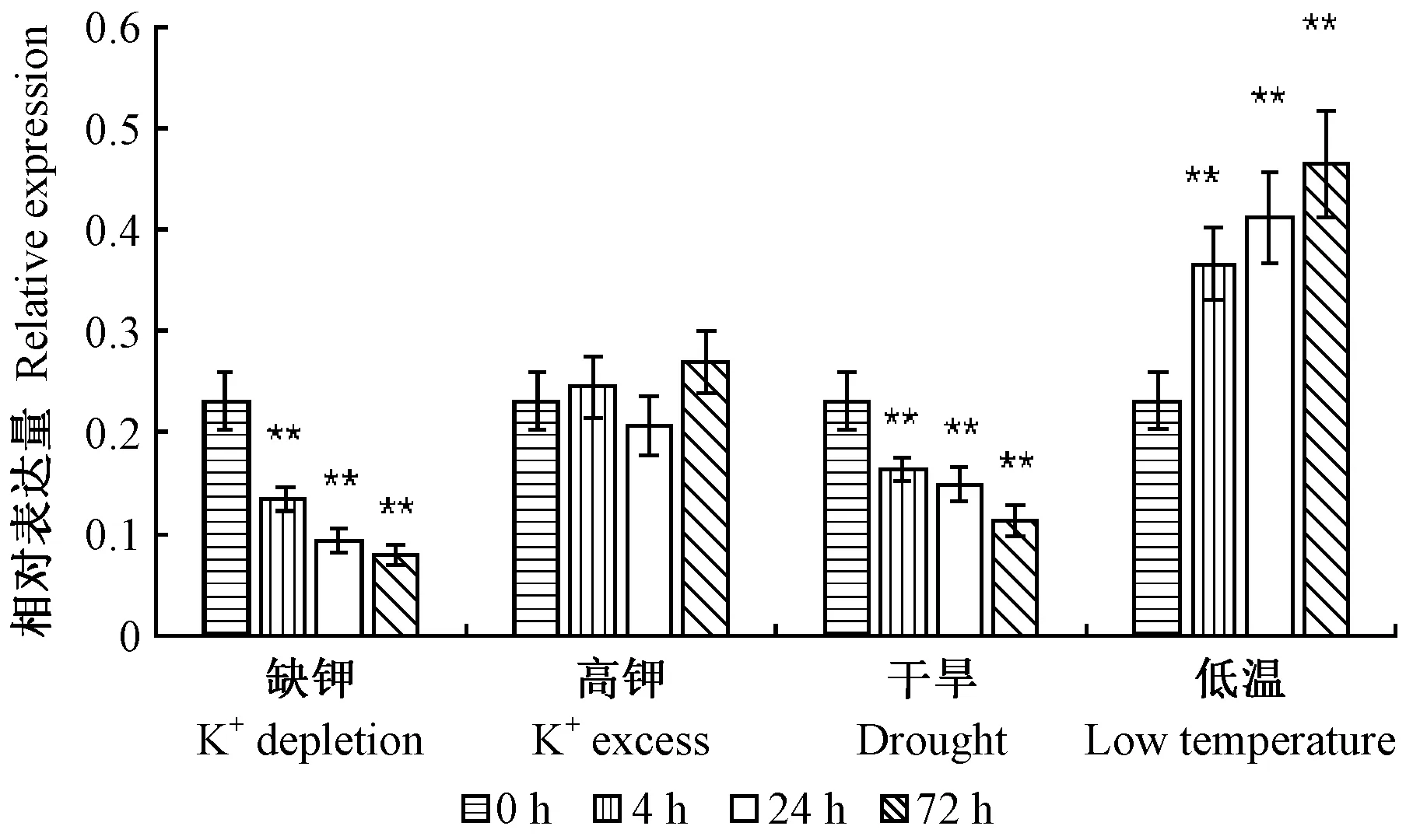
借助SPSS 13.0软件(SPSS Chicago,美国)对全文数据进行显著性分析,在对照和胁迫处理条件下2个独立样品间进行t-检验(*:0.01 以拟南芥AthSKOR(At3g02850)编码序列作为参考序列,在毛果杨基因组数据库中检索到1个同源蛋白SKOR(Potri.017G135400),下载山新杨SKOR基因的CDS序列并设计上下游引物,提取山新杨组培幼苗整株总RNA,反转录获得第1链cDNA模板,PCR扩增山新杨PdbSKOR基因的CDS序列,克隆到pMD19-T载体,转化感受态大肠杆菌(Escherichiacoli)DH5α,筛选阳性克隆子,送生工生物工程(上海)股份有限公司测序,获得山新杨PdbSKOR的CDS序列,含有2 526 bp,编码841个氨基酸,提交NCBI数据库获得GenBank登录号MT335814(表2)。利用Pfam在线服务器在PdbSKOR蛋白中检测到离子通道跨膜域(S1—S6,PF00520)、环核苷酸结合域(cNBD,PF00027)、KHA二聚体结构域(PF11834)和ankyrin锚蛋白域(ANKY,PF12796)等功能结构域(图1),并鉴定了极为保守的通道特征标签序列GYGD,暗示PdbSKOR是一个典型的K+外排型通道。此外,三级结构预测表明山新杨PdbSKOR和红皮柳SpuSKOR具有类似的蛋白质高级结构(图2)。 表2 14种木本植物SKOR蛋白信息 在Phytozome基因组数据库分别鉴定山新杨(杨柳科Salicaceae)、红皮柳(杨柳科)、巨桉(桃金娘科Myrtaceae)、无油樟(无油樟科Amborellaceae)、雷蒙德氏棉(锦葵科Malvaceae)、木薯(大戟科Euphorbiaceae)、可可(梧桐科Sterculiaceae)、葡萄(葡萄科Vitaceae)、桃(蔷薇科Rosaceae)、白梨(蔷薇科)、苹果(蔷薇科)、番木瓜(蔷薇科)、甜橙(芸香科Rutaceae)和克莱门柚(芸香科)14种木本植物的SKOR蛋白,并下载氨基酸序列(表2和图1)。多重氨基酸序列比对结果表明:14种植物SKOR蛋白具有相似的氨基酸序列结构特征,均含有6个保守的跨膜区,即S1—S6,在跨膜区S5和S6之间有1个通道孔P环结构(P-loop),且包含一段极保守的标签序列GYGD(图1);不同科、属植物SKOR蛋白具有较高的相似性,两两物种之间SKOR蛋白氨基酸序列的一致性均高于85%,14种植物SKOR同源蛋白在氨基酸水平仍然具有81.09%的一致性,特别是S1至S6区间,氨基酸序列一致性极高,其中S6跨膜区的一致性最高,达到96%(图1)。 图1 14种木本植物SKOR结构域预测及氨基酸序列一致性分析 系统进化树(图3)分析表明:14种不同科属木本植物的SKOR蛋白在系统进化关系上有较大差异,而同一科属植物在系统进化关系上更倾向于聚在一起。山新杨和红皮柳同为杨柳科植物,山新杨PdbSKOR和红皮柳SpuSKOR系统进化树上距离最为相近,二者又与木薯(大戟科)MesSKOR和巨桉(桃金娘科)EgrSKOR同源蛋白在系统进化树上紧密聚在一起;甜橙和克莱门柚同为芸香科植物,其同源蛋白CsiSKOR和CclSKOR在系统进化树上紧密聚在一起;苹果、白梨和桃同属蔷薇科植物,其同源蛋白MdoSKOR、PbrSKOR和PpeSKOR在系统进化树上更倾向于聚在一起,而同属蔷薇科的番木瓜CpaSKOR却与雷蒙德氏棉(锦葵科)GraSKOR和可可(梧桐科)TcaSKOR在系统进化树上紧密聚在一起;此外,葡萄科VviSKOR和无油樟科AtrSKOR与上述同源蛋白在进化关系上距离较远。 图3 14种木本植物SKOR蛋白的系统进化树 顺式作用元件分析结果表明:PdbSKOR启动子中拥有至少18种顺式作用元件(表3),包括发育调控(种子特异性、玉米醇溶蛋白代谢、分生组织等)、激素响应(赤霉素、脱落酸、水杨酸、生长素等)、胁迫响应(光感应、低温感应、厌氧诱导、干旱诱导等)等不同生命活动相关的调控元件(表3)。 表3 PdbSKOR启动子顺式作用元件 实时荧光定量PCR检测结果表明:PdbSKOR在3年生山新杨多种组织或器官中均有表达,且在不同组织或器官中的相对表达量差异较大,在根部的表达量最高,其次是花中(盛开期花和花序),在茎部、成熟叶片、新生展叶和果絮中的表达水平较低(图4);此外,PdbSKOR在山新杨组培幼苗中根部的相对表达水平也是最高的,在茎部和叶片的表达量相对较低(图4);推测该基因可能主要在山新杨根部钾素营养过程中发挥功能。 图4 PdbSKOR在3年生植株和组培幼苗不同组织中的表达特征 根据顺式作用元件预测及表达分析结果,以山新杨组培幼苗为材料,设置缺钾、高钾、干旱和低温等非生物胁迫处理,并以根部为材料进行实时荧光定量PCR分析,结果表明:PdbSKOR在转录水平对不同非生物胁迫的响应情况存在差异,对缺钾、低温和干旱胁迫最为敏感,而对高钾处理无响应;缺钾和干旱胁迫持续降低PdbSKOR在幼苗根部的表达量,低温处理则持续增强PdbSKOR在幼苗根部的表达量(图5)。 图5 组培幼苗中PdbSKOR对缺钾、高钾、干旱和低温处理的响应 利用膜片钳系统采集和记录pTracer-CMV3-SKOR在胞外不同K+浓度条件下电流与膜电压的特征曲线(图6):转染pTracer-CMV3-SKOR的细胞记录到大量的外向型电流(已扣除空白对照的标准化电流),且随胞外K+浓度的降低而增大,即胞外K+浓度为100 mmol·L-1时,记录到的电流最低,而胞外0 mmol·L-1时,记录到的电流最高;此外,当细胞膜电位于+20 mV时,PdbSKOR通道被激活,出现外向整流电流,且正向电压越大,外向整流的电流越强,是典型的电压依赖型K+通道。因此,膜片钳电生理功能研究表明PdbSKOR是一个典型的电压依赖型的外排型K+通道。 植物SKOR基因编码外向整流型的Shaker类K+通道蛋白,参与调控植物的生长发育过程(Gaymardetal., 1998; Véryetal., 2014)。除拟南芥外,仅有少数其他植物的SKOR基因被鉴定和报道(Véryetal., 2014; Huangetal., 2018)。全世界共有650种杨柳科植物,尚未见任何杨柳科SKOR通道蛋白的报道。近20年来,基因组测序技术为植物科学研究提供了便利。本研究发现山新杨PdbSKOR蛋白拥有植物Shaker类K+通道所特有的功能结构域,特别是GYGD通道标签序列(Véryetal., 2003; 2014)。虽然不同科属木本植物SKOR同源蛋白的核心跨膜区域具有极高的序列一致性(图1),但在遗传进化关系上存在差异(图3),而同一科属植物SKOR同源蛋白的一致性相对较高,在遗传进化距离上也更为相近(图3)。特别地,山新杨PdbSKOR和红皮柳SpuSKOR在所检测木本植物SKOR蛋白系统发育树中紧密聚在一起,二者具有极高的氨基酸序列一致性(94.54%),其中S6跨膜区的一致性达到98.26%,此外,PbdSKOR和SpuSKOR的蛋白质三级结构极其相似。高度相似的氨基酸序列和蛋白结构,暗示二者具有类似的生理功能。因此,解析山新杨PdbSKOR通道的功能,为研究杨柳科SKOR同源蛋白的功能提供了理论依据。 在生理学功能层面,SKOR通道属于典型的Shaker类外向整流型K+通道,已在拟南芥(Gaymardetal., 1998)、甜瓜(Huangetal., 2018)和葡萄(沈静沅等,2020)中利用非洲爪蛙卵和双电极电压钳技术得到证实,而利用膜片钳技术研究SKOR功能的报道少见。本研究借助膜片钳系统揭示山新杨PdbSKOR具有外向整流型K+通道的电流特征:外排型K+电流,通道活性具有电压依赖性且受胞外K+浓度调控(图6),与拟南芥AtSKOR和甜瓜CmSKOR的K+电流特征(Gaymardetal., 1998; Huangetal., 2018; 沈静沅等,2020)类似,但是电流强度、电流与膜电位的关系曲线差异显著,暗示林木类SKOR通道的功能与1年生植物同源蛋白的功能存在较大差异。尽管PdbSKOR通道运输K+的特点和具体调控机理还尚未开展研究,但本文工作为研究木本植物SKOR同源蛋白的功能提供了理论基础和技术支持。 模式植物拟南芥和水稻中,SKOR主要在根中柱鞘细胞中表达(Gaymardetal., 1998; Kimetal., 2015),这些SKOR通道基因所具有的细胞特异性表达模式,可能是通道维持特定功能和植物生长所必不可少的。本研究中,PdbSKOR主要在山新杨根部表达,与在其他植物中的报道(Gaymardetal., 1998; 段丽婕等,2015; Kimetal., 2015; Huetal., 2016; Huangetal., 2018; 沈静沅等,2020)相一致,证实SKOR通道基因主要在植物根部的钾素营养动态中发挥重要作用。 已有研究证实Shaker类型通道在植物K+动态平衡和渗透调节中发挥关键作用,且在转录水平受外界K+浓度、干旱、NaCl、ABA等非生物胁迫的调控(Gaymardetal., 1998; 段丽婕等,2015; Liuetal., 2013; Demidchiketal., 2014; Kimetal., 2015; Huetal., 2016; Huangetal., 2018;Limetal., 2019),但对低温胁迫的响应特征还不清晰。本研究发现,与电生理通道活性受胞外K+浓度调控相一致的是,PdbSKOR在转录水平的表达量也受外界K+浓度调控,缺钾处理显著抑制PdbSKOR的表达水平(图5),这些结果与拟南芥(Gaymardetal., 1998)、霸王(Huetal., 2016)、甜瓜(Huangetal., 2018)和葡萄(沈静沅等,2020)中的报道是相似的。因此推测在缺钾情况下,植物根部没有太多的K+往地上部分运输,进而减少了SKOR通道的需求量,引起SKOR基因表达水平的降低。 本研究中,在山新杨PdbSKOR启动子区域鉴定到干旱诱导和低温感应的顺式作用元件(表3)。PEG6000模拟干旱显著降低PdbSKOR基因在根部的表达量(图5),表明该基因在干旱环境中可能更倾向于停止或降低其在根部转运K+的作用,进而减少干旱胁迫对山新杨根系的毒害,以便维持根系基本生长;低温处理(4 ℃)显著增强PdbSKOR在根部的表达量(图5),推测在低温环境中,PdbSKOR通道活性被诱导而增强了将根部K+向地上部运输的能力,以便在地上部迅速富集较多的K+,保障山新杨地上部的各种依赖K+而必需的生命活动,进而适应和抵抗低温不利环境的影响。这些发现,直接证实SKOR通道的活性易受干旱和低温胁迫的调控,然而,具体机制依然未知。此外,PdbSKOR对高钾处理无响应,暗示山新杨根部SKOR丰度足以维持其在高钾环境中持续发挥作用。综上可知,PdbSKOR主导山新杨根部K+外排,参与维持植物体内钾素动态平衡,并可能在杨树适应干旱和低温胁迫方面发挥作用。 从山新杨中鉴定并克隆了PdbSKOR,它是一个具电压依赖性的外排型K+通道;山新杨PdbSKOR与红皮柳SpuSKOR在进化关系上最近;PdbSKOR主要在山新杨根部表达,并在转录水平受缺钾或干旱的抑制均显著降低,受低温胁迫诱导而显著增强。2 结果与分析
2.1 杨树PdbSKOR的克隆
2.2 14种木本植物SKOR同源蛋白系统发育树

2.3 PdbSKOR启动子顺式作用元件预测
2.4 PdbSKOR的表达模式
2.5 PdbSKOR对不同胁迫处理的响应
2.6 PdbSKOR的电生理功能
3 讨论
4 结论
