以金针菇菌糠为培养基质的猴头菇高效栽培技术*
2021-03-12聂荣荣叶志伟郭丽琼林俊芳
陈 熙,聂荣荣,叶志伟,魏 韬,邹 苑,郭丽琼**,林俊芳**
(1.华南农业大学食品学院生物工程系,广东 广州 510640;2.广东省微生态制剂工程技术研究中心,广东 广州 510640)
猴头菇(Hericium erinaceus)是我国著名的食(药)用菌,其子实体营养丰富并且含有多肽、多酚、萜类等多种天然活性物质,具有很高的营养价值[1-2]。猴头菇的人工栽培开始于20世纪50年代末[3]。目前虽然已掌握猴头菇栽培技术,但实现较大规模生产的企业仍较少,主要是因为猴头菇生长周期长,生物转化率低且缺少高效科学的栽培体系。猴头菇是一种木腐真菌[4],大部分栽培方式仍是以木屑为主料的代料栽培[5],这不仅使得栽培成本高,也对环境资源造成一定的破坏。开发高效廉价的猴头菇栽培料可以扩大猴头菇栽培规模,目前已有学者使用废弃农业副产品,如玉米秸秆、葛根废渣、苹果树枝屑等进行猴头菇栽培,并取得良好的效果[6-8]。
金针菇(Flammulina velutiper)菌糠是指金针菇栽培后的废弃栽培料,其中仍具有很多营养成分未被利用。大部分金针菇菌糠都作为废料焚烧掩埋,容易造成环境污染[9]。滤泥是蔗糖生产的副产物,是蛋白质、果胶质等非糖有机物的沉淀[10],目前对金针菇菌糠和滤泥尚无较好的利用途径,如果将其成功应用于猴头菇的高效栽培中,将具有一定的经济价值和应用前景。
1 材料与方法
1.1 菌种及材料
猴头菇T3菌株,山东寿光食用菌研究所;金针菇菌糠,深圳达利时实业有限公司;愈创木酚,广州天河精科化玻仪器批发部。
猴头菇菌种培养基:马铃薯琼脂培养基(PDA);猴头菇活力检测培养基:玉米芯78%、麸皮20%、石膏1%、蔗糖1%,料水比为1∶1.5。
1.2 试验方法
1.2.1 猴头菇液体菌种制备及活力测定
1)液体菌种制作
将活化好的猴头菇T3固体菌种切成均匀的小块接种于PDA液体培养基中,置于25℃,转速150 r·min-1的摇床中震荡培养8 d后再次接种于PDA液体培养基中,接种量为10%,置于25℃,转速150 r·min-1的摇床中震荡培养8 d。
2)摇瓶培养基选择
猴头菇摇瓶培养基配方见表1。

表1 猴头菇摇瓶培养基配方Tab.1 Formulas of liquid medium of Hericium erinaceus
分别配制表1中各配方培养基,分装于250 mL三角瓶中,每瓶装100 mL,121℃灭菌30 min;每天取各配方培养基3瓶,为3次重复,接种上述PDA液体菌种,接种量10%;连续接种9 d,置于25℃,转速150 r·min-1的摇床中培养,第10天同时取出检测。
3)菌丝活力检测
取不同摇瓶天数的猴头菇液体菌种500 μL,接种于活力检测培养基的平板中间,25℃恒温培养箱中培养72 h,观察培养基中菌丝生长活力。
1.2.2 金针菇菌糠培养基配方的确定
猴头菇子实体生长阶段所需的培养基碳氮比以30∶1~40∶1最适宜[11],根据金针菇菌糠、滤泥、玉米芯、甘蔗渣、麸皮中碳氮含量,设计了碳氮比约为40∶1的6种猴头菇栽培培养基配方进行试验,猴头菇菌糠栽培培养基配方见表2。

表2 猴头菇菌糠栽培培养基配方Tab.2 Formulas of culture medium of Hericium erinaceus
1.2.3 金针菇菌糠培养基配方的优化
为探究最适金针菇菌糠所占比例,设计配方见表3。

表3 金针菇菌糠培养基梯度配方Tab.3 Formulas of culture medium with different appending proportions of waste culture substrate of Flammulina velutiper
如表3所示,以配方S2作为对照,设计金针菇菌糠梯度试验。
1.2.4 培养基中麸皮添加量试验
为探究麸皮对猴头菇生长的影响,以玉米芯为主料的配方(玉米芯78%、麸皮20%、石膏1%、蔗糖1%,料水比为1∶1.5)作为对照,设计梯度试验,具体配方见表4。

表4 麸皮梯度试验配方Tab.4 Formulas of culture medium with different appending proportions of bran
如表4所示,根据金针菇菌糠占比为48%~58%设计3种麸皮添加量梯度试验。
1.2.5 不同培养方式的试验
对配方S2进行口径、搔菌、装料量对猴头菇生长影响的试验,8组试验设计见表5。

表5 不同栽培方式试验Tab.5 Experiment on different cultivation methods
1.2.6 猴头菇袋装栽培及出菇管理
按各配方中各组分的重量分别进行称重,料水比为1∶1.5,栽培袋规格为12 cm×22 cm,每袋装料量300 g。装料完毕后高压灭菌1.5 h,冷却后接种,随后放入菇房进行管理。菌丝生长阶段,菇房温度为25℃,待原基形成后开盖,菇房温度保持在20℃左右,空气相对湿度保持在85%~90%。试验期间记录菌丝萌发时间、菌丝生长速度、菌丝满袋时间、现蕾时间。
1.2.8 猴头菇子实体营养成分分析
对通过新型栽培体系培养的猴头菇子实体与传统栽培培养基栽培的猴头菇子实体进行含水量、粗总蛋白、总多糖、纤维素、灰分测定的比较。总多糖的测定使用分光光度计比色法[12],粗总蛋白的测定使用凯氏定氮法[13],纤维素的测定使用化学滴定法[14],灰分的测定使用灼烧法[15],水分含量的测定使用直接干燥法[16]。
2 结果与分析
2.1 猴头菇液体菌种的制备及菌种活力检测
猴头菇在不同配方的液体培养基中菌丝活力情况见图1。
图1 猴头菇在不同配方的液体培养基中菌丝生长情况Fig.1 Growth condition of Hericium erinaceus mycelial in different liquid medium
由图1可知,不同液体培养基培养的猴头菇菌种活力检测结果显示,不同培养基配方培养的猴头菇菌丝在不同天数生长情况下的菌丝活力存在差异。菌丝活力先增强后减弱,其中配方H1、配方H2培养的猴头菇菌丝在第5天时活力最强,配方H3培养的猴头菇菌丝在第4天时活力最强,而后菌丝活力均开始下降。配方H3菌丝生长更快,因此确定液体菌种配方为H3。
2.2 猴头菇菌糠培养基质研究
2.2.1 金针菇菌糠培养基配方的确定
不同培养基栽培猴头菇的生长情况见表6。
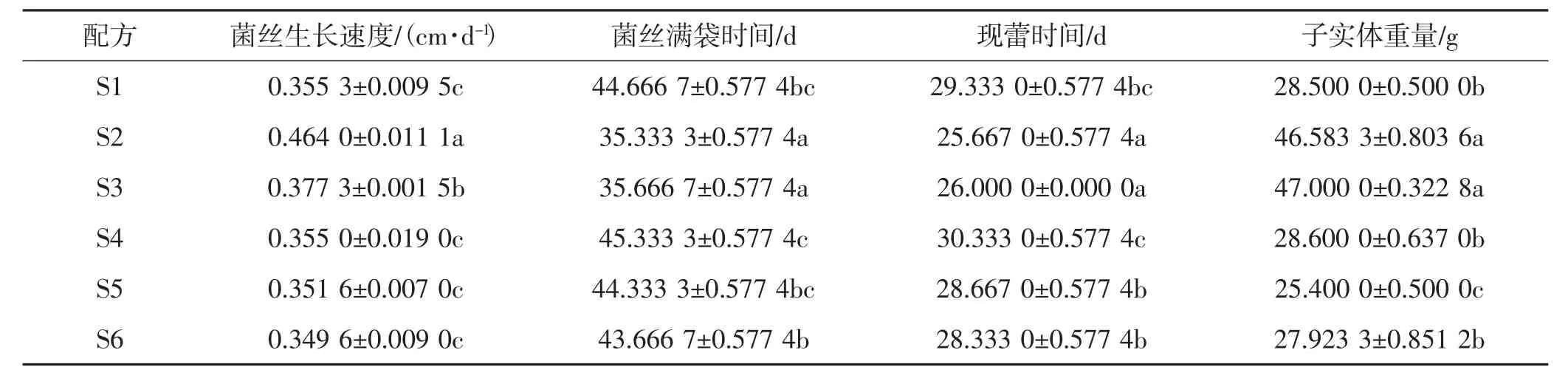
表6 不同培养基栽培猴头菇的生长情况Tab.6 Growth condition of Hericium erinaceus cultured with different mediums
由表6可知,配方S2和配方S3的子实体重量最高,平均每袋分别为46.58 g和47.00 g,显著高于其他试验组。生物转化率分别为18.6%和18.8%,菌丝满袋时间较短,分别为 35.33 d和35.67 d,配方S2、配方S3组间差异不显著。表明利用金针菇菌糠和玉米芯(配方S2、配方S3)栽培猴头菇优于其他基质,由于配方S2的菌丝生长速度更快为0.46 cm·d-1,认为是最优配方。因此在后续优化中以配方S2作为对照组。而5%的麸皮添加量对猴头菇生长影响作用不明显,需进一步设计试验考证。
2.2.2 金针菇菌糠培养基配方的优化
不同金针菇菌糠比例的培养基栽培猴头菇的生长情况见表7。

表7 不同金针菇菌糠比例的培养基栽培猴头菇的生长情况Tab.7 Growth condition of Hericium erinaceus with different mediums with appending proportions of cultivation substrate of Flammulina velutiper chaff
由表7可知,以配方S2作为对照组,通过改变金针菇菌糠和玉米芯的比例对猴头菌生长的影响显著。其中配方C2、配方C3栽培的猴头菇菌丝生长速率快,均达到0.47 cm·d-1,菌丝满袋时间均为29 d,现蕾时间分别为23.00 d和22.67 d,并且子实体重量较高,分别为85.00 g和86.33 g。2组间差异无统计学意义,均高于对照组。因此判断使用金针菇菌糠添加比例为48%~58%的栽培培养基较为适合猴头菇的栽培。
2.3 麸皮添加量对猴头菇生长的影响
不同麸皮添加比例的培养基栽培猴头菇的生长情况见表8。

表8 不同麸皮添加比例的培养基栽培猴头菇的生长情况Tab.8 Growth condition of Hericium erinaceus cultured with different mediums with appending proportions of bran
由表8可知,配方W2菌丝生长速度、菌丝满袋时间、现蕾时间、子实体重量及生物转化率都较其他对比配方和对照组好,配方W2菌丝生长速度为 0.49 cm·d-1,满袋时间为 32.0 d,现蕾时间为23.0 d,产量为101.67 g,生物转化率达34%,相比于对照组配方,产量提高44%。
因此,当最优金针菇菌糠占比为48%~58%时,一定比例的麸皮添加对猴头菇生长也有一定的影响,麸皮占比过多或过少均不利于猴头菇生长。所试验的配方W2能够使得猴头菇生长更快,子实体重量更高。
2.4 培养方式对猴头菇生长的影响
不同培养方式栽培猴头菇生长情况见表9。

表9 不同培养方式栽培猴头菇生长情况Tab.9 Growth condition of Hericium erinaceus with different cultivation methods
由表9可知,T1、T4、T7、T8试验菌丝满袋时间较短,T2、T3、T5、T6试验菌丝满袋时间较长。T2、T4、T6、T8试验现蕾时间显著高于T1、T3、T5、T7。T2、T4试验猴头菇产量显著高于T1、T3;T1、T3试验猴头菇产量显著高于T6、T8试验;T6、T8试验猴头菇产量显著高于T5、T7试验。
将口径、搔菌、装料量对猴头菇子实体重量的影响进行多元线性回归分析,结果显示,子实体重量对口径 (X)1、搔菌 (X)2、装料量 (X)3的非标准化回归系数为-7.325、7.525、0.013;口径、搔菌的回归系数显著性水平 Sig.=0均小于 0.05,装料量的回归系数的显著性水平Sig.=0.338,所以口径、搔菌对子实体重量有显著性影响,装料量对子实体重量影响不显著。回归分析得回归方程计算公式为:

式中:X1为口径(cm);X2为搔菌(搔菌即为1,不搔菌为0);X3为装料量(g)。
基于上述试验结果分析,不搔菌猴头菇试验(T2、T4、T6、T8)子实体重量显著高于其他试验且现蕾时间更短。小口径试验(T1、T2、T3、T4)猴头菇子实体重量显著高于大口径试验。装料量对猴头菇生长影响不显著。进一步多元回归线性分析结果表明,对猴头菇子实体重量影响因素大小顺序依次为搔菌、口径、装料量。
2.5 新型培养体系与传统栽培的猴头菇营养成分分析
猴头菇子实体营养成分对比见表10。

表10 猴头菇子实体营养成分对比Tab.10 Comparison of nutritional contents of Hericium erinaceus fruiting body
由表10可知,配方W2与对照组配方栽培的猴头菇在总多糖含量无显著差异。使用配方W2栽培的猴头菇在总粗蛋白含量、纤维素、灰分均高于对照组,而含水量低于对照组。通过营养物质分析可以判断猴头菇子实体的营养价值差异。总体来说,配方W2栽培的猴头菇优于传统栽培方式培养的猴头菇。
3 讨论与结论
食用菌在生长过程中会分解利用栽培料中的营养物质,因此在菌糠中未被利用的营养物质在二次栽培中可以更快速地得到利用,从而使得试验中新型配方栽培的猴头菇具有更良好的生物学性状[17]。麸皮作为小麦加工的副产物,其中所包含的微量元素可能是促进猴头菇生长的重要原因。在试验中使用的滤泥是通过堆积发酵形成,含水量较高且气味较大,虽也具有较多营养物质,但也容易造成栽培过程中的污染,因此对于滤泥的利用还需寻求更好的途径。
试验中发现搔菌在一定程度上会增加现蕾时间和减少子实体重量,可能是由于搔菌步骤破坏了原先形成的菌皮,菌丝不能顺利形成原基[18],因此猴头菇的生长过程并不需要进行搔菌。小口径试验猴头菇子实体重量显著高于大口径试验,小开口的栽培袋中猴头菇子实体形成较快,形态良好,不容易出现畸形菇,开口较大后形成的无效子实体无法继续生长。装料量对猴头菇生长影响不显著,说明试验用装料量提供的营养已足够猴头菇生长所需。
以传统方式进行的猴头菇栽培需要耗费巨大的木屑栽培料,将其替换为金针菇菌糠后,可以节约购买木屑的成本,还能够收获更高的猴头菇产量,这在农业物质循环利用中具有重要的现实意义,适用于猴头菇工业化栽培。
以金针菇菌糠、玉米芯和麸皮制作的猴头菇栽培培养基W2进行栽培时菌丝具有较高的生长速率、满袋和现蕾时间以及更高的子实体重量。与传统以玉米芯为主料的栽培料对比,新型栽培方式栽培的猴头菇子实体具有更高的营养成分含量和更低的含水量,说明新型栽培方式培育的猴头菇更具有优势,可以推广使用。
