透明质酸包裹的木犀草素胶束制备及其对小鼠肺癌移植瘤的抑制作用
2021-03-12肖建鹏蒋俊张振海胡冰洁王丽何津津蔡志慧徐希明
肖建鹏,蒋俊,张振海,胡冰洁,王丽,何津津,蔡志慧,徐希明
(1. 江苏大学药学院,江苏 镇江 212013; 2. 江苏省中医药研究院,江苏 南京 210028)
肺癌是肺部原发性肿瘤中最常见的类型,从组织病理学和生物学特征可分为小细胞肺癌和非小细胞肺癌[1-2]。全球范围内,肺癌的发病率、死亡率都极高且呈现上升趋势[3-4]。手术切除是治疗肺癌的主要方法,但受到很多条件的限制,一般只用于部分非小细胞癌的治疗[5];而小细胞癌由于转移与扩散的发生,不适于手术治疗[6],多采用化学疗法,然而传统药物的不良反应较大,因此限制了药物的用量[7]。同时,耐药性减少了药物进入有效部位的药量,使药物的抗癌效果大大降低。
黄酮是一类植物次级代谢产物,具有抗氧化、防止血管增生、抗炎、抗病毒、降血糖、降血脂和抗骨质疏松等多种生物活性[8],广泛分布于天然产物中。木犀草素(luteolin)是一种常见的黄酮类化合物,具有高效低毒的特性。已有研究表明,木犀草素对肺癌具有防治作用,是极具开发价值的抗肺癌药物[9]。然而,在实际应用中,为优化木犀草素的抗癌活性,一些问题尚待解决: ① 木犀草素为难溶性药物[10],生物利用度低,限制了其在体内抗肿瘤活性的发挥; ② 木犀草素在体内不具有靶向性[11]。
基于上述问题,本研究将制备透明质酸包裹的木犀草素胶束(HA-LE-MC)[12-13]。一方面,制备的胶束可将疏水性药物木犀草素包裹在疏水内核,从而增加木犀草素的溶解度,提高生物利用度;其次,透明质酸具有肿瘤靶向性,引导胶束靶向于肿瘤组织。
1 材料与方法
1.1 主要材料与仪器
双十烷基二甲基溴化铵(DDAB,南京南奥科技有限公司);泊洛沙姆407(F127,相对分子质量9 840~14 600 Da,德国BASF公司);透明质酸(HA,相对分子质量77 kDa,华熙福瑞达公司);木犀草素原料药(批号:xc20131226-5,西安小草植物科技有限责任公司);甲醇、乙腈(色谱纯,上海泰坦科技股份有限公司),无水乙醇(分析纯,上海泰坦科技股份有限公司);超纯水、PBS(实验室自制);Lewis细胞(中国科学院上海细胞生物研究所细胞库);C57小黑鼠(体重18~22 g,6~8周龄,SPF级,雄性);透析袋(相对分子质量8~12 kDa,南京南奥科技有限公司);85-2恒温加热磁力搅拌器、3000HSA型激光粒度分析仪(英国马尔文仪器有限公司);6390LV-透射电镜(日本电子公司);安捷伦1200高效液相色谱仪(北京京科瑞达有限公司)。
1.2 HA-LE-MC的制备
1.2.1 制备过程 采用逆相蒸发法制备HA-LE-MC。精密称取DDAB和F127,加入圆底烧瓶中,加氯仿10 mL,再加入木犀草素无水乙醇溶液,混匀,35 ℃全真空减压去除有机溶剂,形成均匀薄膜,加入10 mL氯仿,再加入3 mL PBS,振摇,超声5 min形成稳定的W/O相。35 ℃半真空减压旋转至凝胶状,补加适量PBS,继续旋转洗脱胶状物,得木犀草素胶束。加入适量透明质酸的PBS溶液,继续旋转水化1 h,过0.22 μm微孔滤膜即得透明质酸包裹的木犀草素混悬液,低温避光保存。
1.2.2 F127与DDAB质量比对胶束制备的影响 为了探究F127与DDAB对胶束制备的影响,考察了F127∶DDAB质量比分别为9∶1,14∶1,19∶1时胶束的包封率和粒径分布。
1.2.3 工艺验证 通过对F127∶DDAB用量的筛选,最终确定了制备HA-LE-MC的最佳处方。
1.3 体外表征
1.3.1 HA-LE-MC的形态分布 将制备好的HA-LE-MC置于透射电镜下观察其表观形态。
1.3.2 药物含量测定
1.3.2.1 色谱条件 Aglient Zorbax SB-C18 色 谱 柱(4. 6 mm×250 mm,5 μm),以乙腈-水(70∶30)为流动相,等度洗脱,流速:1 mL/min;检测波长为348 nm;柱温30 ℃;进样量10 μL。
1.3.2.2 含量测定 ① 对照品溶液配制:量取适量木犀草素,置10 mL容量瓶中,加甲醇溶解定容制备成0.05 mg/mL的木犀草素标准溶液。② 供试品溶液配制:新鲜制备1 mg/mL的HA-LE-MC,用移液枪精密吸取100 μL,并加入900 μL甲醇后涡旋混匀1 min。将涡旋后的溶液过0.45 μm的滤膜即得。
1.3.3 包封率测定 采用透析法测定HA-LE-MC的包封率。新鲜制备HA-LE-MC 20 mL。将其中10 mL制剂放入截留相对分子质量为8~12 kDa透析袋中,将透析袋置于300 mL的50∶50水-乙醇溶液介质中,分别透析4 h和8 h后更换透析液,透析24 h后取出透析袋,用高效液相色谱法测定袋内药物含量。同时,测定剩余10 mL未透析制剂的药物含量,二者之比即为包封率。
1.3.4 平均粒径与分布的测定 制备HA-LE-MC,精密量取2 mL,加入50 mL容量瓶中,用注射用水稀释定容。取适量加至样品池1 cm高度处,用激光粒度分析仪测定粒径,所有结果测定3次。
1.4 体内活性实验
1.4.1 活体成像实验 体外培养适量Lewis肺癌细胞,接种前吸取细胞混悬液,1 000 r/min离心2 min。收集底部细胞,加灭菌PBS洗涤细胞2次,并将细胞密度调至1.5×107个/mL。接种时,先将接种部位消毒,以0.1 mL/只的剂量将Lewis细胞接种于小鼠右腋窝皮下,在给药之前观察并测量肿瘤直径确定造模成功。制备含药胶束载体,并加入0.5 mg/mL浓度的DIR染料。将含DIR的胶束载体尾静脉注射到小鼠体内,使用IVIS Lumina Ⅱ小动物活体成像系统(美国Caliper公司)进行活体成像。
1.4.2 体内抗肿瘤实验
1.4.2.1 小鼠腹腔接种Lewis细胞悬液 取C57小鼠4只,体重(18±2) g,从液氮罐中取出Lewis细胞常温下解冻,随后取无菌生理盐水稀释瘤株至细胞浓度为1×107个/mL瘤细胞悬液,在无菌条件下对小鼠进行腹腔接种,观察记录小鼠生长情况。
1.4.2.2 Lewis细胞实体瘤接种悬浮液制备方法 取接种肺癌细胞7 d的小鼠,抽取约3 mL腹腔移液(乳白色),放入无菌容器内,冰浴上操作,加无菌生理盐水,1 000 r/min离心5 min,洗2次后收集细胞,经台盼蓝排斥试验检查细胞成活率95%以上时,调成细胞浓度为1.5×107个/mL的细胞悬液备用。
1.4.2.3 分组及给药 按随机数字表法将36只C57小鼠随机分为6组,每组6只,记录各组小鼠体重。在无菌条件下,将配好的Lewis细胞株悬液(1.5×107个/mL),接种于其中5组小鼠右上肢腋下,0.2 mL/只。接种完成后,逐日观察接种部位有无感染,肿瘤生长后有无自然消退,每天用游标卡尺测量肿瘤长径a和短径b,并计算平均直径,即r=(a+b)/2,每天记录小鼠体重,绘制曲线。造模后的小鼠随机分为5组:模型组,顺铂组,木犀草素原药组,HA-LE-MC高剂量组(药物浓度2 mg/mL),HA-LE-MC低剂量组(药物浓度1 mg/mL),每组6只。造模之后每天观察肿瘤直径,观察15 d以确保造模成功,随后开始给药。其中,顺铂组给予顺铂1 mg/mL,静脉注射0.2 mL/只,1次/2 d;木犀草素原药组给予木犀草素溶液2 mg/mL,静脉注射,0.2 mL/只,1次/2 d;HA-LE-MC高、低剂量组分别给予2 mg/mL和1 mg/mL的HA-LE-MC,静脉注射,0.2 mL/只,1次/2 d。共给药5次。
1.4.2.4 抑瘤率及胸腺指数的测定 末次给药24 h后(即确保造模成功后的第11天),称重后脱颈处死小鼠,取瘤块称重,计算肿瘤生长的抑制率(抑瘤率)。称取小鼠胸腺、脾,分别计算胸腺指数和脾指数,各指标计算公式如下: 抑瘤率(%)=(模型组瘤重-治疗组瘤重)/模型组瘤重×100%;胸腺指数=胸腺质量(mg)/体重(g);脾指数=脾质量(mg)/体重(g)。
1.5 统计学处理

2 结果
2.1 胶束的表观形态
透射电镜观察胶束的表观形态如图1所示,胶束呈球形,粒径约为140 nm。
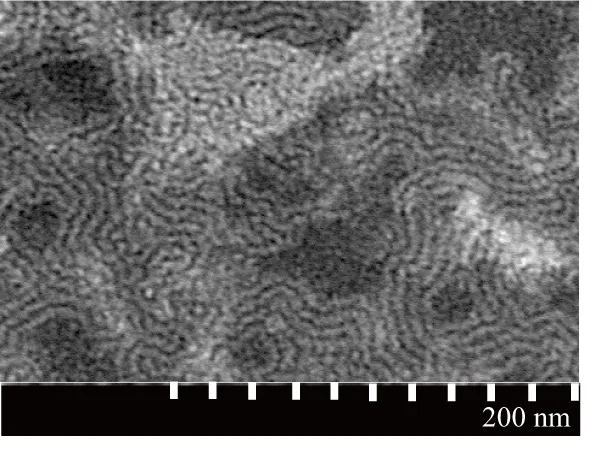
图1 HA-LE-MC透射电镜图
2.2 药物含量测定
HA-LE-MC及对照品色图谱如图2所示。
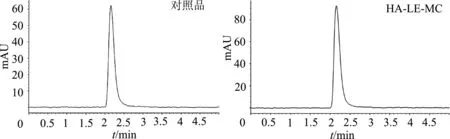
图2 HA-LE-MC及对照品色谱图
HA-LE-MC色谱图的峰面积为985,木犀草素对照品峰面积为661。已知对照品浓度为50 μg/mL,利用外标法计算得HA-LE-MC中木犀草素浓度为75 μg/mL。
2.3 F127与DDAB质量比对胶束制备的影响
如表1所示,当F127与DDAB质量比为9∶1时,HA-LE-MC的包封率最高,粒径最小。实际制备时,采用F127与DDAB质量比为9∶1的配比。
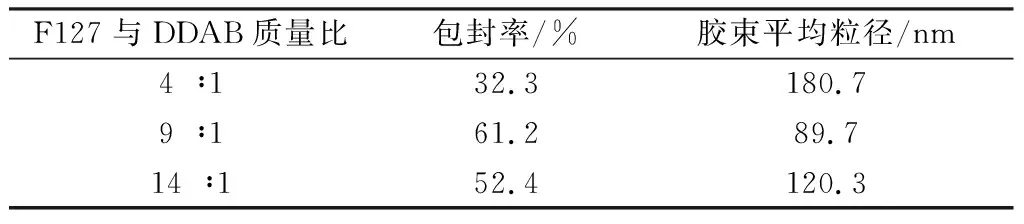
表1 F127与DDAB质量比对胶束的影响
2.4 活体成像实验
尾静脉注射加荧光染料的胶束载体0.5、2、4、6、8、10、12、24 h后的成像结果如图3所示。从图中可知胶束载体尾静脉注射后集中分布在肿瘤部位,说明胶束载体具有较强的肿瘤靶向性。
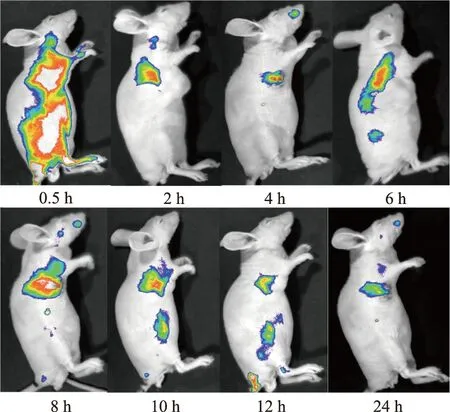
图3 HA-LE-MC在小鼠体内的分布
2.5 小鼠体重、瘤重及抑瘤率
造模之后连续15 d记录小鼠肿瘤直径,如图4所示,小鼠肿瘤直径逐渐增加,造模成功。
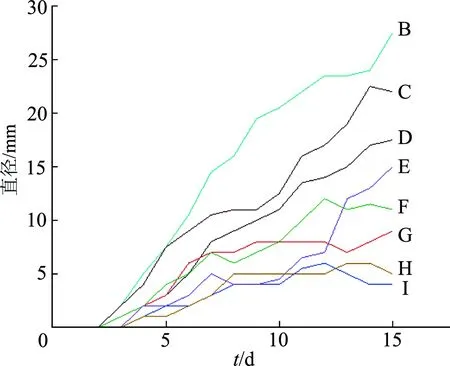
B~I为小鼠编号
各组小鼠体重及瘤重比较见表2,HA-LE-MC高、低剂量小鼠平均瘤重显著低于模型组(P<0.01),而体重无明显差异;顺铂组小鼠平均瘤重显著低于模型组(P<0.01),且体重也显著低于模型组(P<0.01)。说明HA-LE-MC对Lewis肺癌移植瘤有抑制作用,且与顺铂相比对体重的影响较小。经计算得顺铂组平均抑瘤率为70.8%,HA-LE-MC高、低剂量组的抑瘤率分别为58.4%和40.1%,木犀草素原药组的抑瘤率为20.7%,说明HA-LE-MC的抑瘤率显著高于木犀草素原药组。
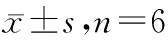
表2 各组小鼠体重及瘤重比较
2.6 HA-LE-MC对小鼠脏器指数的影响
与空白对照组相比,模型组小鼠胸腺指数与脾指数明显降低(P<0.01),说明小鼠接种Lewis细胞后免疫功能下降。与模型组比较,木犀草素原药组脏器指数增加(P<0.05);HA-LE-MC低、高剂量组脏器指数显著增加(P<0.01),调节小鼠免疫功能的效果更明显;而顺铂组脏器指数明显减小(P<0.05),可能是因为顺铂毒副作用较大,从而导致小鼠免疫功能下降。见表3。
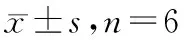
表3 各组小鼠脏器指数比较
3 讨论
体内抗肿瘤实验表明,与模型组相比,HA-LE-MC组小鼠平均瘤重显著降低,而体重无明显差异;顺铂组小鼠平均瘤重显著低于模型组,且体重也显著降低,说明HA-LE-MC对Lewis肺癌移植瘤有抑制作用,且与顺铂相比毒副作用较小。此外,与原料药组相比,HA-LE-MC组的抑瘤率显著增高,结合活体成像结果(荧光信号集中于肿瘤部位),说明HA-LE-MC具有靶向性,可增加有效部位的药量,抗肿瘤活性增强。
给药后,与空白对照组相比,模型组小鼠胸腺指数与脾指数明显降低,说明小鼠接种Lewis细胞后,免疫功能下降;与模型组比较,HA-LE-MC组胸腺指数与脾指数明显增加,说明HA-LE-MC能调节小鼠免疫功能;而顺铂组胸腺指数和脾指数明显减小,可能是顺铂毒副作用较大,从而导致小鼠免疫力下降。此外,HA-LE-MC组的胸腺指数和脾脏指数比原药组高,说明HA-LE-MC组的治疗效果优于原料药组。综上,HA-LE-MC具有免疫促进的作用,能改善小鼠生存状况。
此制剂的特色在于制备方法简单易行,制剂性质稳定,靶向性强,毒副作用低,耐药性大大减小。透明质酸是一种天然的糖胺聚糖,具有高度的黏弹性、可塑性、非免疫原性、良好的生物相容性及可降解性等多糖类化合物特性,已成为靶向肿瘤药物递送的研究热点。本研究制备的是HA-LE-MC,具有靶向性高、毒性低的特性。在保障其抗肿瘤作用的同时,大大降低其毒副作用,解决了传统肿瘤化疗药物毒副作用大、耐药性高等缺陷。
