中国成人心脏瓣膜病超声心动图规范化检查专家共识
2021-03-09中华医学会心血管病学分会心血管影像学组北京医学会心血管病学会影像学组
中华医学会心血管病学分会心血管影像学组,北京医学会心血管病学会影像学组
近年来,欧美国家多次对超声心动图评估心脏瓣膜病的相关指南、共识进行更新[1-4]。为促进心脏瓣膜病相关的临床和科研工作深入发展,在我国尚无综合的心脏瓣膜病超声心动图检查指南的情况下,制定规范化检查专家共识十分必要。基于既往相关指南、共识及大量临床研究文献的总结,本共识详细介绍了超声心动图检查、测量和评价心脏瓣膜病的方法和建议。
1 检查前准备及图像存储要求
检查前准备及图像存储要求包括以下四项:(1)建议检查前记录患者姓名、ID 号、年龄、性别、诊断、身高、体重、血压、心率、心脏杂音等信息。(2)建议使用同步心电图监测。(3)除测量和频谱图像外,建议均存储动态图像,以DICOM 格式存储。建议正常窦性心律患者存储≥3 个心动周期,心房颤动患者存储≥5 个心动周期;窦性心律时测量3个心动周期,心房颤动时测量5 个心动周期,取均值。(4)测量参数的参考图像示意:图片上标注为检查时建议测量参数为检查时可选择测量参数。
2 心脏瓣膜病的超声心动图规范化检查
2.1 主动脉瓣狭窄
主动脉瓣狭窄的常见原因包括先天性、风湿性和老年退行性病变。随着人口老龄化,退行性(钙化性)主动脉瓣狭窄在我国逐渐增多。
2.1.1 主动脉瓣狭窄严重程度的观察与测量参数
仔细观察主动脉瓣叶数目(二叶或三叶)、钙化程度及分布;建议测量主动脉瓣环、左心室流出道、主动脉窦部和升主动脉内径;可选择测量冠状动脉开口位置(高度),同时关注其他瓣膜病变、左心室大小和功能。多声窗多切面测量跨主动脉瓣峰值流速、平均跨瓣压差,采用连续方程法测量主动脉瓣有效瓣口面积(EOA),见表1。

表1 主动脉瓣狭窄程度评估推荐的建议及可选择测量参数
2.1.2 主动脉瓣狭窄程度的分级标准及流程(表2、图1)
关于主动脉瓣狭窄严重程度的分级,主动脉瓣口面积<1.0 cm2,峰值流速≥4.0 m/s 或主动脉瓣平均跨瓣压差≥40 mmHg(1 mmHg=0.133 kPa),上述三个标准中的任何一个均提示重度主动脉瓣狭窄。理想情况下,应严格符合范围内的所有标准。在诊断标准不一致的情况下,应在最终做出诊断之前将这些标准与其他影像结果和临床数据进行整合综合判断。

表2 主动脉瓣狭窄程度的分级标准
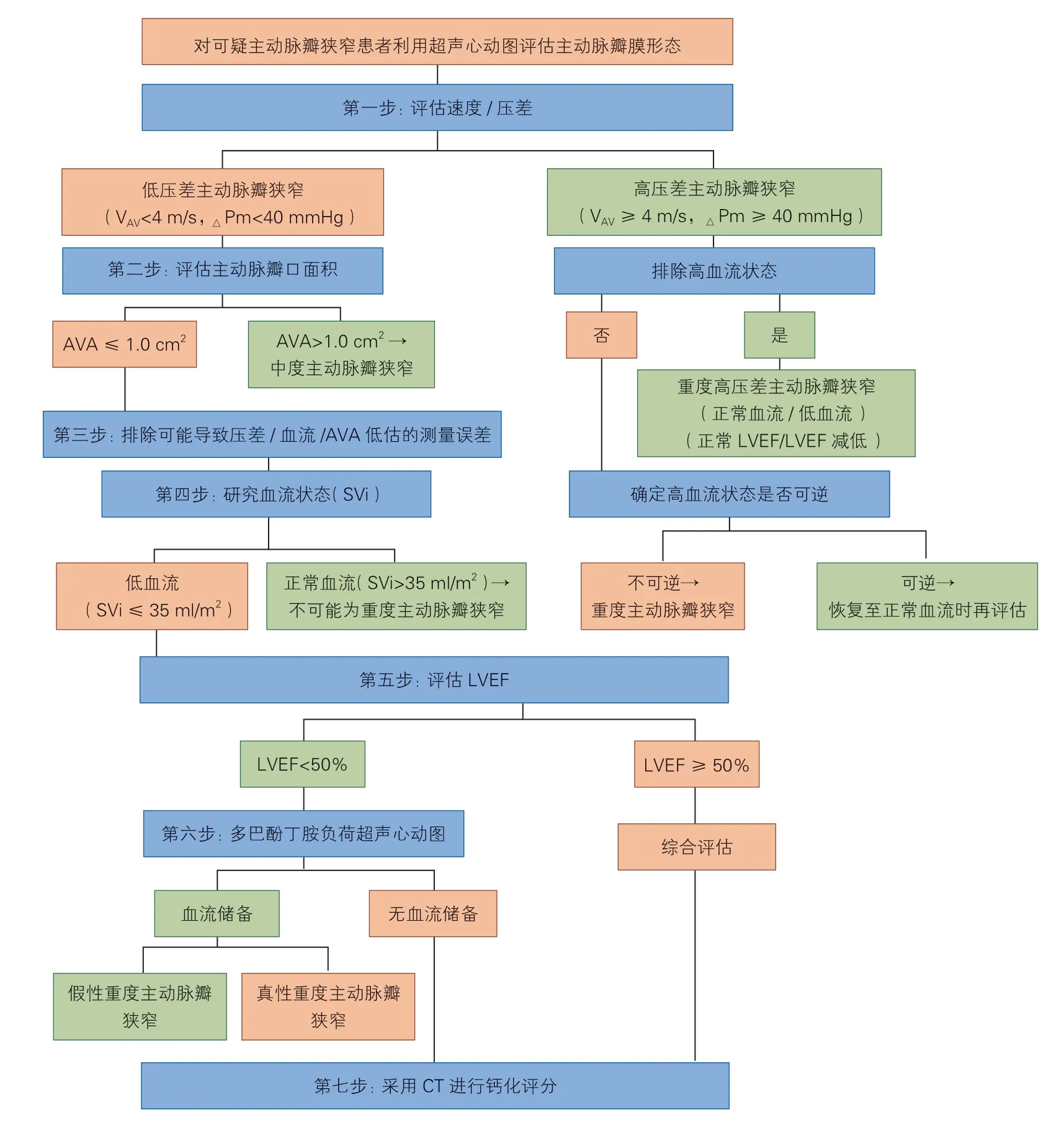
图1 主动脉瓣狭窄评估流程
2.1.3 特殊情况
高压差主动脉瓣狭窄:在高跨瓣血流量情况下,尽管峰值流速≥4.0 m/s,平均跨瓣压差≥40 mmHg,而主动脉瓣口面积可能≥1.0 cm2。必须排除可逆性高排血量(发热、贫血、甲状腺功能亢进、动静脉瘘等)的情况,否则需要在高排血量状态去除后进一步评估。如不存在高排血量,则诊断为重度主动脉瓣狭窄。
射血分数降低的低血流、低压差主动脉瓣狭窄:定义包括以下条件:有效主动脉瓣口面积<1.0 cm2,平均跨瓣压差<40 mmHg,左心室射血分数(LVEF)<50 %,每搏量指数<35 ml/m2。此时应做小剂量多巴酚丁胺负荷试验,以判断是否为真性重度主动脉瓣狭窄。如果主动脉瓣口面积有所增加并且最终>1.0 cm2,表明狭窄不严重。主动脉瓣峰值流速≥4.0 m/s 或平均跨瓣压差≥30~40 mmHg,提示重度主动脉瓣狭窄,在某种血流量时主动脉瓣口面积不超过1.0 cm2。
射血分数保留的低血流、低压差主动脉瓣狭窄:包括主动脉瓣口面积<1.0 cm2,峰值流速<4.0 m/s,平均跨瓣压差<40 mmHg,LVEF 正常(≥50 %)。需要排除以下情况:测量误差(尤其左心室流出道面积以及血流量的低估),在检查时存在高血压、主动脉瓣口面积在0.8~1.0 cm2,主动脉瓣口面积、速度和压差的临界值并非一一对应。对于体型较小的患者,尽管主动脉瓣口面积<1.0 cm2,可能是临床意义上的中度主动脉瓣狭窄。
射血分数保留的正常血流、低压差主动脉瓣狭窄:在临床实践中,有时即使计算血流量正常,也可能会出现主动脉瓣口面积<1.0 cm2和平均跨瓣压差<40 mmHg 的情况。此类患者不应被诊断为重度主动脉瓣狭窄,应对其进行密切随访和再评估,尤其具有临床症状时。
2.1.4 经导管主动脉瓣置换术相关的超声心动图评估(表3)
超声心动图对于经导管主动脉瓣置换术(TAVR)术前、术中及术后评估都有重要作用。经食道三维超声心动图有助于精确测量主动脉瓣瓣环;由于多层计算机断层扫描(MSCT)不仅可以高精度地测量瓣环大小,而且还提供了包括主动脉根部形状,冠状动脉和瓣环之间的距离以及治疗前期整个导管路径全面的解剖细节,故目前多采用MSCT 进行评估。但当患者存在肾功能不全以及心律不齐时,TAVR评估时不适合使用MSCT 而适合选用超声心动图。

表3 TAVR 的围手术期超声心动图评估
2.1.5 随访和术后评估
无症状重度主动脉瓣狭窄应至少每半年重新评估1 次;有明显钙化,轻度和中度狭窄应每年复查;年轻无明显钙化者,评估间隔可延长至2~3 年。超声心动图对主动脉瓣狭窄患者的随访评估重点是狭窄程度(速度和压差的增加及主动脉瓣口面积的减小)的进展以及狭窄产生的继发改变(左心室肥厚加重,LVEF 降低,继发性二尖瓣反流和三尖瓣反流,肺动脉压增高)以及升主动脉大小的变化。可能会影响无症状性重度主动脉瓣狭窄的手术决策的超声心动图发现包括:主动脉峰值流速>5.5 m/s;重度主动脉瓣钙化同时跨瓣峰值流速每年递增≥0.3 m/s;运动负荷状态下,平均跨瓣压差增加>20 mmHg。
2.2 主动脉瓣反流
主动脉瓣反流主要由主动脉瓣膜本身病变、主动脉根部疾病所致。根据发病情况分为急性和慢性两种。主动脉瓣反流的病因和发病机制包括先天性心脏病瓣叶病变,获得性瓣叶病变,先天性心脏病遗传性主动脉根部病变及获得性主动脉根部病变。
2.2.1 主动脉瓣反流程度评估推荐的建议及可选择测量参数(表4)
2.2.2 主动脉瓣反流合并特殊情况的评估
主动脉瓣反流合并二尖瓣反流:中度以上主动脉瓣反流合并二尖瓣反流时,不建议采用心输出量法评估反流程度。
主动脉瓣反流合并二尖瓣狭窄:二尖瓣狭窄的血流信号可能与主动脉瓣反流相混淆,鉴别要点是二尖瓣狭窄的速度较低,起始时间较晚。
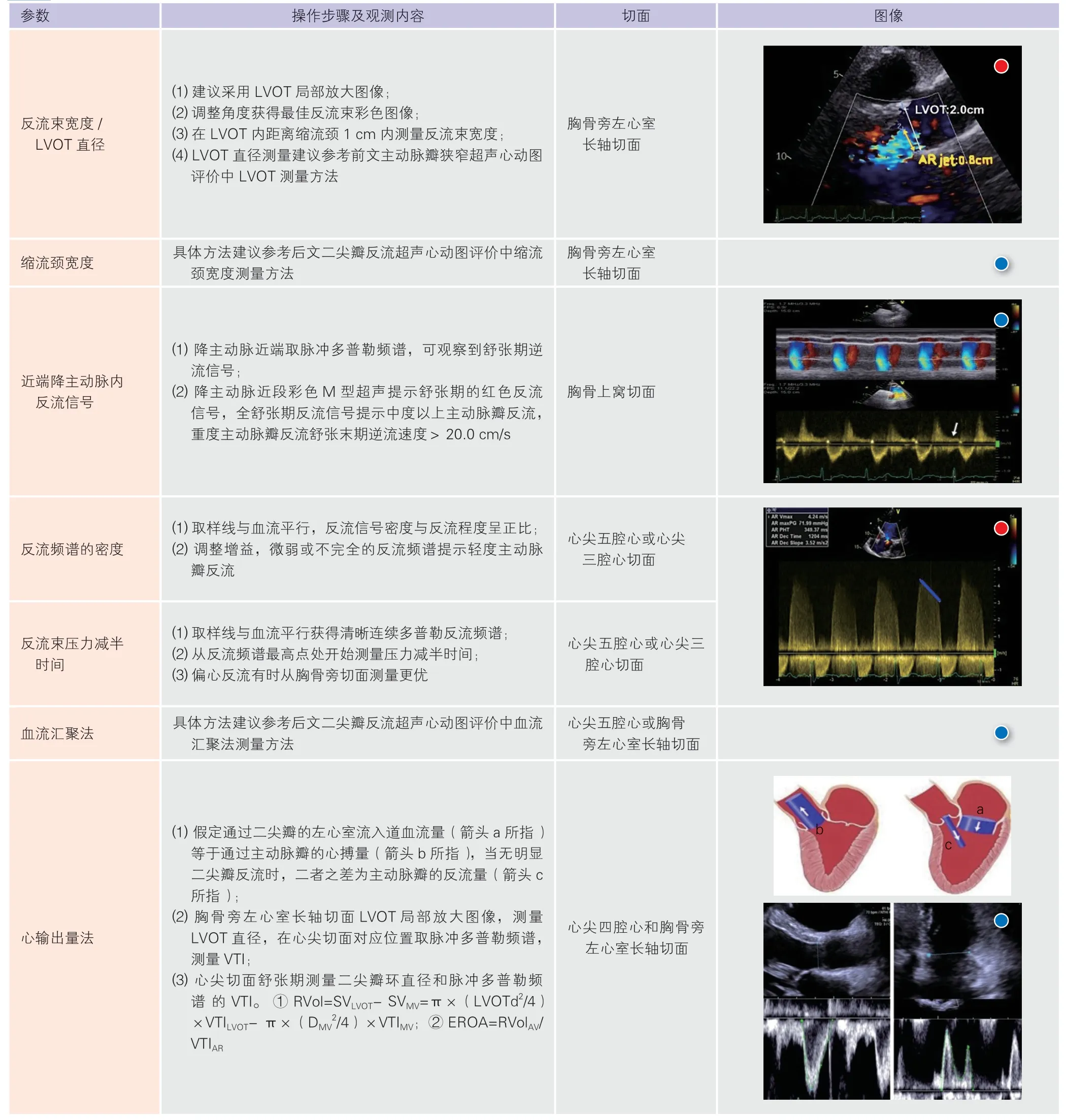
表4 主动脉瓣反流程度评估推荐的建议及可选择测量参数
主动脉瓣反流合并主动脉瓣狭窄:左心室肥厚松弛功能受损时,主动脉瓣反流的压力减半时间(PHT)延长,而当主动脉瓣狭窄导致左心室舒张压升高时PHT 缩短。重度主动脉瓣反流时,左心室流出道速度增快,跨瓣压差增大,但连续方程测量主动脉瓣口面积是准确的。主动脉瓣反流的评估需结合多种方法。
2.2.3 主动脉瓣反流程度的分级评估(表5)
2.2.4 随访和术后评估
轻中度主动脉瓣反流建议每两年随访1 次,重度主动脉瓣反流左心室功能正常时在初次超声心动图检查后半年随访1 次,若稳定每年随访1 次;若左心室大小和LVEF 变化明显,应每半年随访1 次。术前及术后随访内容包括:症状、体征、左心房和左心室大小、左心室功能、升主动脉内径及反流量。重度主动脉瓣反流的手术指征为:出现症状;无症状但LVEF ≤50 %和(或)左心室收缩末期内径>50 mm(25 mm/m2)或左心室舒张末期内径>70 mm。

表5 主动脉瓣反流程度的分级标准
2.3 二尖瓣反流
二尖瓣器由二尖瓣瓣叶、瓣环、腱索、乳头肌构成,同时二尖瓣的启闭功能还与其连接的左心房及左心室大小和功能密切相关,以上六个组成任一部分发生病变均可导致二尖瓣启闭功能障碍。二尖瓣反流在瓣膜病中发病率最高,且随着人口老龄化和人群平均寿命的增加,发病率还在逐年增加。超声心动图对二尖瓣反流的全面评估包括[2,5-6]:反流病因的判断;反流机制的观察和推测;瓣器病变的性质、部位和病变程度的详细描述;反流对于房室腔重构及心功能的影响。
2.3.1 二尖瓣反流的病因学分类及发生机制及形态学评估
可根据导致瓣叶反流的原始病因分为原发性(又称之为器质性,因二尖瓣器质性病变导致),继发性(又称之为功能性,因左心室或左心房的扩大或功能不全导致继发闭合不全)及混合性(合并原发性和继发性的因素)三种病因,见表6。
二维超声可观察二尖瓣器结构变化,有无瓣叶增厚冗长、钙化,了解瓣下腱索的病变情况以及病变累及部位,病变形态学的改变对外科开胸手术或是介入治疗的选择起关键作用。病变累及部位通常按照Carpentier 分区法,把二尖瓣前后叶从外侧到内侧大致三等分各划为三个区,分别为前叶A1、A2、A3 区,后叶P1、P2、P3 区[7],以方便定位瓣叶病变位置和区域,见图2。
2.3.2 二尖瓣反流严重程度的基本评估(表7、表8)典型明确的二尖瓣反流推荐建议测量参数(定性及半定量)评估反流严重程度。当建议测量参数评估结果不确定,需要更多的定量参数支持时,推荐可选择测量参数补充。
2.3.3 二尖瓣反流评估的流程及严重程度分级标准[8](图3、表9)
2.3.4 特殊情况
继发性二尖瓣反流的机制为瓣环扩大,瓣叶对合面积减小所致,收缩期血流沿着对合线反流入左心房,因而反流口呈狭长形,不同于原发性二尖瓣反流的圆形反流口,血流汇聚法测量有效反流口面积时导致低估,有条件可用三维彩色模式成像后,横切至反流口横截面,手动描记有效反流口面积。合并其它瓣膜疾病时需综合患者病史、系列超声检查、心腔大小等情况,二维、多普勒等多参数进行综合判断。
2.3.5 随访和术后评估
轻度及中度二尖瓣反流建议定期随访,每1~2年复查;建议在同一中心采用相同的仪器进行系列随访对照;功能性反流可在血运重建手术后或药物治疗后复查反流变化[2,8]。

表6 二尖瓣反流的病因学分类及发生机制

图2 经食道三维超声心动图Truevue 模式二尖瓣口左心房面观
重度二尖瓣反流外科手术后或经导管瓣膜修复术后随访,需注意有无残余反流及残余反流程度(评估方法同前)、有无术后狭窄(评估方法同瓣膜狭窄)、心腔大小的变化及心功能。
机械瓣、生物瓣和经导管瓣膜置换术后随访,需注意:(1)人工瓣膜血流动力学,包括前向血流峰值流速、峰值压差、平均跨瓣压差,连续方程式估测EOA;(2)有无反流,反流的位置(中心性或瓣周),反流程度(评估方法同前),详细评估方法见人工瓣的评估[9];(3)心腔大小的变化及心功能;(4)人工瓣的形态和活动度(有无赘生物、瓣周漏、瓣周脓肿、血栓、血管翳等异常回声),必要时需进一步经食道超声心动图检查。需与术后早期及既往检查进行对比。
2.4 二尖瓣狭窄
超声心动图是无创评估二尖瓣狭窄的主要手段,为临床决策提供重要依据,准确和规范化测量至关重要。二尖瓣狭窄的病因和发病机制包括风湿性(瓣叶交界处粘连等)、退行性(瓣叶或瓣环、瓣下腱索钙化等)、先天性(“降落伞”型二尖瓣等)和其他。二尖瓣狭窄根据形态可分为膈膜型、漏斗型和膈膜漏斗型[10]。
2.4.1 二尖瓣狭窄严重程度评估推荐建议及可选择测量参数(表10)
2.4.2 二尖瓣狭窄合并特殊情况
无症状或症状不明显的二尖瓣狭窄,亦或症状与二尖瓣狭窄严重程度不一致,可以进行负荷超声心动图检查,通过评估二尖瓣压力梯度和肺动脉压的变化提供更多的客观信息[1,6]。
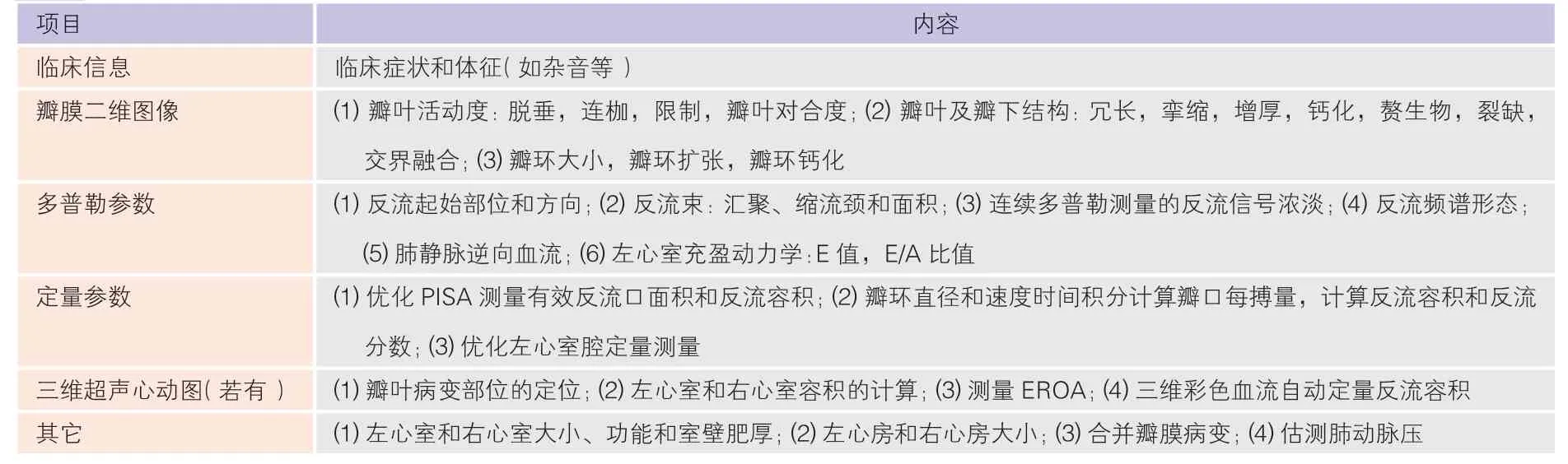
表7 综合超声心动图评估二尖瓣反流所需参数
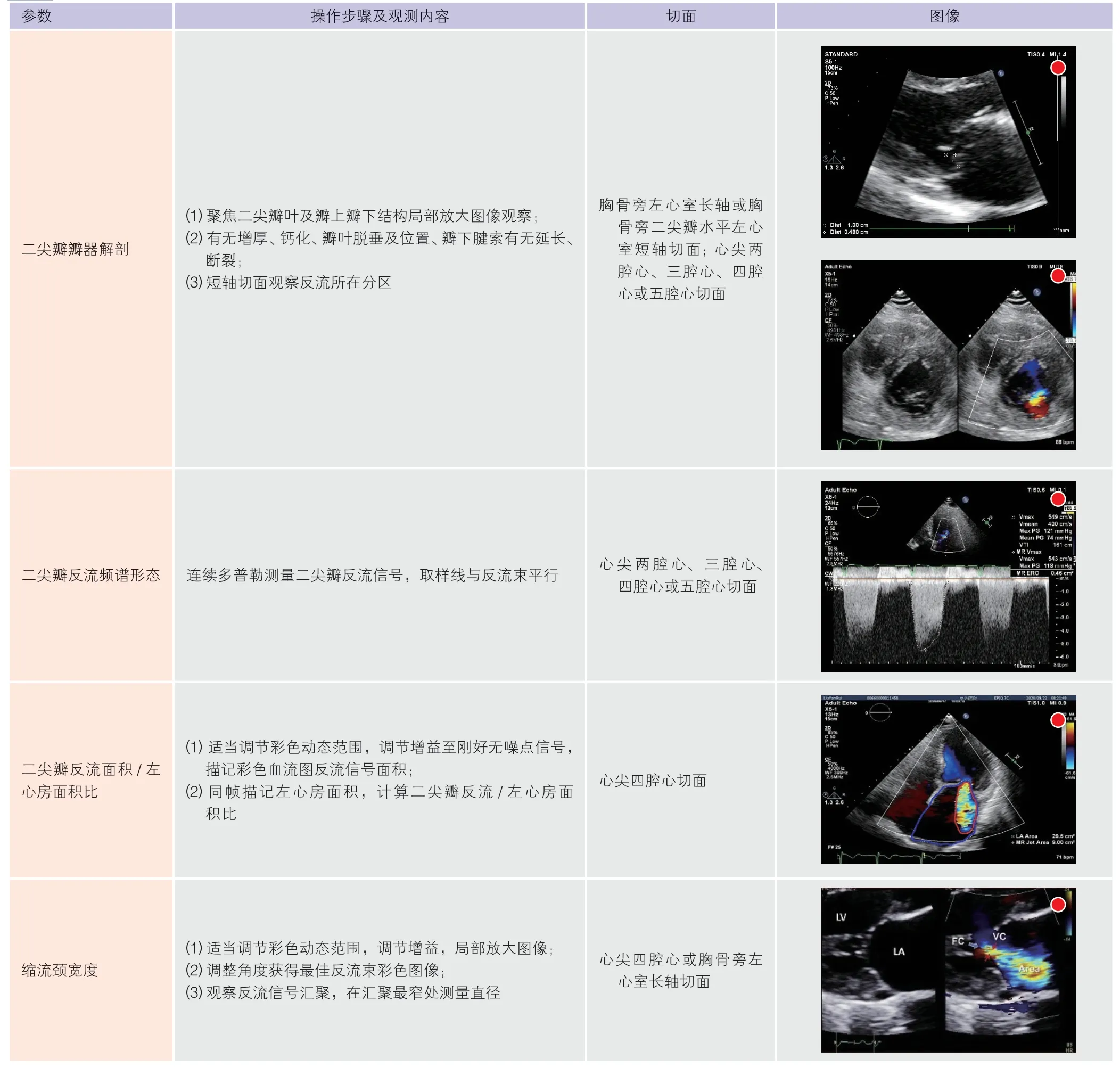
表8 二尖瓣反流程度评估推荐建议及可选择测量参数

(续表8)
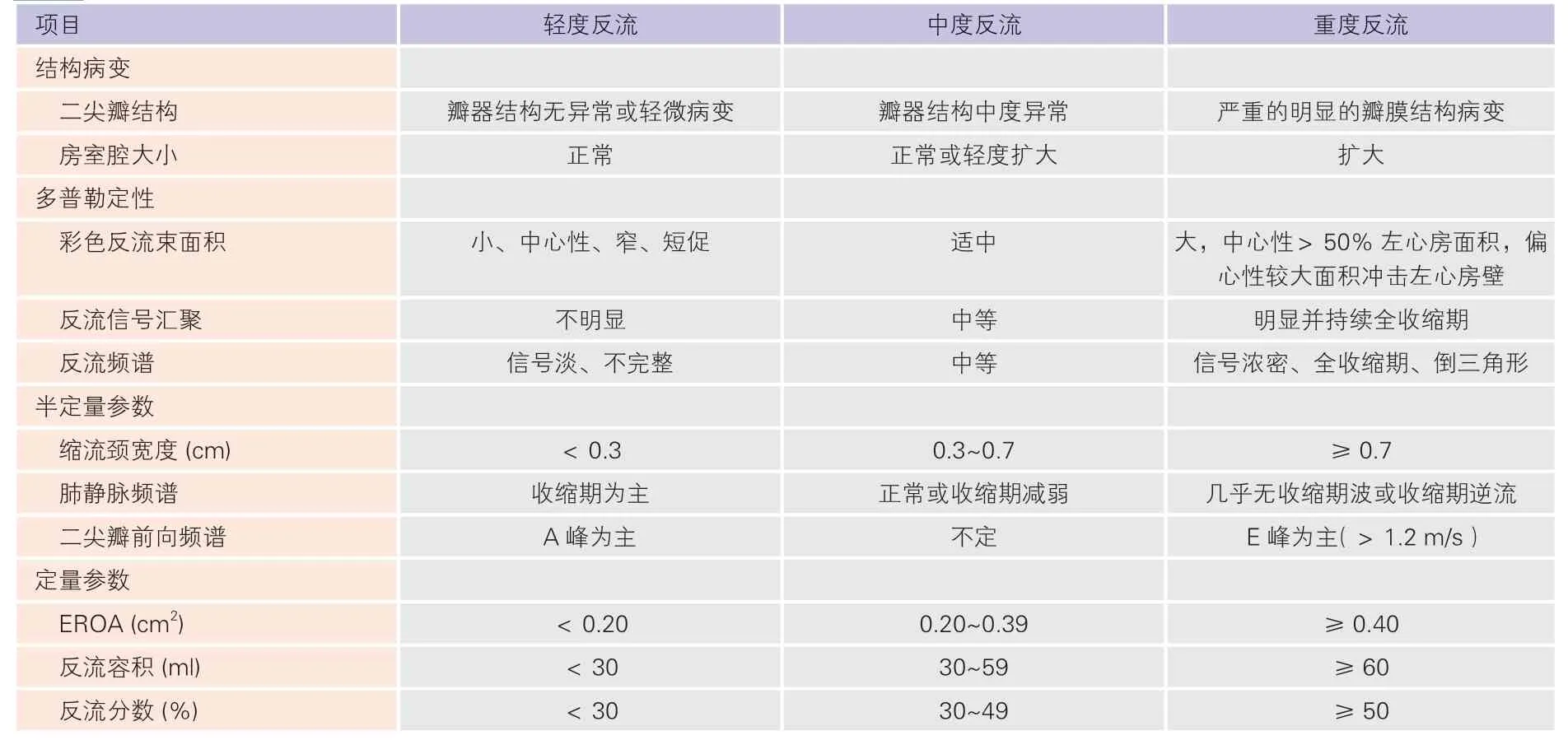
表9 二尖瓣反流程度分级标准

图3 二尖瓣反流评估流程图

表10 二尖瓣狭窄严重程度评估推荐建议及可选择测量参数
二尖瓣狭窄合并反流:应准确定量测定,必要时可行经食道超声心动图协助评估。
二尖瓣狭窄合并主动脉瓣疾病:合并主动脉瓣狭窄时,可能产生“低血流、低压差”效应,主动脉瓣狭窄的严重程度可被低估;合并主动脉瓣反流时,此时不能使用连续方程法和PHT 法评估二尖瓣狭窄,推荐二维超声切面直接测量瓣口面积。
二尖瓣狭窄合并功能性三尖瓣反流多见。
若普通经胸超声心动图二尖瓣图像显示不佳,可行经食道超声心动图检查进一步评估。尤其适用于拟行经导管二尖瓣球囊扩张术及既往有栓塞史等患者,可进一步明确左心房、左心耳有无血栓及左心耳排空速度。
2.4.3 二尖瓣狭窄分级标准(表11)

表11 二尖瓣狭窄程度的分级标准[10]
2.4.4 随访和术后评估
未干预的无症状重度二尖瓣狭窄患者应每年进行超声心动图随访评估,中度患者每2~3 年随访1 次,轻度患者每3~5 年随访1 次[1,6]。经导管二尖瓣联合切开术后推荐用二维描记法评估瓣口面积[15]。经导管二尖瓣球囊扩张成功后的管理与无症状患者相似,如果出现无症状再狭窄,应加强随访[1]。
2.5 三尖瓣病变
2.5.1 三尖瓣反流
三尖瓣反流分为继发性(功能性)和原发性反流。我国最常见继发性三尖瓣反流原因为左心瓣膜疾病和扩张型心肌病[16],肺动脉高压也较常见;原发性反流以黏液样病变居多,起搏器等右心腔导线装置引起的较为严重的三尖瓣反流也越来越多[17]。超声心动图主要用于诊断、评估三尖瓣反流严重程度,确定病因,测量右心房、右心室和下腔静脉的内径,估测肺动脉收缩压(肺动脉收缩压=4V2+右心房压力,其中V 为三尖瓣反流峰值速度)。三尖瓣反流严重程度基本评估与分级见表12、表13。
2.5.2 三尖瓣狭窄
三尖瓣狭窄相对并不常见,以风湿性心脏病为主要病因,且很少独立存在,常伴随二尖瓣狭窄及反流出现。目前主要通过连续多普勒对血流动力学进行分析,可以从三尖瓣流入道切面和四腔心切面进行血流评估(图4)。推荐在全呼吸周期或者呼气末进行评价。正常三尖瓣血流速度通常不会超过0.7 m/s,吸气时有加速。三尖瓣狭窄时,峰值流速>1.0 m/s,吸气时或会超过2.0 m/s。严重三尖瓣狭窄可以根据平均跨瓣压差≥5 mmHg,速度时间积分>60 cm,PHT ≥190 ms,连续方程测量的瓣口面积≤1.0 cm2进行判断,此外还有一些支持性征象有助于分级,如中等程度以上可伴右心房扩大或者下腔静脉明显扩张[10]。

表12 三尖瓣反流程度评估推荐建议及可选择测量参数

表13 三尖瓣反流程度的分级标准
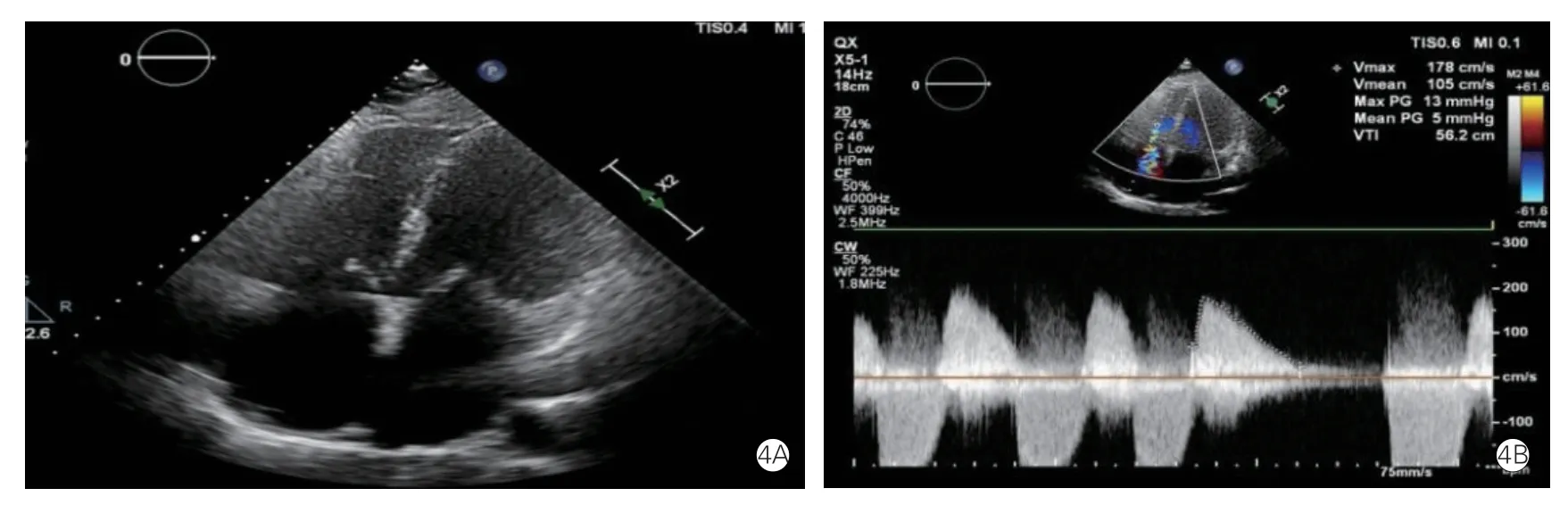
图4 三尖瓣狭窄患者二维超声心动图图像(4A)显示三尖瓣叶瓣缘增厚,开放受限,连续多普勒频谱(4B)提示三尖瓣压差增大
2.6 肺动脉瓣病变
2.6.1 肺动脉瓣反流
肺动脉瓣反流大多数是由于肺动脉瓣环扩大和肺动脉主干扩张引起。正常人群中约75%可以探查到微量的生理性肺动脉瓣反流,并无血流动力学意义。病理性肺动脉瓣反流不常见,大多伴有瓣膜结构异常。最常见病因是各种原因所致的肺动脉高压。继发性肺动脉瓣反流在肺动脉压力升高的患者中最为常见,但反流量通常较小,瓣叶结构正常。原发性肺动脉瓣反流主要见于肺动脉瓣叶异常以及肺动脉瓣狭窄球囊成形术后。严重的原发性肺动脉瓣反流可导致右心室扩大,但右心室功能通常保留。慢性重度肺动脉瓣反流可导致右心室功能障碍。
肺动脉瓣反流程度评估见表14、表15。在随访和术后评估方面,经胸超声心动图评估残余肺动脉瓣反流最常用的方法是综合运用多种技术,包括对右心室流出道、主肺动脉和肺动脉分支的彩色和频谱多普勒观测。
2.6.2 肺动脉瓣狭窄
超声心动图在肺动脉瓣狭窄的评估方面有重要作用,有助于明确狭窄部位、了解狭窄原因、评估狭窄程度以及选择恰当的治疗方案。肺动脉瓣狭窄的病因几乎均为先天性畸形。肺动脉瓣狭窄也可以是复杂先天性心脏病的一个组成部分,如法洛氏四联征等。严重的肺动脉瓣狭窄可能伴发右心室肥厚,最终可导致右心室和右心房扩大。通常采用右心室壁厚度>5 mm 者诊断右心室壁增厚。此外,检测其他伴发的畸形对于肺动脉瓣狭窄患者的评估十分重要。
肺动脉瓣狭窄严重程度基本评估,见表16。评价经导管肺动脉瓣球囊成形术后疗效最常用的指标是跨肺动脉瓣压差。另外需关注右心容量及功能的情况。经导管肺动脉瓣球囊成形术后长期随访并发症主要包括反流及再狭窄。
2.7 瓣膜术后评价的一般原则
显著的瓣膜狭窄和(或)反流最终需手术治疗。外科瓣膜置换是传统的手术方式,经导管瓣膜介入术近十年来发展迅速。瓣膜术后检查应在全面评价心腔大小、左心室收缩与舒张功能等基础上,着重观察人工瓣瓣体、瓣环、周围组织情况,评价瓣膜血流动力学状态(是否存在狭窄、反流),综合判断人工瓣功能与并发症情况。

表14 肺动脉瓣反流程度评估推荐建议及可选择测量参数

表15 肺动脉反流严重程度的分级标准

表16 肺动脉瓣狭窄程度的分级标准
2.7.1 瓣膜病手术治疗方式与人工瓣类型
瓣膜介入手术术式(表17):TAVR 与经导管二尖瓣夹合术(如MitraClip)是较早开展并积累了较多证据的介入术式[18-19]。

表17 瓣膜介入手术术式
外科术式包括瓣膜修复、成形、置换。外科瓣膜置换术常用人工瓣类型(表18)中,最常用的人工生物瓣是带支架的异种生物瓣,最常用的人工机械瓣为双叶碟瓣。人工瓣尺寸指的是瓣环外径,单位采用mm。
2.7.2 人工瓣评价的一般原则
人工瓣功能评价力求信息全面,包括临床资料、二维超声心动图、三维超声心动图、多普勒参数、术后基准超声参数、系列随访参数变化。理想的术后基准超声心动图应在术后4 周左右进行。后继随访应与术后基准检查做对比。人工瓣置换术后每年应行常规临床随访,视临床情况行超声心动图检查。人工生物瓣置换5 年后,即使临床情况无变化也建议每年复查超声心动图。

表18 外科瓣膜置换术常用人工瓣类型
临床资料方面应了解手术信息(术式、时间、人工瓣类型与尺寸)、患者信息(身高、体重、体表面积、血压、心率)、临床信息(症状、抗凝药物使用情况等)。二维超声心动图、三维超声心动图与多普勒参数,见表19。
2.7.3 人工瓣狭窄
设计梗阻:几乎所有置换的瓣膜因为设计原因均有轻微梗阻,瓣口血流速度与压差类似自体瓣轻度狭窄的水平。经导管置入瓣膜跨瓣压差一般低于外科置换术后瓣膜[20-21]。
人工瓣-患者不匹配(PPM):人工瓣的EOA 相对于患者体表面积过小时,发生PPM,导致术后跨瓣压差异常升高。人工主动脉瓣EOA >0.85 cm2/m2为 轻 度PPM,0.65~0.85 cm2/m2为 中 度PPM,<0.65 cm2/m2为重度PPM。PPM 的严重程度直接影响临床转归。人工二尖瓣EOA 不应小于1.2~1.3 cm2/m2[22]。
病理性狭窄:病因包括钙化衰败、血管翳、血栓形成等。仅凭高速血流不能诊断人工瓣狭窄,因可能继发于高流量状态、心动过速、PPM;相反,人工瓣功能障碍伴低心输出量时,跨瓣压差可不增高。人工瓣尺寸、术后基础及系列检查多普勒参数是重要参考。测量的EOA 低于参考面积2 个标准差时提示狭窄。同种异体瓣、无支架瓣膜和经导管置入瓣膜血流动力学特点与自体瓣相近;其他类型的人工主动脉瓣和二尖瓣,在心输出量正常或接近正常的情况下,提示狭窄的参考参数见表20、表21。

表20 提示人工主动脉瓣狭窄的多普勒参数*

表21 提示人工二尖瓣狭窄的多普勒参数
2.7.4 人工瓣反流
“生理性反流”:大多数机械瓣存在轻微或轻度的设计“冲洗反流”。许多生物瓣,尤其是无支架生物瓣,可存在轻度反流。反流的特点与人工瓣的设计工艺有关。
瓣膜介入术后残余反流与瓣周反流:二尖瓣介入(如MitraClip)术后残余反流可为偏心、多束。TAVR 术后瓣周反流与人工瓣设计、自体瓣钙化情况、手术因素等相关,新的瓣膜设计使术后瓣周反流显著减少。中量以上的瓣周反流影响预后。
病理性反流:外科置换术后早期少量的瓣周反流(瓣周漏)常见,通常随内皮化进程而消失,不影响预后。远期可因人工瓣衰败、感染等并发症产生反流,反流程度评价参照前述自体瓣反流。
术后并发症:术后早期可能的并发症包括PPM、几何形状不匹配、瓣周漏、梗阻(如腱索圈套造成卡瓣、介入瓣膜置换后LVOT 梗阻)、感染性心内膜炎、血栓等,晚期并发症包括开裂、人工瓣衰败、血栓形成、栓塞、血管翳、假性瘤形成、感染性心内膜炎、溶血等。
图像提供致谢:三尖瓣狭窄相关图像由权欣(中国医学科学院阜外医院)提供,余共识内图像由专家组和写作组成员提供
核心专家组成员(以姓氏拼音排序):吕秀章(首都医科大学附属北京朝阳医院),李爱莉(中日友好医院),刘芳(清华大学附属北京清华长庚医院),汪芳(北京医院 国家老年医学中心),王廉一(清华大学第一附属医院),吴永健(中国医学科学院阜外医院),杨颖(北京大学第一医院),张瑞生(北京医院 国家老年医学中心),朱天刚(北京大学人民医院),朱振辉(中国医学科学院阜外医院)
专家组成员(以姓氏拼音为排序):方理刚(北京协和医院),冯新恒(北京大学第三医院),黄国倩(复旦大学附属华山医院),吕秀章(首都医科大学附属北京朝阳医院),李爱莉(中日友好医院),刘芳(清华大学附属北京清华长庚医院),马小静(武汉亚洲心脏病医院 武汉亚心总医院),齐欣(北京医院 国家老年医学中心),汪芳(北京医院 国家老年医学中心),王廉一(清华大学第一附属医院),吴永健(中国医学科学院阜外医院),杨杰孚(北京医院 国家老年医学中心),杨颖(北京大学第一医院),张瑞生(北京医院 国家老年医学中心),郑春华(首都儿科研究所附属儿童医院),朱天刚(北京大学人民医院),钟优(北京医院 国家老年医学中心),朱振辉(中国医学科学院阜外医院)
执笔者:郭颖(北京医院 国家老年医学中心),张瑞生(北京医院 国家老年医学中心)
写作组成员(以姓氏拼音为序):蔡绮哲(首都医科大学附属北京朝阳医院),靳文英(北京大学人民医院),孔令云(清华大学附属北京清华长庚医院),裴作为(北京医院 国家老年医学中心),向伟(清华大学附属北京清华长庚医院),朱火兰(北京医院 国家老年医学中心),翟亚楠(中日友好医院),周子裕(北京医院 国家老年医学中心)
利益冲突:所有作者均声明不存在利益冲突
