Gαi2C-末端肽段靶向超声造影剂的制备及靶向性评价
2021-03-08穆玉明王春梅周贤惠
蒋 华 穆玉明 王春梅 周贤惠 张 健
1.成都大学附属医院老年病科,四川成都 610081;2.新疆医科大学第一附属医院超声医学中心心脏超声诊断科,新疆乌鲁木齐 830011;3.新疆医科大学第一附属医院心脏中心,新疆乌鲁木齐 830011
靶向超声造影剂是近年来超声医学领域研究的热点之一。超声靶向微泡破坏(ultrasound-targeted microbubble destruction,UTMD)是一种非病毒载体的基因转染方式,其具有操作简单、安全快捷、靶器官高度特异性等优势,可用于心肌基因治疗[1-3]。
研究表明[4],迷走神经张力异常与阵发性房颤的发生密切相关,阻断迷走神经可以降低房颤的发生率[5]。G 蛋白信号转导途径通过调控自主神经活性从而达到诱发和维持房颤发生的作用。Gαi2C-末端肽段(Gαi2C-terminal peptide,Gαi2ctp)可以干扰Gαiβγ 三聚体的解离,阻断G 蛋白信号转导途径,降低自主神经介导的房颤发生[6-7]。故本研究采用静电吸附法将其连接到造影剂SonoVue 微泡表面,并量化寻找最佳携带剂量,利用UTMD 提高其到达心脏的效率,从而为Gαi2ctp 成功转导至体内发挥其生物学效应奠定基础。
1 材料与方法
1.1 主要试剂与仪器
超声微泡造影剂SonoVue(意大利BRACCO,15A022A);荧光标记的Gαi2ctp[5-羧基四甲基罗丹明(5-TAMRA)-Gαi2ctp,广州特立生物科技有限公司特约合成];流式细胞仪(美国,Beckman Cytometer GALLIOS);漩涡混合器(广州,IKAMS-3);荧光倒置显微镜(德国,LEICA CTR6000);彩色多普勒超声诊断仪(美国,GE VIVID 7 DIMENSON)。
1.2 Gαi2ctp 靶向微泡的制备及分组
采用静电吸附法制备靶向微泡,根据Aistrup 等[6]的研究结果,将5-TAMRA-Gαi2ctp 分为0.5、1.5、3 mg/L三组,生理盐水溶解后与SonoVue 微泡混悬液混和,室温下充分混匀,调整pH 值至4.5,漩涡混合器振荡约1 min,室温下孵育、静置。采用浮选法[8]洗涤:将混悬液置于离心管中,加入等量的0.9%氯化钠,转速400 r/min、离心1 min、离心半径1.5 mm(至微泡聚集在液相的顶部),弃去下清液,重复洗涤2 次。每组平行6 次。
1.3 Gαi2ctp 靶向微泡的鉴定
1.3.1 体外评价 ①荧光显微镜下观察Gαi2ctp 与微泡的结合情况,靶向微泡的形态及分布;②流式细胞仪评价静置0.5、1、2 h Gαi2ctp 靶向微泡的携带率及洗涤前后Gαi2ctp 靶向微泡携带率。
1.3.2 体内评价 ①实验分组及房颤模型制备:成年健康杂种犬14 只,雌雄不拘,体重14~23 kg,平均(15.6±4.8)kg;年龄2~5 岁,平均(2.3±1.1)岁。依据随机数字表将其分为实验组(携1.5 mg/L Gαi2ctp 靶向微泡)及对照组(SonoVue 空白微泡),每组7 只,参照Xue 等[9]的方法制备犬房颤模型。本实验通过新疆医科大学第一附属医院动物实验中心伦理委员会审核批准(批准号:A-20101020001)。
②利用UTMD 靶向转导Gαi2ctp:两组犬分别由静脉注入携1.5 mg/L Gαi2ctp 靶向微泡和SonoVue空白微泡,应用相同的超声条件进行辐照治疗:采用Vivid 7 彩色多普勒超声诊断仪,M3S 探头,二次谐波造影模式,机械指数爆破前后分别为0.08、1.0,FLASH击碎微泡,心电触发在左心房定点爆破,每6 个心动周期击碎一次,直至心腔内微泡完全消失。实验结束后,行犬左心房组织冰冻切片,荧光显微镜下观察犬左心房及肺静脉荧光物质表达情况。
1.4 统计学方法
采用SPSS 17.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,多个时间点比较采用重复测量方差分析,多组间比较采用方差分析,两组间比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 微泡的外观及荧光检验
Gαi2ctp 靶向微泡荧光显微镜下可见外壳荧光染色均匀,呈环状,微泡表面发出橙红色荧光。见图1。

图1 Gαi2ctp 靶向微泡微荧光显微镜下图(200×)
2.2 流式细胞仪检测结果
2.2.1 不同静置时间Gαi2ctp 靶向微泡携带率比较三组时间、组间及交互作用比较,差异均有统计学意义(均P <0.05)。1.5 mg/L 组静置0.5、1、2 h Gαi2ctp靶向微泡携带率高于3 mg/L 组,差异均有高度统计学意义(均P <0.01);1.5 mg/L 组与0.5 mg/L 组静置0.5、1、2 h Gαi2ctp 靶向微泡携带率比较差异无统计学意义(P >0.05)。3 mg/L 组不同时间Gαi2ctp 携带率比较,差异有统计学意义(F=7.330,P=0.030)。见表1。
2.2.2 洗涤前后Gαi2ctp 携带率比较 1.5 mg/L 组洗涤前后携带率比较,差异无统计学意义(P >0.05)。3 mg/L 组和0.5 mg/L 组洗涤后Gαi2ctp 靶向微泡携带率低于携带前,差异均有高度统计学意义(均P <0.01)。见表2、图2。
表1 不同静置时间Gαi2ctp 靶向微泡的携带率比较(%,,n=6)
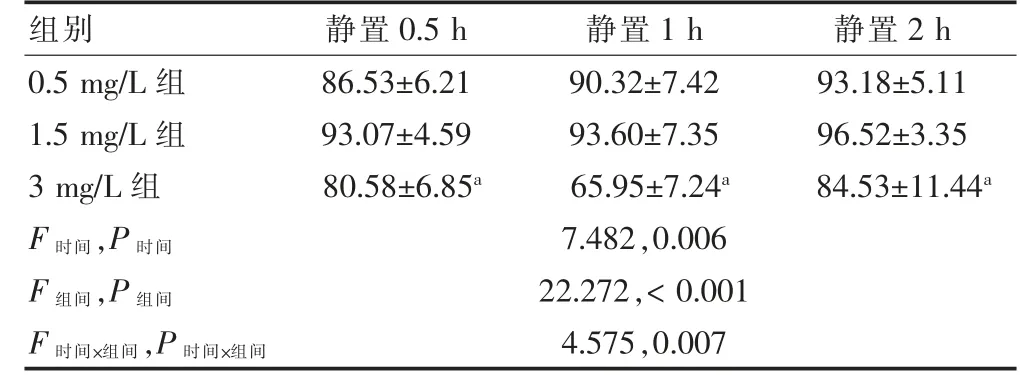
表1 不同静置时间Gαi2ctp 靶向微泡的携带率比较(%,,n=6)
注:与1.5 mg/L 组同期比较,aP <0.01。Gαi2ctp:Gαi2C-末端肽段
表2 洗涤前后Gαi2ctp 靶向微泡携带率比较(,n=6)

表2 洗涤前后Gαi2ctp 靶向微泡携带率比较(,n=6)
注:与本组洗涤前比较,aP <0.01。Gαi2ctp:Gαi2C-末端肽段
2.3 Gαi2ctp 微泡靶向性的体内评价
荧光显微镜下观察,实验组左心房及肺静脉激发出橙红色荧光,而对照组无荧光物质聚集。见图3。
3 讨论
超声分子成像是一种新型的非侵入性生物分子显像技术,而靶向微泡造影剂的构建是超声分子成像的基础[10]。微泡造影剂与特异性抗体或配体偶联的结合方法多种多样,每种方式各有优劣[11-13]。本实验采用的静电吸附法是利用脂质微泡的化学双极性(疏水端和亲水端),通过自身离子键、物理吸附(范德华力)等方法将目标配体Gαi2ctp 偶联在微泡壳膜上,制成靶向微泡。造影剂SonoVue 含磷脂单层,性质稳定,安全性好。将罗丹明磺化的目的是通过亲电取代反应用磺酸基(-SO3H)取代其本身的氢离子,增加其水溶性和生物学活性。近几年,不少国内学者们尝试用静电吸附法制备靶向造影剂[14-16]。岳媛媛等[17]利用静电吸附法将靶向微泡与大鼠骨髓间充质干细胞偶联,制备出靶向微泡-干细胞复合体,进一步拓宽了此方法在超声医学领域的应用。本研究结果显示,靶向造影剂在荧光显微镜下激发出橙红色荧光,1.5 mg/L 组Gαi2ctp 微泡造影剂携带率最高,洗涤前后携带率变化不大。
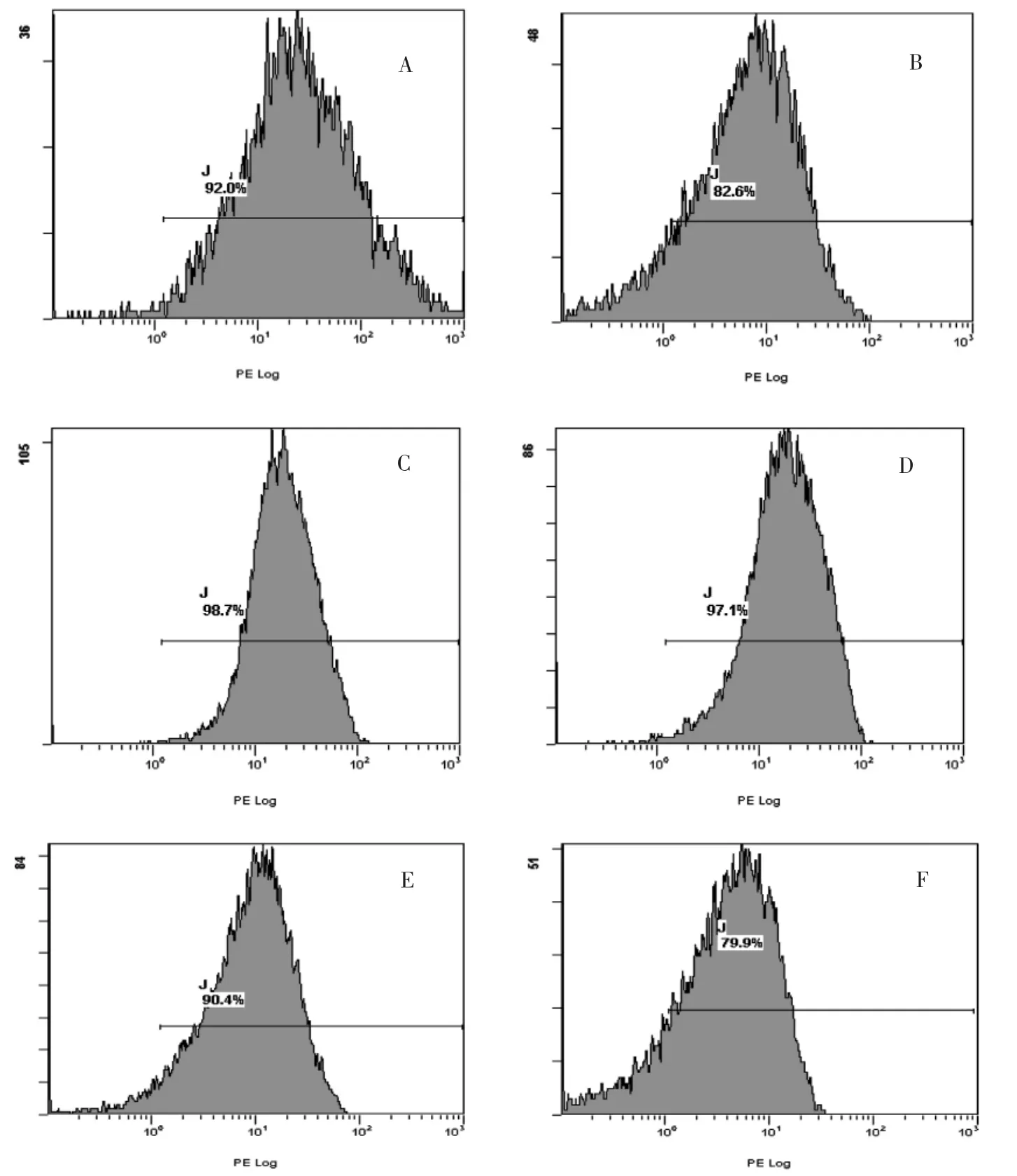
图2 各组Gαi2ctp 靶向微泡造影剂携带率检测结果
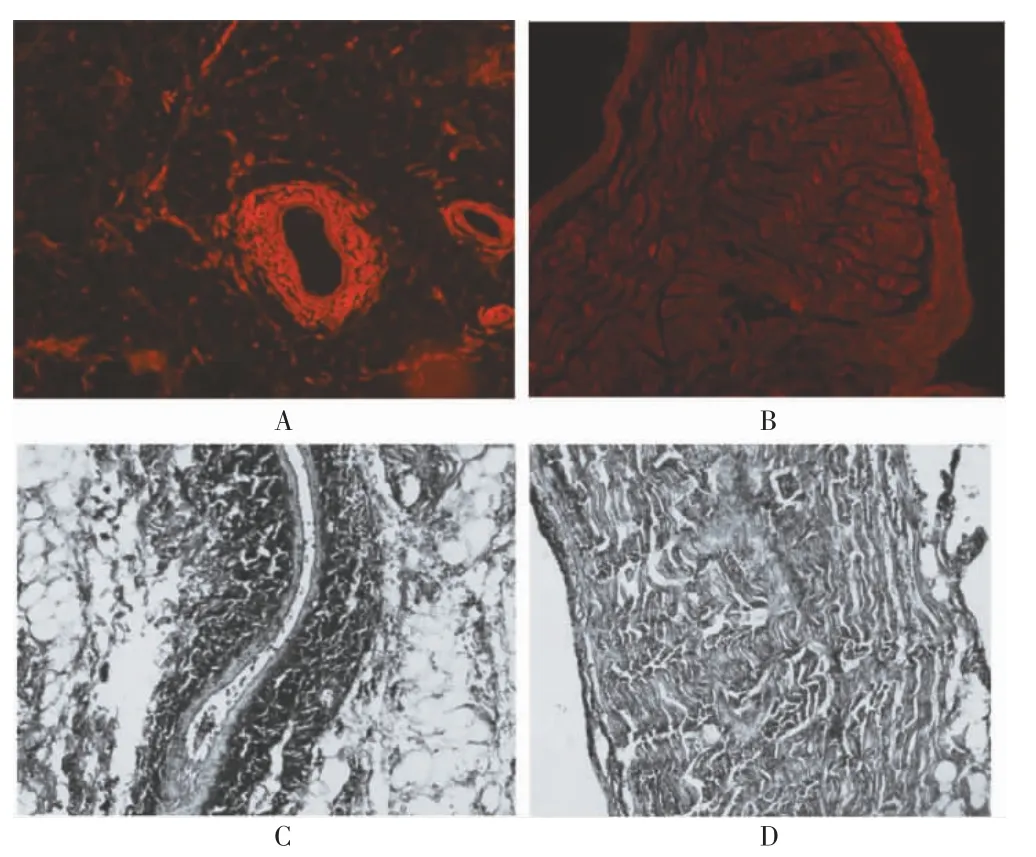
图3 左心房及肺静脉冰冻切片荧光显微镜结果图(50×)
制备成功的Gαi2ctp 造影剂微泡能否成功到达靶组织,是验证其靶向性的关键。近年来,UTMD 成为超声医学领域一种新型的基因传输及靶向给药方法,广泛应用于肿瘤、心血管疾病的基因治疗等领域[18-21]。当靶向微泡到达特定组织时,利用UTMD 产生的空化效应、声孔效应、内吞作用和声辐射力等,提高细胞和毛细血管的通透性,从而增加基因转染效率,是一种理想的基因载体系统[22-23]。Chen 等[24]应用UTMD 将含胰高血糖素样肽-1 基因PB 转座子的质粒微泡转导至心肌病大鼠体内,通过胰高血糖素样肽-1 基因刺激心肌再生,治疗阿霉素心肌病。迟婷婷等[25]应用UTMD将成纤维细胞生长因子(aFGF)转导至大鼠心肌组织,证实微泡靶向转导aFGF 可以改善糖尿病心肌病大鼠左心室心肌血流灌注。本研究试图利用UTMD 将Gαi2ctp 定向输送至犬左心房,体内实验结果发现,实验组犬左心房及肺静脉可见明亮的橙红色荧光表达,对照组未出现橙红色荧光,提示Gαi2ctp 成功转导至犬左心房及肺静脉组织。
因此本研究认为利用静电吸附法可以成功制备Gαi2ctp 靶向微泡,其性质稳定,目的肽段携带率高,靶向性明确,方法简便易行,从而为研究外源性Gαi2ctp的生物学效应提供有力的支持。
