聚己内酯微泡的制备与表征
2019-01-02付慧莉
付慧莉,程 戈
武汉工程大学材料科学与工程学院,湖北 武汉 430205
微泡是一种增强心血管体系超声成像信号的造影剂[1]。这种造影剂通常是直径几个微米、包覆生物惰性气体的空心微球,具有脂质或高分子(如血清蛋白、聚乙烯醇和聚酯等)的外壳[2-7]。当微泡分散到血液中,空腔内的气体会在超声波的作用下周期性地收缩和膨胀、发出超声波信号而被检测[8]。微泡可作为超声示踪剂用于人体[9-11],同时,也可作为药物与生物活性气体的载体[12-14],在超声波的辅助下通过形态结构的变化而进行药物与生物活性气体(如NO等)的传递和释放。与脂质微泡相比,高分子微泡具有固定的外壳,从而拥有在特定环境下优良的稳定性,如长期包覆储存及传递生物活性气体等。其中生物可降解聚酯微泡不仅能稳定保持空腔内的气体,而且有可能通过调节聚酯外壳的降解而控制气体的逸出。因此,聚酯微泡可以做为一种稳定可控的生物活性气体载体向人体内传递释放包覆的气体,释放的速率可通过调节聚酯外壳的降解速率来调控。本文用溶剂挥发界面沉积法制备了一种以聚己内酯为外壳主体、核心包覆氮气的空心微泡,并对微泡的结构、形貌、粒径分布、超声成像和包覆气体的持久性进行了表征,以验证其做为生物活性气体载体的可能性。
1 实验部分
1.1 化学试剂与仪器
人血清白蛋白、乙酸异丙酯、环辛烷、戊二醛(Sigma-Aldrich),羧基端基聚ε-己内酯(Mr=105)(Lakeshore Biomaterials),荧光染料 BODIPY493/503(Invitrogen)。
蠕动泵(Masterflex);高速台式离心机(Sig⁃ma);AdventurePlus冻干机(Labconco);Sequoia 512超声诊断仪(Siemens Medical Solution)。
1.2 实验方法
1.2.1 聚己内酯微泡的制备 本文制备的聚己内酯微泡的结构示意图如图1所示。微泡由溶剂挥发界面沉积法制备[15],将聚己内酯沉积在交联的人血清白蛋白外网的内侧形成微泡的聚合物外壳,用以包覆核心气体。具体操作为:将44 g含5%(质量分数,下同)聚己内酯和13%环辛烷的乙酸异丙酯溶液加入到25 g含6%人血清白蛋白的水溶液中,用蠕动泵使该混合液通过微孔金属滤芯进行乳化,所得乳液在350 g含0.1%戊二醛的水溶液中交联固化为包覆溶剂液滴的微球,然后分装入血清瓶,在冻干机中冻干并充入氮气压盖封口保存。将荧光染料BODIPY493/503加入到聚己内酯溶液中混合并用上述方法制备得到荧光聚己内酯微泡。

图1 聚己内酯微泡的结构示意图Fig.1 Schematic diagram of polycaprolactone microbubble structure
1.2.2 聚己内酯微泡的结构、形貌与粒径分布表征 用生理盐水将冻干的聚己内酯微泡重新分散、洗涤、离心收集,并配制微泡悬浮液。将悬浮液滴加在载玻片上,加盖盖玻片,在荧光显微镜下观测微泡的结构与粒径分布。将微泡悬浮液中的微泡滤出,真空干燥喷金并通过扫描电子显微镜(scanning electron microscope,SEM)表征其形貌和结构。通过CoulterCounter Multisizer III粒度分析仪对微泡悬浮液进行粒径分布和浓度的检测。
1.2.3 聚己内酯微泡的超声成像 将已知浓度的聚己内酯微泡悬浮液稀释并配制成一系列梯度浓度,将每一个浓度的微泡悬浮液装入样品室中,在预先除气的水浴中通过超声诊断仪进行微泡的超声成像。成像使用15L8探头、采用对比脉冲序列技术CPS 7MHz MI1进行。所得超声显影图像中指定区域内的微泡的平均信号强度由软件Image J进行分析。
1.2.4 聚己内酯微泡在生理环境下的稳定性表征 将微泡浓度为8.0×105mL-1的微泡悬浮液分装入若干样品室中,放入37℃培养箱中孵育,在设定的不同时间点分别取出3个平行样品,用上述方法进行超声成像并分析图像中指定区域内的微泡的平均信号强度。
2 结果与讨论
2.1 聚己内酯微泡的结构与形貌
重新分散的聚己内酯微泡漂浮在悬浮液的表层,表明因为包覆气体使微泡的密度小于水,间接证明成功制备了微泡。聚己内酯微泡的明场和荧光光学显微镜图分别如图2(a)和图2(b)所示。图2(a)中所制备的聚己内酯微泡分散均匀,直径为几个微米,微泡中间呈透亮的白色,可以证明微泡为内部中空的球型结构;图2(b)中混合荧光染料的聚己内酯微泡外壳在光源的激发下发射出绿色荧光,微泡中部没有荧光,表明内部中空没有聚合物和荧光染料,同样证实了微泡的空心结构。图2(c)为聚己内酯微泡的SEM图,微泡的外壳完整,大体平滑,略带褶皱,在真空干燥的制样条件下,微泡内部的气体被抽出,外壳塌陷,进一步证明了所制备微泡的中空薄壳结构,且微泡的粒径为2 μm~3 μm,与光学显微镜的观察结果吻合。
2.2 聚己内酯微泡的粒径分布
微泡的粒径分布如图2(d)所示,微泡的粒径尺寸分布在1 μm~10 μm,绝大部分集中在1 μm~5 μm之间,微泡的平均粒径为2.2 μm。微泡的这一尺寸不仅可以使其做为心血管超声造影剂在血管中自由通过,而且使其内腔具有较大的容量,可储存生物活性气体。

图2 聚己内酯微泡:(a)明场光学显微镜图(200X),(b)荧光光学显微镜图(200X),(c)SEM图,(d)粒径分布图Fig.2 Polycaprolactone microbubbles:(a)bright-field microscopic image(200X),(b)fluorescence microscopic image(200X),(c)SEM image,(d)size distribution
2.3 聚己内酯微泡的浓度与超声成像信号强度的关系
聚己内酯微泡的浓度与超声成像信号强度的关系如图3(a)所示。在微泡浓度处于103mL-1至107mL-1之间时,随着微泡浓度增加超声成像信号逐渐增强,从0.3 dB增强到24.4 dB。其中,当微泡浓度处于104mL-1和106mL-1之间时,超声成像信号强度随着微泡浓度的增加明显增强,从1.6 dB增强到23.5 dB。微泡浓度增加至107mL-1时,超声显影图像信号强度增强缓慢,趋于饱和。
2.4 聚己内酯微泡生理环境下的稳定性
图3(b)给出了在37℃培养箱中孵育长达14 d的聚己内酯微泡的超声成像信号强度。由图3(b)可知,在持续14 d的孵育中,微泡的超声显影信号强度与孵育之前相比没有明显的变化,孵育14 d后的微泡超声成像信号强度(23.4±1.3)dB与孵育前的信号强度(22.3±0.5)dB相比没有统计学上的差异(概率大于0.05)。微泡的超声信号是由微泡内所包覆的气体在超声波的作用下震动所产生,微泡的超声信号稳定,表明微泡所包覆的气体仍然稳定存在,没有逸出。这一结果表明至少在14 d内微泡可做为稳定的超声示踪剂,也可做为稳定的药物和生物活性气体载体。
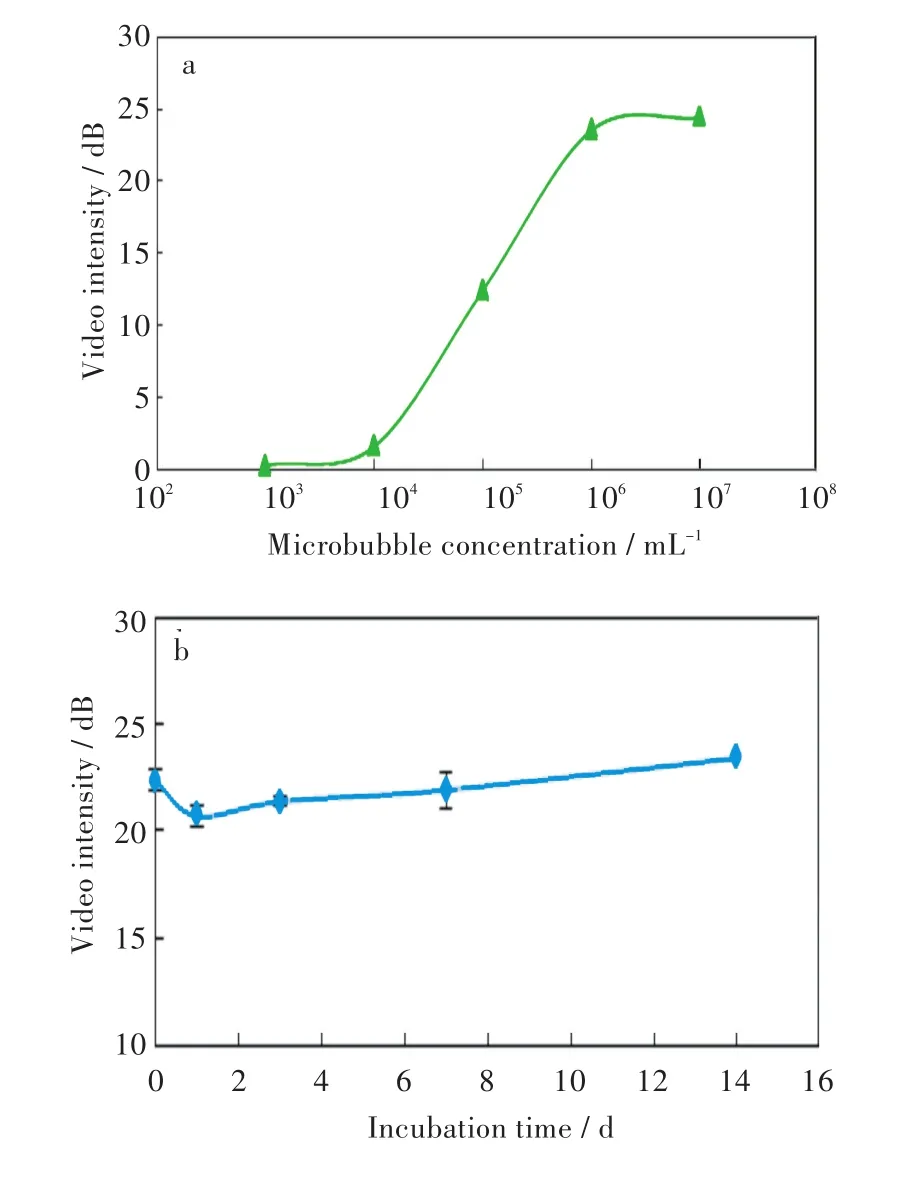
图3 聚己内酯微泡的超声成像信号强度与(a)浓度,(b)孵育时间的关系Fig.3 Relationship between video intensity of polycaprolactone microbubbles and(a)microbubble concentration,(b)incubation time
3 结 语
本文用溶剂挥发界面沉积法成功制备了以聚己内酯为外壳主体、核心包覆氮气、平均粒径为2.2 μm的微泡,并通过超声成像对微泡在生理条件下包覆核心气体的稳定性进行了表征。结果表明聚己内酯微泡能够稳定包覆核心气体至少14 d,具备成为优质超声示踪剂和药物与生物活性气体载体的潜力。
