半红树植物黄槿内生菌及其代谢产物的研究进展
2021-03-08蒋圆婷陈德力梁寒峭
蒋圆婷,刘 杨,陈德力,梁寒峭*
1北京城市学院生物医药学部,北京 100083;2中国医学科学院北京协和医学院药用植物研究所海南分所 海南省南药资源保护与开发重点实验室,海口 570311;3中国医学科学院北京协和医学院药用植物研究所,北京 100193
红树林植物是生长在热带及亚热带海岸潮间带的一类植物,受海水周期性浸淹的木本群落,具有很强的环境适应能力[1,2]。红树林是红树林生态系统的重要组成部分,覆盖了全世界60%~70%的热带及亚热带海岸线,对抵御海浪、保护海岸,维护周边的生态平衡起到积极作用[3,4]。红树植物通常分为真红树植物和半红树植物这两种,前者只能出现在潮间带,后者不仅能出现在河口潮间带,还能延伸进入到陆地生态系统,如黄槿(Hibiscustiliaceus)、海芒果(Cerberamanghas)、玉蕊(Barringtoniaracemosa)、杨叶肖槿(Thespeaisapopulnea)等[5-7]。黄槿(H.tiliaceus)为锦葵科(Malvaceae)木槿属(Hibiscus)泛热带的半红树植物[8,9]。黄槿在热带和亚热带的沿海及内陆都有分布,并且在太平洋群岛最多见,而在我国,黄槿主要分布在海南、广东、广西及福建等沿海省市[10,11]。黄槿不仅是优良树种,而且具有很高的经济及生态价值。其木材可以加工制作为工具,树皮纤维可用于制作绳,由于其根系发达,具有防风固沙的功能[12]。同时,黄槿的各部分还存在着潜在药用价值。
《全国中草药汇编》[13]中仅有收载黄槿(H.tiliaceus)和海芒果(C.manghas)两种半红树植物。其中黄槿的叶、树皮和花均有药用价值,其性甘、淡、微寒,且具有清热止咳、解毒消肿等功效[14]。在国外热带沿海地区,如巴西等地,也会将黄槿作为治疗高血压、发热、肝脏疾病的传统民间药物在使用[15]。根据现代药理学的研究,黄槿具有抗炎[16]、抗氧化[12]及抗肿瘤[17]等多种生物活性。半红树植物黄槿含有丰富多样的内生菌及代谢产物,综述相关的研究进展,有助于对黄槿及其内生菌的药效物质基础来源做出深入探究。
植物内生菌是指其生活史中某一阶段或整个阶段生活在生长健康的植物组织或细胞内,并对宿主植物没有引起明显病害症状的一类微生物群[18]。许多研究表明,植物内生菌会产生与宿主植物相同或相似的结构[19,20]。Xiao等[21]采用高效液相色谱法测定人参培养须根及内生菌中10种人参皂苷单体的含量,结果Rg1、Re、Rb1的含量测定均符合2010版药典的要求。曼琼等[22]筛选出与宿主植物甘草具有相同或相似药理活性的甘草内生菌,并证实其对痰浊阻肺模型大鼠有较好的治疗效果。目前对于此项发现其中的原因提出了三种学说,虽然具体作用机制尚不明确,但都强调了植物内生菌的作用[23]。植物内生菌的次级代谢产物常用于进行微生物转化,目的是得到具有新颖结构的活性先导化合物[24]。目前已有众多报道,从植物内生菌中得到结构合理,活性更优的药物先导分子,这充分表明植物内生菌蕴藏巨大潜力[25-31]。从黄槿植物体中分离出能具有活性物质的内生菌,不仅可以为黄槿的药用资源开发利用进一步提供科学依据和有利参考,还可以为新药的发现提供先导化合物。该文就半红树植物黄槿内生菌的多样性、菌种鉴定、药理作用和活性成分进行了整理和综述,以期为黄槿内生菌的后续研究提供思路和参考。
1 黄槿内生菌的多样性和鉴定
1.1 黄槿内生菌的多样性
红树林是位于陆地海洋间的典型热带生态系统,生长环境特殊,具有强光照、强酸性、高含盐量和高温等特点,因此红树林拥有丰富的内生菌资源,是天然活性产物的有效来源[32-34]。黄槿作为宿主植物常用以研究红树林内生菌资源及其次级代谢产物。据文献报道表明,目前对内生菌的研究主要集中于内生真菌和放线菌,黄槿也同样不例外[35]。
2006年,Lin等[36]采集海南东寨港红树林保护区的黄槿,并且从其各个部位共分离得到17株黄槿内生真菌,各部位菌株的数量分别为根5株、茎6株、叶3株、树皮3株。其中已鉴定的3株黄槿内生菌菌株为镰刀菌属(Fusariumsp.)真菌,部位都在根部。镰刀属也同样为研究较为广泛的内生真菌类群,已发现存在镰刀菌属内生真菌的药用植物有银杏[37]、红茄苳[38]及龙牙草[39]等。2007年,Li等[40]从海南半红树植物黄槿的叶片中分离得到了菌株GT20036029,并对该菌株的代谢产物进行了化学成分分析,具体菌种的鉴定结果目前仍未可知。Liu等[41]采集来自海南省文昌的红树林半红树植物黄槿,并从其根部分离得到菌株,经鉴定为草酸青霉(Penicilliumoxalicum)。2008年,Li等[42]从海南黄槿中分离得到内生真菌赤散囊菌(Eurotiumrubrum)。2010年,Yan等[43]从我国海南的半红树植物黄槿的枝条上分离出内生真菌赤散囊菌(EurotiumrubrumG2)和内生真菌团青霉(Penicilliumcommune)。散囊菌属(Eurotium)真菌属于子囊菌纲(Ascomycetes)散囊菌目(Eurotiales)散囊菌科(Eurotiaceae)真菌,在自然界经常可见的是它们的无性阶段,如常见的曲霉属(Aspergillussp.)和青霉属(Penicilliumsp.)。Yan等[43]对同样来源于黄槿枝条的内生真菌团青霉(Penicilliumcommune)也进行了研究。青霉属(Penicillium)真菌属于半知菌门(Deuteromycotina)丝孢纲(Hyphomycetes)丝孢目(Hyphomycetales)丝孢科(Hyphomycetales)真菌。青霉属是植物内生菌种研究较多的内生真菌类群之一,在具有药用价值的植物内生菌中发现有青霉属内生真菌,如药用植物番红花[44]、水飞蓟[45]等。2012年,Li等[46]从广西半红树植物如杨叶肖槿、黄槿等12个样品中,分离出纯化的菌株总计86株,其中从黄槿中分离得到了一株内生真菌Penicilliumsp.LD-68。Du等[47]从海南东寨港采集的海洋红树林植物黄槿中分离出一株内生真菌AspergillussydowiiEN-198。
放线菌主要是分布在土壤中,且以链霉菌、小单孢菌及游动放线菌为主。Li[48]从海南红树林自然保护区中采集黄槿,并且将黄槿的根际土壤、根部、茎部、叶部分别作为样品进行研究。由于放线菌在自然界中主要栖息的地方是土壤,因此从黄槿的根际土壤样本中分离得到的放线菌的数量和种类数相对较多,共分离出73种放线菌,包括链霉菌属、原小单孢菌属、小单孢菌属、诺卡氏菌属等共4个属。从黄槿根部分离出63种放线菌,其中的优势菌群同样是链霉菌。从黄槿茎部和叶部分别分离出27种和19种放线菌,其中茎部放线菌包括链霉菌、诺卡氏菌属,叶部分离出的放线菌中包括链霉菌属、小单孢菌属和束村氏菌属。在研究中,黄槿相较于同为红树林植物的海漆和秋菊,黄槿的植株体生长环境最为放线菌所偏好。目前对植物内生菌中内生放线菌的研究也同样较为集中,不仅是黄槿,还有雷公藤[49,50]、秋茄树[51]、益智[52]等药用植物中都发现有链霉菌或诺卡氏菌属。
1.2 黄槿内生菌鉴定
内生菌的鉴定方法主要包括外观形态学鉴定、生理生化水平鉴定以及分子生物学鉴定等。黄槿内生菌的鉴定:首先结合《常见细菌系统鉴定手册》[53]、《真菌鉴定手册》[54]等,观察并记录内生菌菌落的大小、生长速度、颜色、气生菌丝形态等特征,并且利用光学显微镜观察菌丝颜色、有无产孢、孢子形态、有无横隔等微观特征,进行形态学的初步鉴定[55];之后进行生理生化鉴定(包括碳氮源利用能力、酶反应和血清学反应等)[56];最后是进行分子生物学鉴定。Yan等[43]通过克隆真菌核糖体rDNA基因转录间隔序列(ITS1-5.8S-ITS2全长序列)测序并与Genbank中已知真菌菌株相应序列比对结果鉴定出内生真菌赤散囊菌(EurotiumrubrumG2)以及内生真菌团青霉(Penicilliumcommune)。2012年,Li[48]将三株放线菌的16S rDNA序列在Ez Txon上进行BLAST比对,应用N-J法构建其系统发育树确定三株放线菌的系统发育地位,从而初步鉴定菌种。
2 黄槿内生菌次级代谢产物活性成分
2.1 生物碱类化合物
Li等[40]从黄槿内生真菌GT 20036029中分离得到1个生物碱类化合物,其化学结构为N-(2-羟基苯乙基)乙酰胺(1)。Li等[57]从黄槿内生真菌赤散囊菌的菌丝体及发酵液中分离出14个含吲哚的二酮哌嗪生物碱类化合物。其中有两个新的生物碱类化合物,分别是(cyclo-L-alanyl-4,5-diisopentenyl-2-(1′,1′-dimethylallyl)-8-(Z)-ene-tryptophan)(2)、(cyclo-L-alanyl-5,7-diisopentenyl-2-(1′,1′-dimethylallyl)-8-(Z)-ene-tryptophan)(3)。Yan等[43]通过固体发酵培养从黄槿赤散囊菌(EurotiumrubrumG2)的提取物中鉴定出18个含吲哚的二酮哌嗪生物碱类化合物(2~19),其中化合物12确定为新化合物,命名为12-nor-12-oxo-eurotechinulin B。并且从黄槿团青霉的提取物中鉴定出2个吲哚类生物碱,分别为化合物3-(3-indolyl)-2-(N-acetyl)-propanoic acid(20)和化合物(3-indolylacetic acid methyl ester)(21)。Du等[47]利用多种分离手段从黄槿内生真菌AspergillussydowiiEN-198的发酵液中分离出2个生物碱类化合物,分别是N-[2-(4-吲哚)乙基]乙酰胺(22)和N-[2-(4-对羟基苯酚)乙基]乙酰胺(23)。化合物22和23分别命名为dehydrovariecolorin L和dehydroechinulin。化合物1~23的结构见图1。

图1 黄槿内生菌中生物碱类化合物的结构Fig.1 Structures of alkaloids in H.tiliaceus endophytes
2.2 环二肽与核苷类化合物
Li等[40]利用多种色谱技术从黄槿内生真菌GT 20036029中分离得到5个核苷类化合物。分别为环(L-脯氨酸-D-异亮氨酸)(24)、环(L-亮氨酸-L-脯氨酸)(25)、环(D-亮氨酸-L-脯氨酸)(26)、环(亮氨酸-酪氨酸)(27)、环(苯丙氨酸-丝氨酸)(28)。Yan等[43]从黄槿内生真菌团青霉的提取物中分离得到多种结构的化合物,其中有3个属于核苷类化合物,分别为尿嘧啶-2′-脱氧核苷(thymidine)(29)、尿嘧啶(uracil)(30)、胸腺嘧啶(thymine)(31)。Du等[47]利用乙酸乙酯萃取黄槿内生真菌AspergillussydowiiEN-198的发酵液,采用硅胶柱层析、葡聚糖凝胶柱层析以及制备薄层层析等手段分离确定了6个核苷类化合物的结构。分别是环-(S-脯氨酸-S-苯丙氨酸)(32)、环-(S-脯氨酸-S-亮氨酸)(33)、环-(S-苯丙氨酸-S-色氨酸)(34)、胸腺嘧啶脱氧核苷(35)、尿嘧啶脱氧核苷(36)、尿嘧啶核苷(37)。其中化合物32和33为首次从黄槿内生真菌AspergillussydowiiEN-198中提取分离。Liu等[41]从黄槿内生菌草酸青霉(092007)菌菌丝体的丙酮提取物中分离得到6个环二肽类化合物,利用多种波谱技术确定其结构分别为:环(苯丙异亮)二肽(38)、环(苯丙-缬)二肽(39)、环(异亮-亮)二肽(40)、环(缬-缬)二肽(41)、环(脯-缬)二肽(42)、环(脯-甘)二肽(43)。化合物24~43的结构见图2。
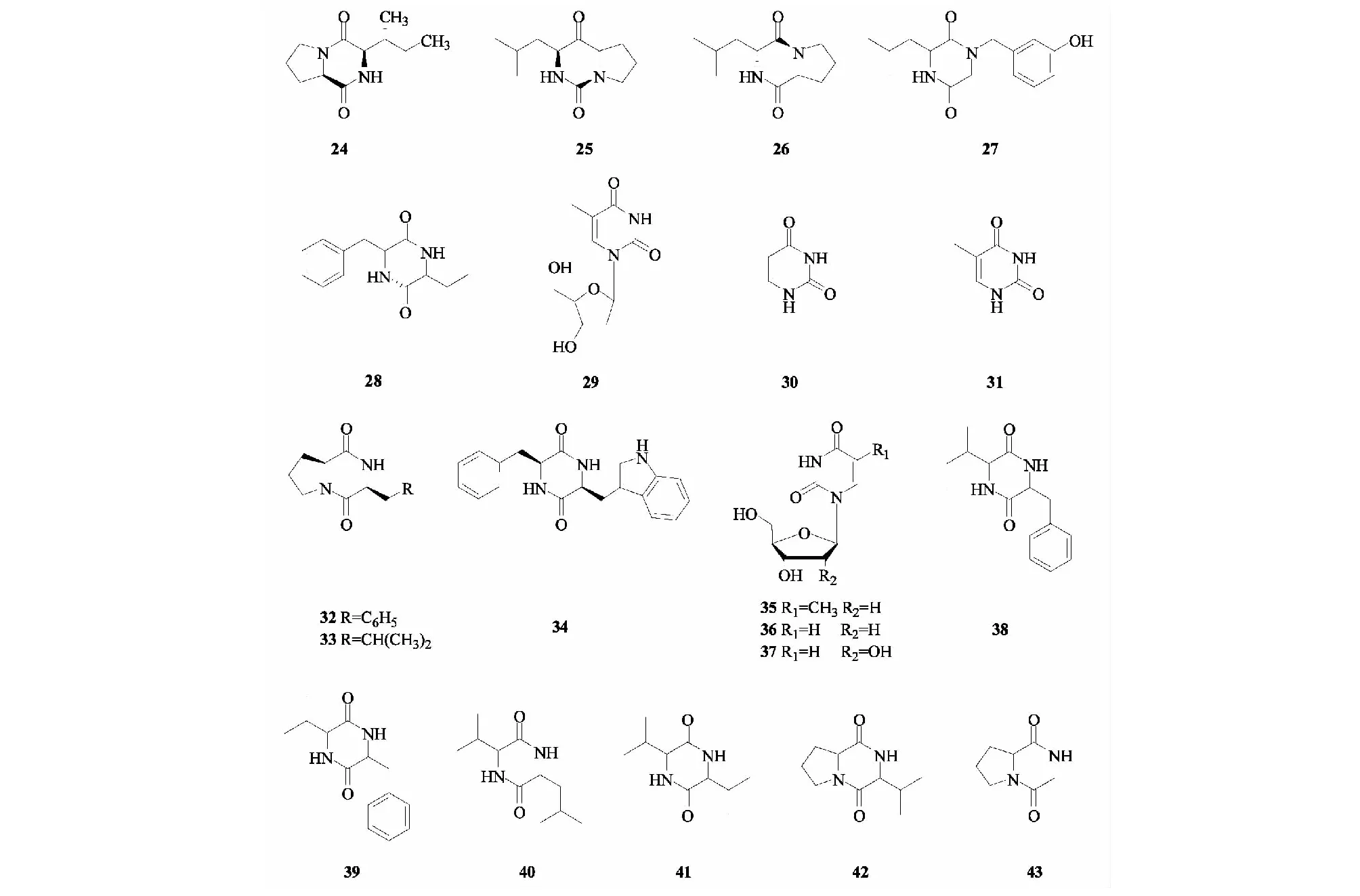
图2 黄槿内生菌中环二肽与核苷类化合物的结构Fig.2 Structures of cyclic dipeptides and nucleoside compounds in H.tiliaceus endophytes
2.3 蒽醌类化合物
Yan等[43]从黄槿赤散囊菌(EurotiumrubrumG2)的提取物中鉴定出11个蒽醌类化合物(44~54)。其结构分别为:questin(44)、emodin(45)、citreorosein(46)、emodic acid(47)、erythroglaucin(48)、catenarin(49)、physcion(50)、asperflavin(51)、2-O-methyl-9-dehydroxyeurotinone(53)、2-O-methyleurotinone(53)、9-dehydroxyeurotinone(54)。其中化合物54为新化合物。化合物44~54的结构见图3。
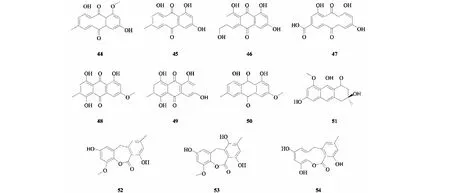
图3 黄槿内生菌中蒽醌类化合物的结构Fig.3 Structures of anthraquinones in H.tiliaceus endophytes
2.4 多取代苯类化合物
Yan等[43]从黄槿赤散囊菌(EurotiumrubrumG2)提取物中鉴定出1个多取代苯类化合物(55),确定其结构为isodihydroauroglaucin。并且从黄槿团青霉的提取物中鉴定出2个多取代苯类化合物,分别为2′,4′-dihydroxy-3′,5′-dimethylacetophenone(56)和2,5-dihydroxybenzeneacetic acid(57)。Li等[58]从来源于海南半红树植物黄槿的内生真菌赤散囊菌(Eurotiumrubrum)的菌丝体及发酵液的提取物中分离并鉴定了6个苯甲醛类衍生物的结构。分别为(E)-6-hydroxy-7-(3-methyl-2-butenyl)-2-(3-oxobut-1-enyl)chroman-5-carbaldehyde(58)、2-(1′,5′-heptadienyl)-3,6-dihydroxy-5-(3-methyl-2-butenyl)benzaldehyde(59)、isotetrahydroauroglaucin(60)、isodihydroauroglaucin(61)、2-(2′,3-epoxy-1′,3′-heptadienyl)-6-hydroxy-5-(3-methyl-2-butenyl)benzaldehyde(62)、2-(2′,3-epoxy-1′,3′,5′-heptatrienyl)-6-hydroxy-5-(3-methyl-2-butenyl)benzaldehyde(63)。其中化合物58和59为新化合物。化合物55~63的结构见图4。

图4 黄槿内生菌中多取代类化合物的结构Fig.4 Structures of polysubstituted benzene compounds in H.tiliaceus endophytes
2.5 三萜类化合物
Li等[40]利用多种色谱技术从黄槿内生真菌GT 20036029中分离得到2个三萜类化合物,分别为(25S)纽替皂苷元-3-O-α-L鼠李糖-(1→2)β-D葡萄糖苷(64)和(25S)异纽替皂苷元-3-O-α-L鼠李糖-(1→2)β-D葡萄糖苷(65)。Yan等[43]从黄槿赤散囊菌(EurotiumrubrumG2)的提取物中鉴定出1个三萜类化合物,确定其化学结构为zeorin(66)。并且从黄槿团青霉的提取物中鉴定出4个三萜类化合物(67~70),分别为麦角甾醇((22E,24R)-ergosta-5,7,22-trien-3β-ol)(67)、fumigaclavines A和B(68)、penitrem A and roquefortine(69)和啤酒甾醇((22E,24R)-ergosta-7,22-dien-3β,5α,6β-triol)(70)。Du等[47]从黄槿内生真菌AspergillussydowiiEN-198的发酵液中分离出2个三萜类化合物,分别为过氧化麦角甾醇(71)和麦角甾醇(72)。化合物64~72的结构见图5。
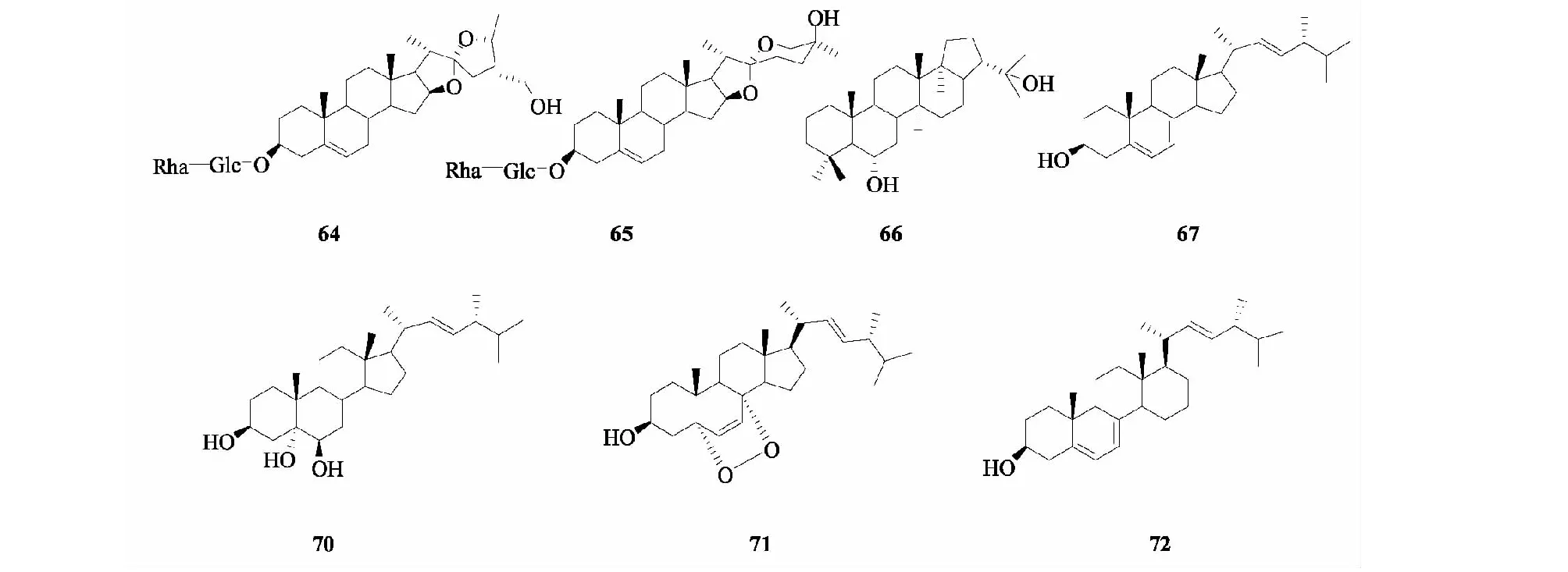
图5 黄槿内生菌中三萜类化合物的结构Fig.5 Structures of triterpenoids in H.tiliaceus endophytes
2.6 其他类化合物
Du等[47]从黄槿内生真菌AspergillussydowiiEN-198中分离出1个萜类化合物为(1S)-1-(4′-间羟基苯甲酸)-1,1,5,5-二甲基己二醇(73),以及2个酰胺类化合物分别为(2S,2′R,3R,3′E,4E,8E)-N-(2′-羟基-3′-十六烯酰基)-9-甲基-4,8-二十碳二烯-1,3-二醇(74)和1-O-β-D-葡萄糖基-(2S,2′R,3R,3′E,4E,8E)-N-(2′-羟基-3′-十六烯酰基)-9-甲基-4,8-二十碳二烯-1,3-二醇(75)。Li等[46]采用溶剂萃取?柱色谱层析及制备HPLC等方法对1株分离自广西红树林植物黄槿的内生真菌Penicilliumsp.LD-68菌株发酵产物进行化学结构鉴定。分离得到5个苯并多元环类化合物,其结构分别鉴定为curvularin(76)、dehydrocurvularin(77)、11-β-hy-droxy-12-oxocurvularin(78)、11-β-hydroxycurvularin(79)和11-α-hydroxycurvularin(80)。Li等[40]利用多种色谱技术从半红树植物黄槿内生真菌GT 20036029中分离得到1个皂苷类化合物,为脑苷脂B(81)。Yan等[43]从黄槿团青霉的提取物中鉴定出3个其他类型化合物(82~84),分别为1-O-(2,4-dihydroxy-6-methylbenzoyl)-glycerol(82)、1-O-acetyl-glycerol(83)和(4R,5S)-5-hydroxyhexan-4-olide(84),其中化合物82为新化合物。化合物73~84的结构见图6。

图6 黄槿内生菌中其他类化合物的结构Fig.6 Structures of other compounds in H.tiliaceus endophytes
3 药理作用
3.1 抗菌作用
黄槿具有抗炎的药理作用[10],且黄槿内生菌会产生与黄槿相同或相似的结构,因此对于黄槿内生菌代谢产物抗菌活性的研究具有意义。Du等[47]从海南东寨港的海洋红树林植物黄槿叶中分离到的一株内生真菌AspergillussydowiiEN-198,利用多种分离手段从发酵液中分离得到14个化合物,以金黄色葡萄球菌为供试菌株,利用滤纸片扩散法测试了所有化合物的抑菌活性。其中发现曲酸表现出较好的抑制活性,在加样量为100 μg/碟时,抑菌圈直径为10 mm,阳性对照抑菌圈直径为22 mm。根据Li[59]的研究表明,曲酸对大肠杆菌也具有良好的抑菌效果,且热稳定性强。同时,化合物23也表现出一定的抑制活性,该化合物的抑菌活性为首次报道。Yan等[43]对黄槿内生真菌赤散囊菌(EurotiumrubrumG2)次级代谢产物的生物活性研究中,发现在抗菌活性测试中化合物54对大肠杆菌表现出一定的抗菌活性。根据Bi等[60]研究,化合物45对耐甲氧西林金黄色葡萄球菌具有显著的抑制作用。在Wakuliński[61]的实验中,化合物49也同样表现出抗菌活性。Lin等[36]采用琼脂块法对分离出的黄槿内生真菌进行抑菌实验,实验结果表明分离出的17株黄槿内生菌具有抗菌活性,其中有4株对至少一种微生物具有抗菌活性。
3.2 抗肿瘤作用
据现有研究结果,在红树林植物内生真菌的次级代谢产物中,经常能发现具有抑制肿瘤的药理作用,并且有些化合物的抗肿瘤活性较强,有望能开发为新的抗肿瘤药物[62,63]。黄槿作为半红树林植物,近年来有许多研究人员从其代谢产物中发现具有良好的抗肿瘤活性,以期可以为新型药物研发提供前体化合物。Li等[46]从广西黄槿中分离得到一株内生真菌Penicilliumsp.LD-68,以其作为供试菌种对其次级代谢产物以及其生物活性进行研究。通过采用溶剂萃取、柱色谱层析及制备液相色谱等方法对菌株发酵产物进行分离,得到5个弯孢霉菌素类化合物。利用SRB和MTT法评价化合物的抗肿瘤活性,以A549、Hela、BEL-7402、K562这4种人肿瘤细胞株作为指示细胞。经实验表明,化合物76~80对4种指示细胞具有不同程度的抑制作用。其中化合物77~80对Hela细胞生长具有显著抑制作用,表现出较好的抗肿瘤活性。并且化合物77~80对4种肿瘤细胞系的细胞毒活性为首次发现。Liu等[41]从草酸青霉(Penicilliumoxalicum)菌丝体的丙酮提取物中分离得到6个环二肽类化合物,并且用MTT法评价各化合物对肝癌细胞HepG-2和前列腺癌细胞LNCaP生长的抑制作用。其中化合物39、40和42在50 μg/mL下对肝癌细胞HepG-2的抑制率分别为31%、32%、17%,对前列腺癌细胞LNCaP抑制率分别为50%、43%、53%,具有一定的细胞毒活性。Li等[40]从海南半红树林植物黄槿中分离得到内生菌真菌GT 20036029,并且应用多种色谱技术从中分离得到9个化合物。其中化合物64显示出较好的肿瘤细胞抑制活性。在对其进行肿瘤细胞生长抑制活性筛选中发现,螺环部分的结构可能为其活性官能团。Yan等[43]在对黄槿内生真菌赤散囊菌(EurotiumrubrumG2)代谢产物的研究中,鉴定了32个化合物的结构式,苯甲醛类化合物、蒽醌类化合物、含吲哚的二酮哌嗪生物碱类化合物这三类化合物是赤散囊菌代谢产物的主要结构类型。其中化合物14对人肝癌细胞SMMC-7721、化合物55对人胰腺胆管癌细胞sw1990和人前列腺癌细胞Du145表现出较强的抑制活性(IC50分别为11、10、15 μg/mL)。在Wang等[64]的研究中,化合物14~16表现出较弱的细胞毒活性及抗氧化活性。根据Zhang等[65]的研究,化合物56在体外实验中可对多种植物病原真菌表现出抑制活性。Li[48]使用“杯碟法”对分离出的放线菌进行嗜杀酵母系统模型初蹄,结果分离出的184株黄槿共附生的放线菌中有155株显示了对酵母嗜杀系统的抑制作用。在随后的细胞毒活性的检测中,结果显示其中87株黄槿的共附生放线菌有强的细胞毒活性。对酵母嗜杀系统的抗性较强的菌主要分布在黄槿的根际土壤及其根部,其中分离自黄槿根部的2株放线菌活性强于利巴韦林阳性对照(82%)。结果表明黄槿土壤中分离出的活性放线菌数量最多,根部次之,茎部最少。
4 小结
半红树植物黄槿,是在潮间带生存的两栖木本植物,有重要的生态功能。由于其生长环境具有高盐、强光照、缺氧等特点,使得黄槿生境适应性独特,既可在海滩上成为优势树种,又能在陆地环境自然繁殖。这一特点造就了黄槿内生菌特殊的代谢途径,使其成为新型天然产物的来源之一。当前,由于抗菌药物滥用,使得致病菌耐药性增强等问题频频出现[66,67],抗肿瘤药物由于癌症治疗理念的升级,也同样亟待新型天然药物的开发利用[68]。现代药物的30%~60%与天然产物相关,通过对天然产物的改造和利用是新药开发的重要手段之一[69,70]。但是从普通的微生物资源中难以得到结构新颖的新骨架化合物,因此药用植物内生菌以及海洋产物逐步引发关注。根据Schafhauser等[71]研究,中药紫菀中具有抗肿瘤活性的环肽astins,是由其内生真菌Cyanodermellaasteris通过非核糖体途径合成的主要骨架。此发现有助于该化合物更好地生产研发,同时也证明了药用植物内生菌及其次级代谢产物的研究价值。另有研究,从海洋曲霉天然产物Aspergillussp.CNC-139中衍生出血管阻断剂plinobulin(NPI-2358),用以治疗转移性的晚期非小细胞肺癌[72]。由此根据黄槿内生菌及其代谢产物具有抗菌、抗肿瘤等活性的现有报道,有望将其中结构新颖,特异性强,具有显著药用的活性分子,与基因组学、分子生物学等技术结合创制新药。
