青藏高原土壤放线菌的分离与初步鉴定
2022-09-21任建委任明辉
任建委,任明辉
(西藏大学医学院,西藏拉萨 850000)
放线菌是一类能够产生抗生素、抗肿瘤活性物质、免疫调节剂和酶抑制剂等多种活性物质,具有较高经济价值的一类原核细胞微生物[1-2]。目前,国内外研究人员对放线菌的开发与研究主要集中在放线菌的极端生境[3-5]。我国青藏高原地区被称为“世界屋脊”“世界第三极”,具有海拔高、空气稀薄、太阳辐射强等特点,放线菌资源比较丰富[6],而且还存在一些未知的放线菌,非常值得展开青藏高原放线菌的研究。本研究对采自青藏高原拉萨地区罗布林卡公园的3 份土壤样品进行分离,探讨了土壤预处理不同温度对土壤放线菌分离的影响。
1 放线菌分离影响因素分析
放线菌分离过程中需要注意的问题是,在放线菌分离过程中既要保证抑制杂菌(细菌、真菌等)的生长,同时又不影响放线菌的生长。为了提高放线菌的分离率,许多学者对多种相关因素进行研究,包括土壤预处理、培养基成分、杂菌抑制剂等。
1.1 土壤预处理
土壤预处理是影响放线菌分离效率至关重要的一个步骤,适当的土壤预处理可以激活放线菌孢子的萌发及提高放线菌的检出率。常用的土壤预处理方法包括风干与加热处理、超声波处理和制作土壤稀释液时的试剂处理等。何建清等[7]以土样风干,120℃干热1h,制作土壤稀释液后又加入0.05%SDS,40℃悬浮0.5h后涂布分离为土壤预处理方式得到放线菌。盛海彦等[8]用控制变量法对土壤预处理的条件(温度、SDS、酵母膏)进行了探讨,发现在120℃处理1h、土壤悬浮液中加入SDS 0.5g/kg、6%酵母膏并于40℃常温振荡0.5h的条件下分离的放线菌数量最多,并有效抑制了细菌的生长。田华等[9]将样品自然风干0、2、4、6、8d,发现将土壤样品风干放置6d 前的时间里,分离的放线菌数目随风干天数增加,在一定程度上说明通过适当风干时间,有利于土壤中放线菌的活化;将土壤稀释液分别进行40℃、50℃、60℃、70℃加热处理20min,发现以50℃为分界点,放线菌的数目也会随着温度升高而增加或减少,在某种程度上说明,适当的温度处理有利于放线菌的活化。毛宁等[10]对采集的土壤样品分别进行0s、20s、50s、100s 的超声波处理,发现放线菌的种类和数量均不同,说明通过适当时间的超声波处理,有利于增加需分离的土壤放线菌的数量和种类。闫建芳等[11]分别用不同浓度的SDS 溶液(0.01%、0.05%、0.10%、0.20%)稀释风干土壤样品涂布于高氏培养基后观察放线菌数量,发现0.05%SDS 溶液稀释的土壤样品能有效分离土壤中黄瓜枯萎病菌的拮抗放线菌。茹祥等[12]采用了3 种预处理方法,其中放线菌出菌率最高的方法是向土壤稀释液中加入1‰螯合树脂—胆酸钠溶液并用50W 超声波水浴60s,得到稀释液;另取土样以磷酸盐缓冲液为稀释液,振荡15min 后,将两者混合,进行涂布后培养得到放线菌的菌落数是最多的。来航线等[13]分离盐碱土中的放线菌时,用20g/kg 腐殖酸溶液浸泡土壤,于40℃下振荡20 min,结果可提高放线菌的出菌率并抑制了杂菌生长。
1.2 培养基成分
培养基的营养成分对微生物生长至关重要。一种培养基中所含营养物质不可能满足所有放线菌的生长要求,所以试验者可根据目的改变培养基的成分,从而分离出相关目的放线菌菌株。闫建芳等[11]利用7 种培养基对瓜类枯萎病菌拮抗放线菌进行分离,发现高氏一号培养基、淀粉琼脂培养基和HVG 培养基对拮抗放线菌的分离效果较好,联合培养能够尽可能多地分离放线菌。茹祥等[12]利用高氏一号培养基、BN 培养基、葡萄糖-天冬门素培养基和腐殖酸培养基,结果表明,BN 培养基在分离放线菌的种类和数量上比其他3种培养基的分离效果好。周娟等[14]采用9 种培养基对分离的土样进行放线菌分离,LNMS 培养基培养的放线菌数量最多,燕麦琼脂培养基分离种类最多,但由于培养基成分种类和比例不同,分离出放线菌数量和种类是不同的。李菲等[15]从红树林土壤中共分离到444株放线菌,其中3 株放线菌为潜在新种。在酶活性方面,至少有1 种酶活性的放线菌共56 株,2 种酶活性的放线菌共31 株,蕴藏着新的且功能酶活性显著,具有较大的挖掘潜力。
1.3 杂菌抑制剂
杂菌抑制剂在分离放线菌过程中,主要作用是排除杂菌如细菌、真菌及其他非目的放线菌等微生物,不影响目的放线菌的分离。在分离放线菌时,向培养基中加入一定量的抑制剂,会抑制细菌和真菌的数量,减少放线菌分离时两者的干扰,进而有效提高放线菌检出率。因此,有效抑制细菌和真菌的生长是放线菌分离杂菌抑制方面需要解决的重要问题。闫建芳等[11]以重铬酸钾(K2CrO2)、放线菌酮、链霉素、青霉素和氟哌酸等作为杂菌抑制剂,发现1μg/mL 青霉素、40μg/mL氟哌酸、75μg/mL K2CrO2适合作为土壤放线菌分离的杂菌抑制剂,其中以1μg/mL 青霉素效果最明显。司美茹等[16]在培养基中加入化学抑制剂(75μg/mL K2CrO2+2μg/mL 青霉素),培养基中细菌数量明显减少,但不影响放线菌种类和数量;若化学抑制剂和土样加热双重处理,细菌数量比单纯使用分离方法明显减少,放线菌的数量和种类比单纯使用化学抑制剂明显增加。安德荣等[17]向高氏一号培养基中加入4 种(放线菌酮、制霉素、多菌灵、K2CrO2)化学抑制剂,发现放线菌酮和K2CrO2是理想的放线菌分离抑制剂,既可以作为土壤中细菌和真菌的抑制剂,又不会影响放线菌的正常生长。
2 放线菌分离的材料与方法
2.1 试验材料
采用五点取样法取土壤样品3 份,样品来源于罗布林卡公园5~20cm 深土层。将3 份土壤分别过2 层医用纱布。
2.2 土壤预处理
将土壤样品分为2 份,一份做常温风干处理;一份做65℃烘干处理。
2.3 培养基使用
本试验分离放线菌采用2 种培养基,即高氏一号琼脂培养基和马铃薯葡萄糖琼脂培养基(PDA)。高氏一号琼脂培养基成品、PDA 成品,按照说明书配制培养基,121℃灭菌20min。
2.4 土壤稀释液制备及纯种分离
称取1g 土壤加入到10mL 灭菌的无菌水中,震荡10min,获得土壤悬液为10%浓度的土壤稀释液。向装有9mL 无菌水的试管里加入上述稀释液1mL,需用移液管吸取,摇匀,制成1%浓度的土壤稀释液。按照1∶10 的比例,依次稀释至0.1%浓度梯度的土壤稀释液。整个稀释过程都在超净工作台中进行。在土壤稀释过程中,发现即便土壤经过过筛后,试管下仍沉积很多类似于沙子的不溶物。因曾做过预试验,发现至0.1%土壤稀释浓度已经很少有放线菌存在。所以本试验只稀释到0.1%土壤稀释度。
完成等浓度梯度稀释土壤稀释液的制备之后,配制高氏一号培养基,121℃15 min,待其冷却至55~60℃时,倒平板。待凝固以后,用移液枪分别吸取等量的浓度为10%、1%、0.1%的土壤稀释液于无菌平板上,最后用烧灼后的无菌玻璃涂布器分别均匀涂布,并且在平板上做标记。静置20min 左右后将平板倒置于28℃的恒温培养箱中培养3~5d。每个稀释梯度重复2 次。
2.5 放线菌分离结果
以65℃温度处理、3 号土壤为例,采用土壤浓度稀释法,用高氏一号培养基培养放线菌,分离结果如图1所示。从图中可以看出,在培养皿中长有细菌菌落,在其他的培养皿中还长有真菌,对放线菌菌落大概数目做初步统计见表1。
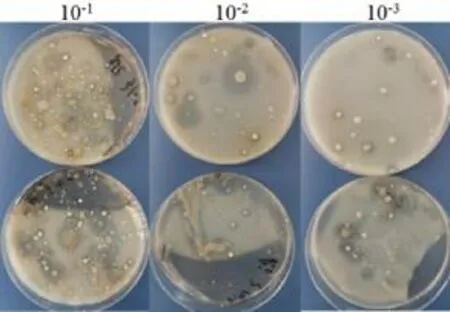
图1 经65℃预处理的3 号土壤

表1 放线菌菌落的数目约数 单位:个/mL
2.6 放线菌培养特性及染色
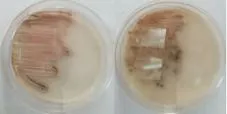
图3 部分放线菌培养插片法

图4 部分放线菌插片法后的染色情况
放线菌制片染色方法包括印片法和插片法,前者主要观察放线菌孢子丝的形态、孢子的排列及其形状等,但形态特征可能有所改变(使用的是石炭酸复红染液);后者可观察到放线菌自然生长状态下的特征和不同生长期的形态,也是放线菌染色常用的方法。本次放线菌初步培养鉴定使用的是插片法,具体步骤如下:①接种。采用无菌接种法接种挑取放线菌,在高氏一号培养基约一半面积上密集划线接种。②插片。无菌操作法用镊子取无菌盖玻片,在划线接种区内45°角插入平板琼脂培养基内,另一半未划线的区域也以同样的方式插入数块盖玻片。③培养。平板倒置28℃培养箱培养3~5d。④镜检。取盖玻片,用纸擦去背面培养物,菌面向上放载玻片上,滴0.1%碱性美兰染液。
3 讨论
采样时,用五点取样法在同一地方采集3 份土壤,不同份数土壤中,统计放线菌菌落数的大概数目并不相同,并且有些形成的菌落颜色也不相同,这可能是在取土壤样品时,附近生长的植物不同。
溶解土壤时,发现土壤的沙化,即便用2 层医用纱布筛过后,仍有大部分土壤无法溶解并沉在试管底部,这样每克土壤样品中含有放线菌的数量减少,所以用稀释涂布平板法培养放线菌时,土壤稀释浓度(10%、1%、0.1%)与普通土壤稀释度(0.1%、0.01%、0.001%)不同。
使用高氏一号培养基培养放线菌时,培养基中会有细菌菌落和霉菌菌落,需要添加真菌抑制剂和细菌抑制剂来抑制除放线菌以外的其他杂菌的生长。
