狭果茶藨子果实多糖提取及其抗氧化和流变特性
2021-03-08乔杨波蔡庭秀赵永珍哈生云
乔杨波,蔡庭秀,刘 哲,赵永珍,哈生云,叶 英,3*
1青海大学农牧学院,西宁 810016;2青海圣航农牧科技开发有限公司,尖扎 811200;3青海省青藏高原农产品加工重点试验室,西宁 810016
狭果茶藨子(RibesstenocarpumMaxim,RSM)属虎耳草科茶藨子属植物,生于海拔2 800 m以下的山坡灌丛、杂木林下或山沟中,是原产于起北欧的一种木本灌木。在中国主要分布于四川、甘肃、陕西、青海等地。全世界约有160种,中国有59种30变种,仅青海就有11种1个变种[1-3]。《晶珠本草》中记载茶藨子属植物具有滋补止泻、敛毒、除黄水之效,并能收敛各种脉管病,与树莓、蓝莓、山葡萄、沙棘等尚未被完全开发的野生山果一起并称为第三代水果[4]。茶藨子属植物中富含维生素C,总酚、黄酮、多糖、多糖等多种生物活性物质,具有多种生物活性,如调节肠道菌群平衡[5],提高机体抗氧化能力,抑菌[6]等。同时还可降低患心血管疾病[3]、癌症、神经退化性疾病、免疫系统疾病[5]、糖尿病、慢性风湿病、关节炎和炎症性等疾病的风险[7]。
研究表明,植物源多糖具有较强的亲水性[8]、较高的热稳定性[9]以及优良的流变学性质[10],致使其具有良好的加工性能,因而广泛的应用于食品加工当中。同时因植物源多糖具有多种重要的生物活性,如抗氧化、抗炎、抗病毒、抗癌、降血糖,提高机体免疫力[11-14]等,因而在保健品和医药工业中也具有潜在的应用前景。青海地区狭果茶藨子资源丰富,但是均为野生状态[4]。多糖作为狭果茶藨子果实中一类重要的生物活性物质,尚未见有关其研究的相关报道。本研究采用青海当地狭果茶藨子果实为原料,采用超声辅助提取法,设计单因素试验和响应面试验对狭果茶藨子果实多糖提取工艺条件进行优化,具有提取时间短、操作简单、原料利用率高、成本低廉等优点[15]。同时就提取后的狭果茶藨子果实多糖的体外抗氧化活性及流变特性予以探讨,旨在从狭果茶藨子果实中开发新型的天然抗氧化剂和增稠剂,进一步扩大狭果茶藨子在食品领域当中的应用,发挥其潜在的生物价值。
1 材料与方法
1.1 材料与试剂
狭果茶藨子(采摘自青海互助珠固乡);抗坏血酸、DPPH试剂(南京奥多福尼生物科技有限公司);ABTS试剂(北京酷尔化学科技有限公司);D101大孔吸附树脂(东鸿化工有限公司);无水乙醇、氯仿、正丁醇、氢氧化钠、浓盐酸、浓硫酸、苯酚等均为分析纯。
1.2 仪器与设备
HH-4S数显恒温水浴锅(江苏省金坛市友联仪器研究所);SB-3200DT超声波清洗机(宁波新芝生物科技股份有限公司);HJ-4A数显恒温多头磁力搅拌器(峥嵘仪器);KC-130小型粉碎机(北京开创同和科技发展有限公司);UV-2 600紫外可见分光光度计(岛津企业管理有限公司);电热鼓风干燥箱(上海一恒科学仪器有限公司);GS55-9冷冻干燥机(基因有限公司);来美ETT CP 5000 流变仪(广州来美科技有限公司)。
1.3 试验方法
1.3.1 狭果茶藨子果实多糖的提取
狭果茶藨子果实干燥粉碎后过60目筛,去除籽粒。准确称取一定量的果粉,按料液比1∶10加入95%的乙醇溶液静置过夜。收集沉淀后在55 ℃烘箱中干燥。准确称取干燥后的狭果茶藨子果实粉末,按料液比1∶30 g/mL,温度40 ℃,时间30 min,对狭果茶藨子果实多糖进行超声辅助提取。将提取后的多糖滤液浓缩至原体积的三分之一,按体积比3∶1加入Sevege试剂进行除蛋白处理,重复上述过程,直到无蛋白析出。使用D101大孔吸附树脂对脱蛋白后的多糖溶液进行脱色,将脱色后溶液浓缩至原体积的三分之一,加入4倍体积的无水乙醇使多糖沉淀。在4 ℃冰箱中静置过夜,对沉淀进行真空冷冻干燥即得狭果茶藨子果实粗多糖提取物(R.stenocarpumpolysaccharides,RPs)。
1.3.2 狭果茶藨子果实多糖提取量的计算
参考文献[16],采用苯酚-硫酸法绘制葡萄糖标准曲线。以吸光值y与葡萄糖标准品浓度x(μg/mL)进行线性回归,得回归方程:y=0.057 2x-0.112,R2=0.999,并根据标准曲线计算样品中多糖浓度,按公式计算多糖提取量。
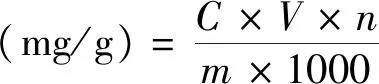
式中:C为标准曲线查得得样品多糖浓度(μg/mL);V为多糖液体积(mL);n为稀释倍数;m为狭果茶藨子果实粉末质量(g)。
1.3.3 狭果茶藨子果实多糖提取工艺优化
1.3.3.1 狭果茶藨子果实多糖提取单因素试验
准确称取1.0 g狭果茶藨子果实粉末,以超声辅助热水浸提法对狭果茶藨子果实多糖进行提取,超声功率为300 W。固定其他因素及相应水平,以狭果茶藨子果实多糖提取量为考察指标,研究提取温度、时间、料液比对狭果茶藨子果实多糖提取量的影响。设计各因素水平为:提取时间:20、30、40、50、60 min;料液比:1∶10、1∶20、1∶30、1∶40、1∶50 g/mL。提取温度:30、40、50、60、70 ℃。
1.3.3.2 狭果茶藨子果实多糖提取响应面试验
在单因素试验结果的基础上,以狭果茶藨子果实多糖提取量为响应值(Y),以提取温度(A)、提取时间(B)、提取料液比(C)为试验因素,利用Design-Expert 7.0.0软件设计三因素三水平Box-Behnken响应面试验,并对结果进行分析。因素水平表见表1。

表1 因素水平表Table 1 Fctors and levels
1.3.4 狭果茶藨子果实多糖的流变特性研究
1.3.4.1 多糖浓度对狭果茶藨子果实多糖表观粘度的影响
参考文献[10],将RPs配制成0.1%、0.5%、1.0%(W/V)的溶液,以0.1%(W/V)的羧甲基纤维素钠溶液作为对照。设置剪切温度为30 ℃,剪切速率扫描范围为150~1 000 s-1,研究不同多糖浓度对表观粘度的影响。
1.3.4.2 剪切温度对狭果茶藨子果实多糖表观粘度的影响
参考文献[17],将RPs配制成0.1%、0.5%、1.0%(W/V)的溶液,以0.1%(W/V)的羧甲基纤维素钠溶液作为对照。设置剪切温度范围为30~80 ℃,剪切速率为500 s-1,研究剪切温度对多糖表观粘度的影响。
1.3.4.3 pH对狭果茶藨子果实多糖表观粘度的影响
参考文献[18],以1.0%(W/V)RPs溶液为研究对象,用0.1 M HCl与0.1 M NaOH调节pH至3、7、11,设置剪切温度为40 ℃,剪切速率扫描范围为150~1 000 s-1,研究pH对狭果茶藨子果实多糖表观粘度的影响。
1.3.5 狭果茶藨子果实多糖的抗氧化活性研究
1.3.5.1 DPPH自由基清除率的测定
参考文献[19],精确称取DPPH,用无水乙醇将其配置为0.2 mM。精确称取RPs,用蒸馏水将其稀释到不同的质量浓度(1.00~0.03 mg/mL),与上述DPPH溶液按体积比1∶1混合,室温下避光静置30 min后,在517 nm处测定吸光度值,以抗坏血酸为阳性对照,并按公式计算DPPH自由基清除率。
式中Asample为DPPH溶液的吸光值;Acontrol为样品加DPPH溶液的吸光值。
1.3.5.2 羟自由基清除率测定
参考文献[19],精确称取RPs,用蒸馏水将其稀释到不同的质量浓度(1.00~0.03 mg/mL),精确吸取0.1 mL待测样液,依次加入2 mL FeSO4(6 mM)与2 mL H2O2(6 mM),混匀后在室温下静置10 min,加入2 mL水杨酸-乙醇溶液(6 mM),于50 ℃水浴30 min后,在510 nm处测定吸光值,以抗坏血酸为阳性对照,按公式计算羟自由基清除率。
式中:A1为样品吸光值;A2为不含H2O2时样品的吸光值;A0为空白对照的吸光值。
1.3.5.3 总还原能力测定
参考文献[19],精确称取RPs,用蒸馏水将其稀释到不同的质量浓度(1.00~0.03 mg/mL),精确吸取0.5 mL待测样液,依次加入2 mL 0.2 M pH 6.6 的PBS缓冲液与2.5 mL 1%(W/V)的K3Fe(CN)6,50 ℃水浴20 min,后加入2.5 mL 10%(W/V)三氯乙酸,3 000 rpm离心10 min后取上清液2.5 mL,依次加入2.5 mL蒸馏水与0.5 mL 0.1%(W/V)的FeCl3,室温静置10 min后于700 nm处测定吸光值。
1.4 数据处理
2 试验结果
2.1 狭果茶藨子果实多糖提取单因素试验结果
2.1.1 料液比对狭果茶藨子果实多糖提取量的影响
固定提取时间40 min,提取温度为40 ℃,研究料液比对狭果茶藨子果实多糖提取量的影响,试验结果见图1。由图1可知,当料液比为1∶30 g/mL时,狭果茶藨子果实多糖提取量达到最大值。此后随着料液比的不断增大,狭果茶藨子果实多糖提取量呈现下降趋势。推测这可能是由于料液比的不断增大,水分与狭果茶藨子果实粉末的浓度差越大,传质驱动力越强,多糖可以有效的从原料中溶解出来。然而随着料液比的进一步增大,此时由于多糖不断从果实中溶出,溶剂的粘度也随之加强,导致超声波的空化效应减弱,也会降低多糖提取量。因此选取料液比1∶30 g/mL作为狭果茶藨子果实多糖最佳提取条件。
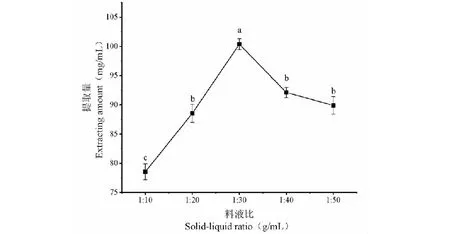
图1 料液比对狭果茶藨子果实多糖提取量的影响Fig.1 Effect of material-liquid ratio on the content of polysaccharides in R.stenocarpum
2.1.2 提取时间对对狭果茶藨子果实多糖提取量的影响
固定提取温度40 ℃,料液比1∶30 g/mL,研究提取时间对狭果茶藨子果实多糖提取量的影响,试验结果见图2。由图2可知,在提取时间为30 min时,狭果茶藨子果实多糖提取量达到最大值。此后随着温度的不断上升,多糖提取量逐渐下降,推测这可能是由于提取时间过长导致多糖降解以及多糖分子结构的变化,致使多糖提取量降低。因此选取30 min作为狭果茶藨子果实多糖最佳提取时间以进行后续试验。

图2 提取时间对狭果茶藨子果实多糖提取量的影响Fig.2 Effect of extraction time on the content of polysaccharides in R.stenocarpum
2.1.3 提取温度对狭果茶藨子果实多糖提取量的影响
固定提取时间30 min,料液比1∶30 g/mL,研究提取温度对狭果茶藨子果实多糖提取量的影响,试验结果见图3。由图3可知,当提取温度为40 ℃时,狭果茶藨子果实多糖提取量达到最大。此后随着温度的不断上升,多糖提取量逐渐下降。推测这可能是由于提取温度的不断增大,水的电离常数变大,水当中H+与OH-离子的浓度上升,导致水的极性下降,进而会致使多糖提取量下降[14],故选取40 ℃作为狭果茶藨子果实多糖的最佳提取温度。
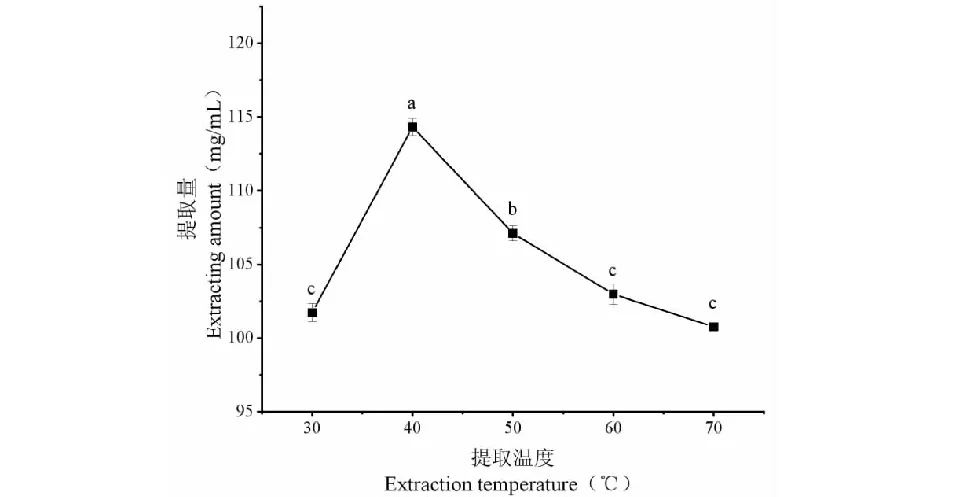
图3 提取温度对狭果茶藨子果实多糖提取量的影响Fig.3 Effect of extraction temperature on the content of polysaccharides in R.stenocarpum
2.2 超声法提取狭果茶藨子果实多糖提取响应面试验结果
2.2.1 响应面试验设计
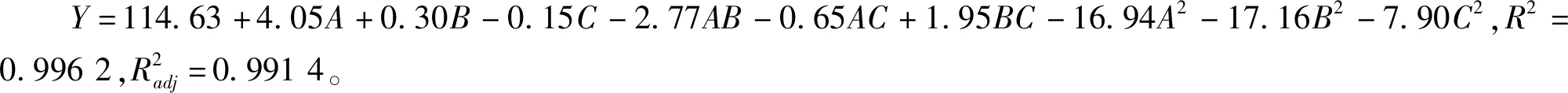

表2 响应面试验结果表Table 2 The table of response surface test result
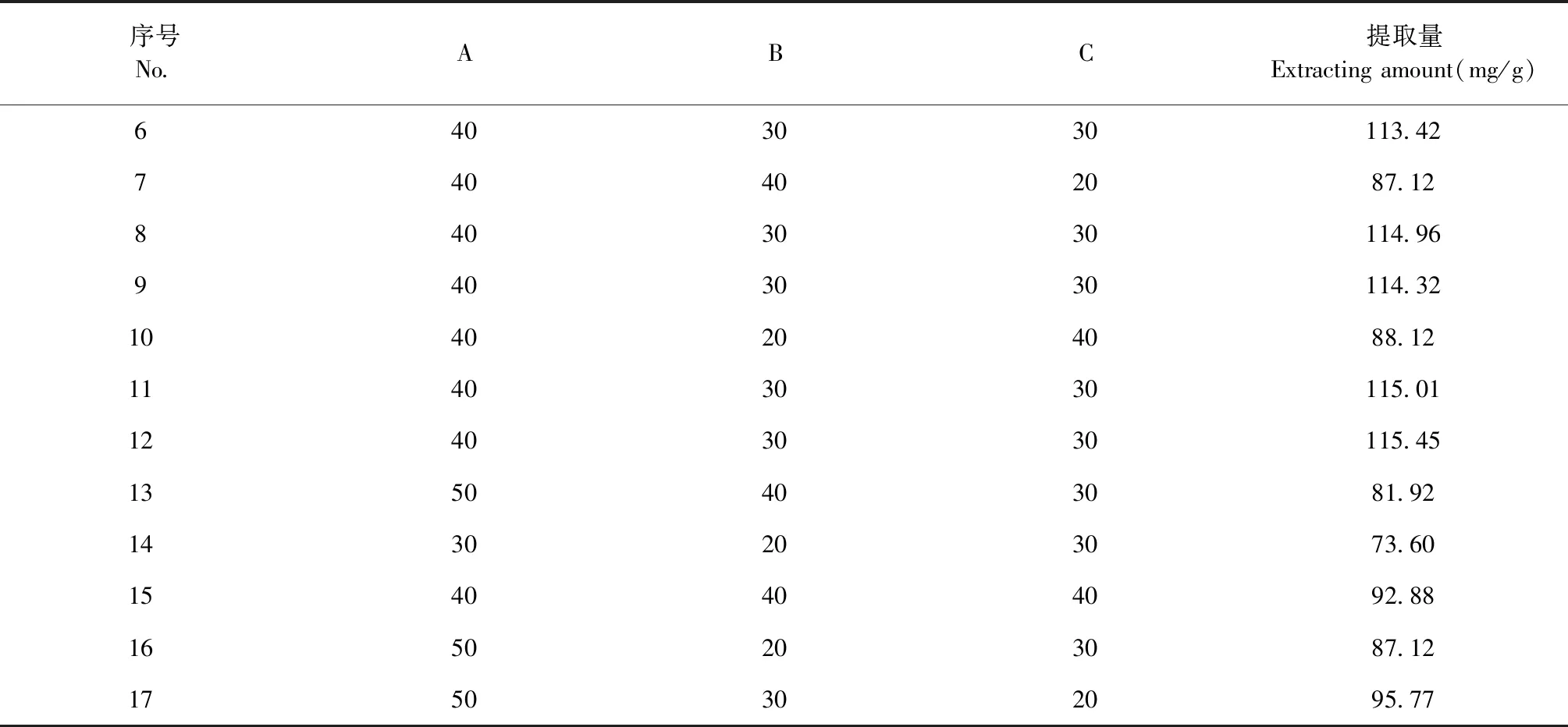
续表2(Continued Tab.2)
外部融资是采用企业之外的资金来进行并购活动,一般采用债券融资和股权融资两种形式进行。债券融资可以带来一定的节税效果。借款利息可以在上税之前进行扣除。但是负债会使得企业有还款压力,负债越多,企业压力越大,最后可能会使得企业资金周转困难。股权融资是指企业通过增发等方式出售自己的股份。股票回购没有固定的期限,企业暂时没有还款的压力。但是会影响到之前股东所持有的比例,损失股东的权益。分配利润之后企业还需要支付股息,股息不可以在缴纳企业所得税之前扣除。
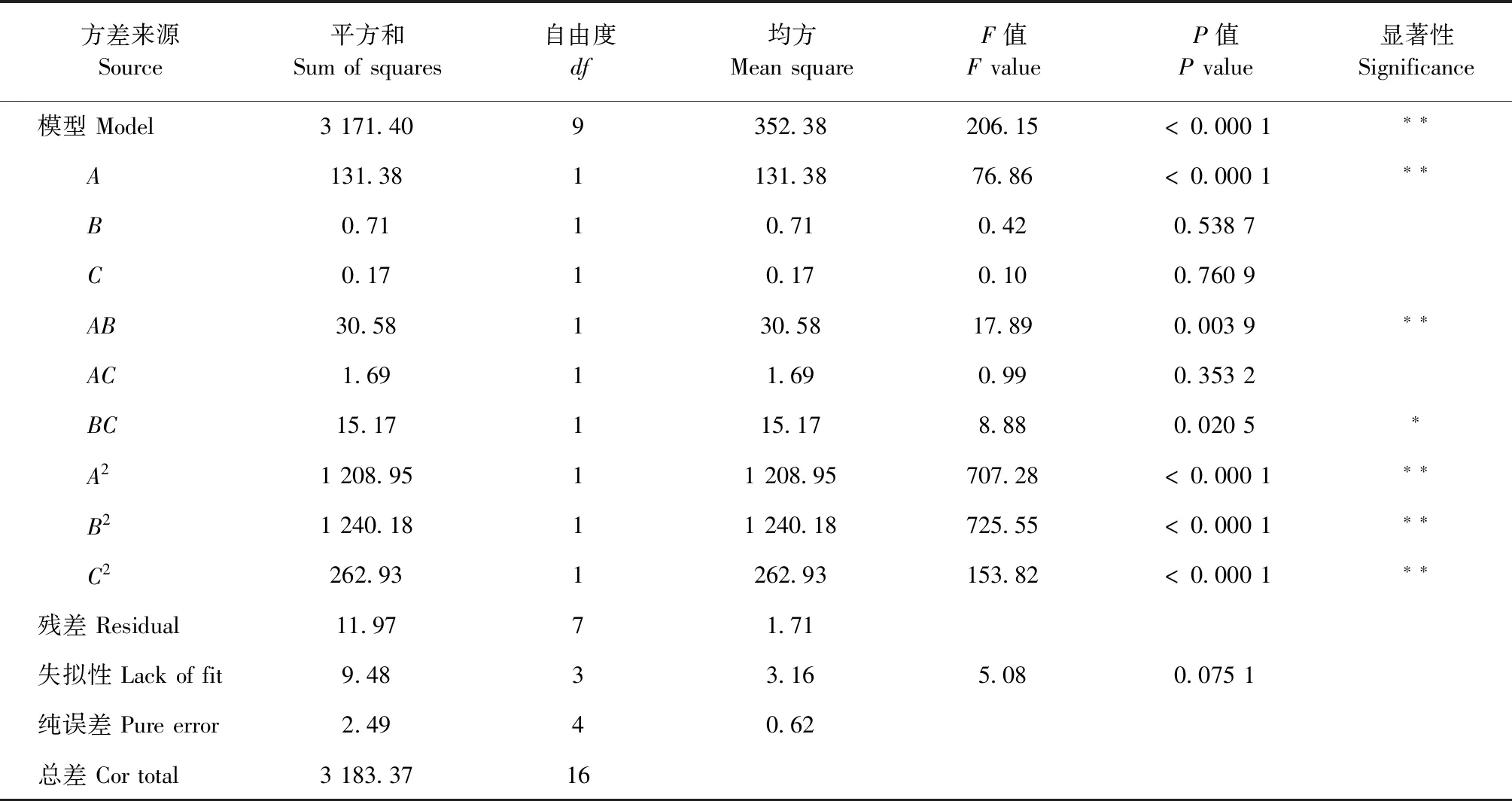
表3 方差分析结果Table 3 ANOVA results

表4 幂律模型拟合参数Table 4 Fitting parameters for the power law model
经Design-Expert 7.0.0软件进行响应面试验,得到图4。由图4a可知,响应曲面随着提取温度和时间的不断增大,狭果茶藨子果实多糖提取量先快速上升而后快速降低,由此可知,适当控制提取时间与料液比可提高狭果茶藨子果实多糖的提取量。此外,等高线图呈椭圆形,说明两者交互作用明显,说明两因素的交互作用对狭果茶藨子果实多糖提取量具有显著性影响,这与表3方差分析结果一致。由图4b可知,改变提取温度和料液比,多糖提取量缓缓升高后缓慢下降,响应曲面较为平缓,且颜色变化不明显,等高线图近似圆形,说明两者交互作用不显著,与表3结果一致。由图4c可知,随着提取时间和料液比的不断增加,多糖提取量升高后缓慢下降,响应曲面较为平缓,且等高线图呈椭圆形,故两者对于狭果茶藨子果实多糖提取量影响显著。
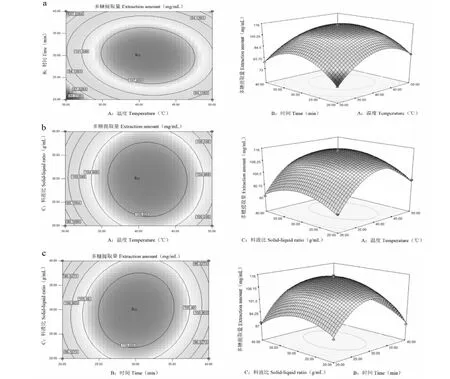
图4 各因素交互作用对狭果茶藨子果实多糖提取量的影响Fig.4 Effect of the interaction of various factors on the polysaccharides content of R.stenocarpum
2.2.2 最优条件确定
根据响应面优化得到狭果茶藨子果实多糖提取最佳工艺条件为:提取温度41.20 ℃、料液比1∶29.86、提取时间29.98 min,为方便试验操作修正为提取温度40 ℃、料液比1∶30 g/mL、提取时间30 min,对其进行验证试验得到狭果茶藨子果实多糖提取量为115.32±1.01 mg/g,与预测值114.88 mg/g无显著差异。
2.3 狭果茶藨子果实多糖流变特性研究
2.3.1 多糖浓度对表观粘度的影响
设置剪切温度为30 ℃,剪切速率扫描范围为150~1 000 s-1,多糖浓度对狭果茶藨子果实多糖表观粘度的影响见图5。由图5a可知,在试验浓度范围内,随着多糖浓度的不断上升,狭果茶藨子果实多糖的表观粘度不断加大。同时随着剪切速率的不断增大,多糖溶液的表观粘度不断下降,溶液呈现剪切
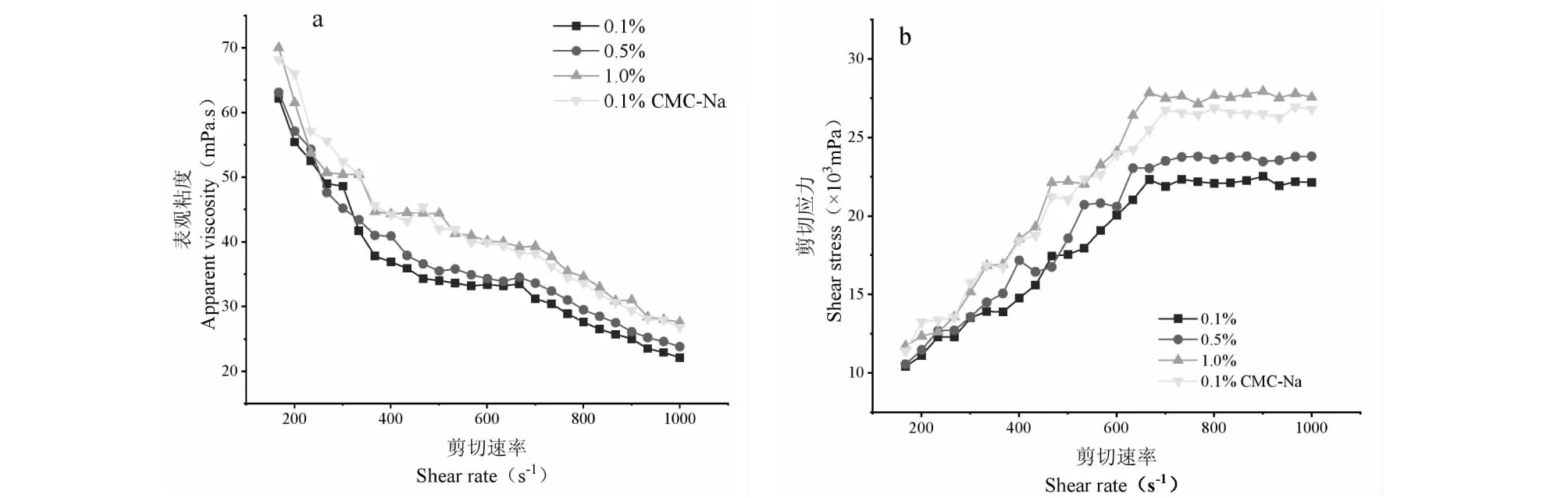
图5 狭果茶藨子果实多糖溶液的表观粘度η(a)和应力σ(b)对剪切速率的依赖性Fig.5 Shear rate dependence of apparent viscosity (a) and stress (b) of RPs
变稀的特性,表现出假塑性流体的特征。当多糖浓度为1.0%(W/V)时,其表观粘度与0.1%(W/V)羧甲基纤维素钠表观粘度接近,两曲线趋势也近乎一致,说明多糖溶液在水相中形成了相互交织的网络结构,改变了水溶液原有的性质,使溶液表现出非牛顿流体行为的特征[20]。此外随着剪切速率的增加,剪切应力变化曲线(5b)显示出与粘度曲线相反的趋势,在试验浓度范围内,狭果茶藨子果实多糖的浓度随着剪切速率的增加而增加,同样也表明了剪切稀化的特性。
将上述曲线拟合为幂律方程η=kγn-1,其中,η为剪切黏度,k为一致性指数,γ为剪切速率,n为流动行为指数。n为0~1的流体被归类为假塑性流体;如果n=1,则流体为牛顿流体。如表3所示,系统的n值范围在0.472~0.543之间,且n值随着多糖浓度的增大而不断升高,显示出更大的剪切稀化的能力,表明狭果茶藨子果实多糖为假塑性流体。
2.3.2 剪切温度对狭果茶藨子果实多糖表观粘度的影响
设置剪切速率为500 s-1,设置剪切温度范围为30~80 ℃,研究剪切温度对狭果茶藨子果实多糖表观粘度的影响,试验结果见图6。由图可知,随着剪切温度的不断增加,多糖溶液的表观粘度不断降低,表现出假塑性流体的特征。推测这可能是由于高温使得多糖分子结构发生热膨胀,分子间距离增大,弱化了多糖分子间的相互缠结,进而致使多糖的表观粘度呈现下降的趋势[20]。
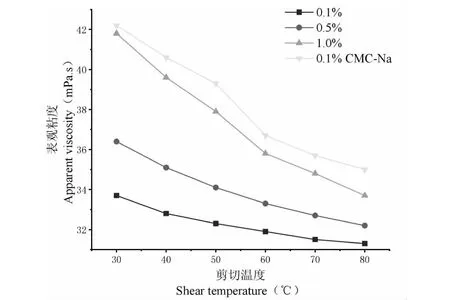
图6 剪切温度对狭果茶藨子果实多糖表观粘度的影响Fig.6 Effect of shear temperature on the apparent viscosity of RPs
2.3.3 pH对狭果茶藨子果实多糖表观粘度的影响
设置剪切温度40 ℃,研究不同剪切速率下pH对狭果茶藨子果实多糖表观粘度的影响,试验结果见图7。狭果茶藨子果实多糖原有pH为4.8,推测这可能是由于样品中单糖所含的官能团所致,使溶液呈现弱酸性。同时由图7可知,随着pH的不断降低,狭果茶藨子多糖表观粘度呈现逐渐上升的趋势,酸性环境提高了狭果茶藨子果实多糖的表观粘度,碱性环境弱化了样品原有的表观粘度。推测这可能是由于H+与溶液当中的负电荷结合,从而引起了絮凝反应,进而导致溶液的粘度上升。综合图5与图7,发现过酸过碱的环境均能解离狭果茶藨子果实多糖的结构,对溶液的表观粘度造成一定影响。但由表5可知,过酸过碱的环境均不会改变狭果茶藨子果实多糖的假塑性流体的特征,其溶液具有较好的稳定性,因而据此优良的特性,可将RPs应用于果蔬汁及乳制品饮料的加工过程当中,在提高产品品质稳定性的同时亦可提高产品的营养价值。

表5 幂律模型拟合参数Table 5 Fitting parameters for the power law model
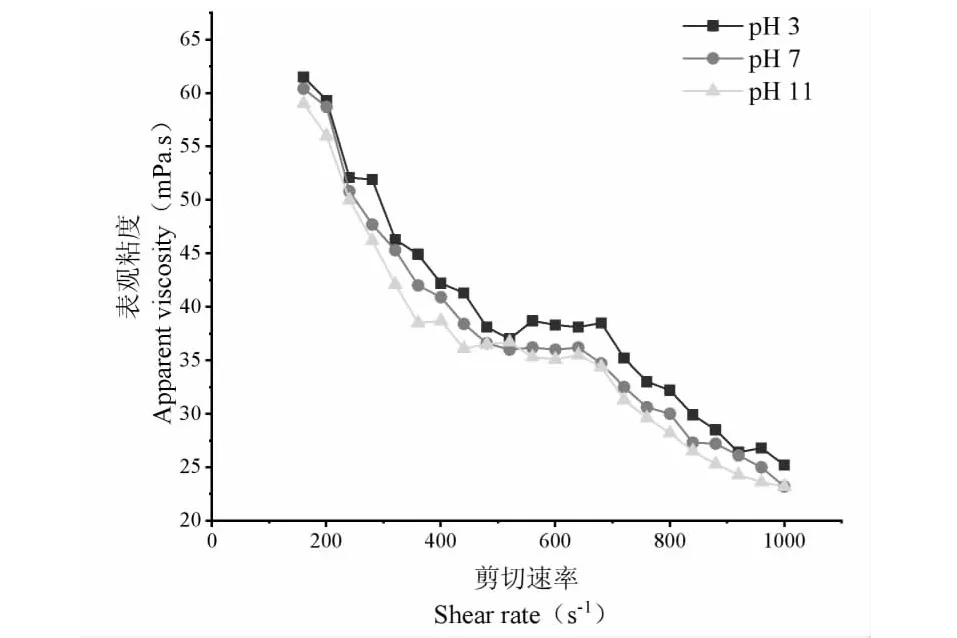
图7 pH对狭果茶藨子果实多糖表观粘度的影响Fig.7 Effect of pH on the apparent viscosity of RPs
2.4 狭果茶藨子果实多糖的体外抗氧化活性研究
2.4.1 DPPH自由基清除率
DPPH作为一种稳定且定性良好的固体自由基,广泛的应用于抗氧化能力的定量测定当中。多糖中含有许多羟基,它们大多能提供氢来还原DPPH自由基,进而达到清除自由基的作用。RPs与抗坏血酸对DPPH自由基的清除率如图8所示。RPs清除DPPH自由基的IC50值为0.245 mg/mL。此外,在试验浓度范围内,RPs对于DPPH自由基的清除率(y)与RPs的质量浓度(x)呈三次依赖关系,表达式为:y=-19.397X3+3.900 0X2-0.267X2+77.013(R2=0.951 0)。当多糖质量浓度为1.00 mg/mL时,样品对于DPPH自由基的清除率达到最大,为61.32%±0.91%。

图8 DPPH自由基清除率Fig.8 DPPH radical scavenging rate
2.4.2 羟自由基清除能力测定
羟自由基是一种反应性极强的化学分子,作为损伤作用最强的自由基,能够很容易的穿过生物的细胞膜,与多种生物分子发生反应,导致组织损伤或细胞死亡,因此清除羟自由基对于维持生命系统的正常工作起着十分重要的作用。RPs对羟自由基的清除率如图9所示,在试验多糖质量浓度范围内,随着多糖质量浓度的不断降低,RPs对于羟自由基的清除能力呈现逐渐下降的趋势,且RPs对于羟自由基的清除率大于阳性对照抗坏血酸。当多糖质量浓度为1.00 mg/mL时,RPs对于羟自由基的清除能力均达到最大值,为40.27%±0.42%。RPs对羟自由基具有较强的清除能力,推测这可能是由于RPs改善了自由基的供氢能力,从而终止了自由基的链式反应。但RPs对于羟自由基的清除作用机理尚不明确,还需进一步的研究来阐明其可能的抗氧化机制。
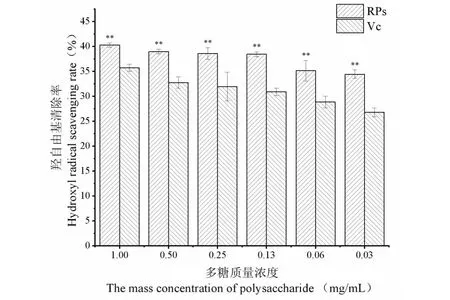
图9 羟自由基清除能力测定Fig.9 Determination of hydroxyl radical scavenging ability
2.4.3 总还原能力测定
抗氧化物质具有还原能力,还原能力通常用于评估多糖潜在的抗氧化活性。通过测量700 nm下普鲁士蓝的形成来测定还原力,700 nm处的吸光度值越高,还原力越强。RPs的还原能力测定结果如图10所示。由图可知,RPs还原能力具有一定的剂量依赖性,即随着多糖质量浓度的不断降低,样品的还原能力呈现下降趋势,同时其还原能力明显低于阳性对照抗坏血酸。RPs还原能力的测定结果在某种程度上也代表了其潜在的抗氧化活性。
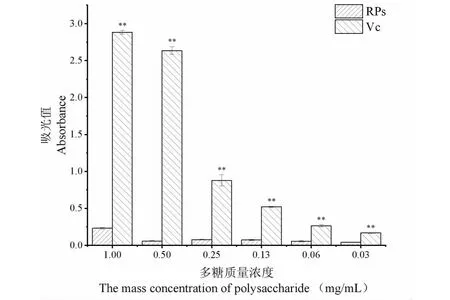
图10 还原能力测定试验结果Fig.10 Test result of reducing ability
3 结论
青藏高原野生茶藨子种类繁多,资源丰富,但缺少对其系统的研究与开发利用,此次试验对青藏高原地区狭果茶藨子果实多糖的提取工艺进行优化,并对其流变特性及体外抗氧化活性予以探讨。通过响应面法建立狭果茶藨子果实多糖提取工艺的回归方程,得到最佳提取条件为:提取温度40 ℃,料液比1∶30 g/mL,超声浸提30 min。在此条件下可极大地提高多糖的得率,其提取量最高可达115.32 mg/g;通过流变学研究发现狭果茶藨子果实多糖溶液属非牛顿流体,具有剪切稀化的特性,溶液的粘度随着多糖浓度的升高而不断增大,且过酸过碱的环境均不会对多糖溶液的流变特性造成巨大影响,溶液具有良好的稳定性。说明狭果茶藨子果实多糖具有良好的流变特性,有望从中开发新型的食品天然增稠剂或稳定剂,拓宽狭果茶藨子果实多糖的应用范围;此外,体外抗氧化试验表明,狭果茶藨子果实多糖具有潜在的抗氧化活性,对DPPH自由基与羟自由基均具有一定的清除作用。此次试验可为青藏高原地区狭果茶藨子果实功能性食品的开发提供一定的理论依据,从而促进茶藨子属植物资源的开发利用。
