毒根斑鸠菊中的一个新倍半萜的分离与鉴定
2021-03-08王盈盈王开明周凤玲周晓娅钟惠民
王盈盈,王开明,周凤玲,周晓娅,钟惠民
1济宁医学院基础医学院;2山东理工职业学院化工新材料工程学院,济宁272067;3青岛科技大学化学与分子工程学院,青岛 266042
毒根斑鸠菊VernoniacumingianaBenth为菊科Compositae管状花亚科斑鸠菊族斑鸠菊属植物,又名惊凤红、过山龙、细脉斑鸠菊等,在我国主要产于广西西部和西南部、福建、四川、云南、台湾等地区,常攀在乔木上。该属植物有1 000多种,其中有许多种可供药用,在我国就有12种作为药用植物。目前对斑鸠菊属植物的化学成分和生物活性研究较多,研究表明其化学成分复杂多样。目前对该属植物药理活性的研究已不只停留在粗提物的研究上,近年主要对该属植物的某些单体成分进行研究,尤其是倍半萜内酯类化合物和甾体皂苷类化合物也是近年来研究的热点。倍半萜是植物挥发油中高沸点部分的主要组成部分,倍半萜的含氧衍生物多有较强的香气和生物活性,是医药、食品、化妆品工业的主要原料,而倍半萜内酯类大多具有细胞毒性和抗癌活性。由于倍半萜类化合物具有较强的药理活性和结构骨架的多样性,长期吸引着众多学者的研究兴趣,研究显示倍半萜类化合物药理活性广泛。具有抗疟[1]、抗肿瘤活性[2,3]、细胞毒[4]、抑菌[5]、抗炎止痛等作用[6,7]。此外,该属中许多植物还具有杀虫、抗疟作用,尤其在美洲,斑鸠菊属植物作为驱虫、抗疟疾的植物药其疗效显著[8]。据记载此种的干根或茎藤可治风湿痛、腰肌劳损、四肢麻痹等症,亦可用于感冒、发热等[9]。斑鸠菊属植物在我国资源丰富,目前对毒根斑鸠菊植物的化学成分和药理活性研究还不够深入,存在着广阔的开发空间,尤其对毒根斑鸠菊植物的茎叶研究少之又少,因此,有必要对该植物进行更深入系统的研究,为其建立完善的质量标准。
本文对毒根斑鸠菊叶茎的95%乙醇提取物中的乙酸乙酯萃取部分进行了分离纯化,旨在丰富该植物的化学成分研究。对分离得到的新倍半萜内酯化合物进行了抗菌活性测定。为毒根斑鸠菊的进一步开发利用提供了科学参考。
1 材料与方法
1.1 材料
柱层析硅胶H(75~150、45~75 μm)、硅胶板(青岛海洋化工厂);Sephadex LH-20(Merck公司);循环水多用真空泵(SHB-3型,上海亚荣盛华仪器厂);旋转蒸发仪(E-52型,上海亚荣生化仪器厂);显微熔点仪(SGW X-4型,上海精密仪器有限公司);Buchi中压制备色谱仪(653型,瑞士Buchi公司);核磁共振仪(Bruker Avance 500型,德国Bruker公司);质谱仪(Agilent Technology 5975C);单晶衍射仪(Bruker SMART-1000 CCD diffractomter XD-3型X射线单晶衍射仪,XRD,德国Bruker公司)。试剂均为国产分析纯。
革兰氏阴性细菌(大肠杆菌Escherichiacoli、枯草芽孢杆菌Bacillussubtilis伤寒杆菌Salmonellaenterica);革兰氏阳性细菌(金黄色葡萄球菌Staphylococcusaureus)作为检测菌种,以上菌种均为本实验室保存种。
大肠杆菌培养基、金黄色葡萄球菌培养基、枯草芽孢杆菌、伤寒杆菌所用培养基为营养肉汤和营养琼脂。营养肉汤、营养琼脂(杭州百思生物技术有限公司);青霉素钾与庆大霉素(百灵威科技有限公司)。
本实验所用毒根斑鸠菊叶茎样品于2019年1月采自于海南省昌江黎族自治县,由青岛科技大学化学与分子工程学院钟惠民教授鉴定。凭证样品(No.2019DGBJJ)保存于济宁医学院分子医学与化学实验室。
1.2 实验方法
1.2.1 提取和分离
准确称取毒根斑鸠菊叶茎干样15 kg粉碎后用95%乙醇加热提取3次,每次5 h。合并提取液,过滤,将滤液于50 ℃以下减压浓缩,得到浸膏192 g。用蒸馏水将其分散成悬浊液,依次用石油醚、乙酸乙酯、正丁醇进行萃取(1 500 mL×3),将萃取液合并后减压浓缩,得到各组分浸膏分别为:35、26、61 g。将乙酸乙酯提取物浸膏(26 g)经反复硅胶柱色谱(石油醚-丙酮梯度洗脱100∶1→2∶1)分得6个流份(Fr1、Fr2、Fr3、Fr4、Fr5、Fr6)。流份Fr2依次经Sephadex LH-20凝胶色谱(95%乙醇)和硅胶柱色谱(石油醚-丙酮,体积比为20∶1→6∶1)分离,得到化合物2(12.5 mg)、3(9 mg)。流份Fr3依次经过Sephadex LH-20凝胶色谱(95%乙醇)和硅胶柱色谱(石油醚-丙酮,体积比为10∶1→1∶1)分离,得到化合物4(6.5 mg)。流份Fr4依次经过Sephadex LH-20凝胶色谱(95%乙醇)和硅胶柱色谱(氯仿-甲醇,体积比为30∶1→10∶1)分离,得到化合物5(7.6 mg)、6(9.8 mg)。流份Fr5依次经过中压色谱柱和硅胶柱色谱(氯仿-甲醇,体积比为10∶1→3∶1)分离,得到化合物7(5.2 mg)。流份Fr6依次经过Sephadex LH-20凝胶色谱(95%乙醇)和硅胶柱色谱(石油醚-丙酮,体积比为6∶1→2∶1)分离,得到化合物1(11.5 mg)。
1.2.2 抗菌活性测定
本实验采用双层琼脂扩散法对化合物1进行抗大肠杆菌、枯草芽孢杆菌、伤寒杆菌、金黄色葡萄球菌4种菌株活性的测定,以青霉素钾与庆大霉素作为阳性对照。将所用菌群活化后并调整菌体浓度为1×106CFU/mL。于无菌平皿中倒入10 mL的1.5%的素琼脂,待其凝固后用无菌镊子取灭菌的牛津杯(直径8 mm)数个,按一定次序整齐排列于平皿中。取50 μL活化好的菌群悬液加入到15 mL冷却至50 ℃左右的半固体牛肉膏蛋白胨培养基中,迅速混匀,将混合均匀的培养基倾倒于底层素琼脂上,待其充分冷却凝固后,以无菌镊子取出牛津杯,即形成若干孔洞。配制无菌化合物1溶液(1 mg/mL),按照顺时针方向依次在牛津杯中加入120 μL抑菌液,以双抗作阳性对照。超净工作台上放置2 h后,置37 ℃恒温箱培养过夜,观察是否出现抑菌圈,出现抑菌圈的用游标卡尺测量抑菌圈直径。
2 结构鉴定
2.1 化合物1的结构鉴定
2.1.1 晶体结构测试
选取合适尺寸的化合物1单晶,放于X射线单晶衍射仪上,用经过石墨单色器单色化的MOKα射线(λ= 0.710 73)作为光源,于293(2)K温度下,经φ-ω扫描方式,在一定角度范围内收集所有衍射点,选取I > 2σ(I)的一定数量独立衍射点用于结构的测定与修正,数据经Lp因子及半经验吸收校正,所有计算经SHELXL97程序解出,非氢原子坐标和各向异性温度因子经全矩阵最小二乘法对F2修正,晶体结构由直接法和Fourier合成法解出。
2.1.2 晶体结构解析
化合物1在2.55° ≤ θ ≤ 25.02° 范围内共收集3 001个衍射点,其中2 105 [R(int)= 0.033 9]个独立衍射点,精修参数为237个,最终偏差因子R1 = 0.044 9,wR2 = 0.087 5,最大残余峰为0.172 e.A^-3,最小残余峰为-0.168 e.A^-3。该化合物属于单斜晶系,波长:Mo Kαradiation(0.710 73Å),Mw = 360.35,温度:293(2)K,尺寸:0.34 mm×0.25 mm×0.20 mm,空间群为P2(1),CCDC号:959512,晶体学参数为:a = 10.169 3(7),b = 7.819 6(6),c = 11.002 8(8),α= 90°,β= 98.325 0(10)°,γ= 90°,晶体密度为:21.382 mg/m3,化合物的不饱和度为:Ω = 10。通过X射线晶体分析确定了该化合物的相对构型为3R*、4R*、12S*。该化合物的晶体结构及堆积图如图1所示。

图1 化合物1的晶体结构及堆积图Fig.1 Crystal structure and packing diagram of 1
2.1.3 波谱解析
由H-H COSY得出氢原子相关信号H-5(δH6.55)-H-4(δH5.78)-H-3(δH3.02)-H-12-(δH4.98)-H-11(δH2.76,3.02)和H-7(δH2.46,2.92)-H-8(δH2.46,3.02)-H-9(δH6.71)推导出化合物含有=CH-CH-O-与CH2=C(CH)-CH-O-片段。HMBC相关显示H-3与C-5(δc149.8)、C-13(δc127.6)、C-1(δc169.1),H-4与C-6(δc141.1)、C-12(δc71.8)、C-2(δc134.9),H-5与C-7(δc21.6)、C-14(δc195.8),H-7与C-9(δc141.1)、C-14(δc195.8),H-9与C-15(δc194.9)、C-11(δc26.5),H-11与C-15(δc194.9)、H-12与C-10(δc139.3),H-13与C-1(δc169.1)相关。化合物1的关键HMBC和H-H COSY相关图(见图2)这些相关性表明该化合物具有gemacrane型碳骨架。与已知化合物4′-hydroxypectorolid[10]相比两个羟基氧化成了两个醛基,HMBC中得知H-12同C-16(δc164.9)相关确定该化合物的结构为2-hydroxy methyl acryl acid,经文献检索该化合物为一新化合物,命名为vernone A,其核磁共振氢谱与碳谱数据见表1。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
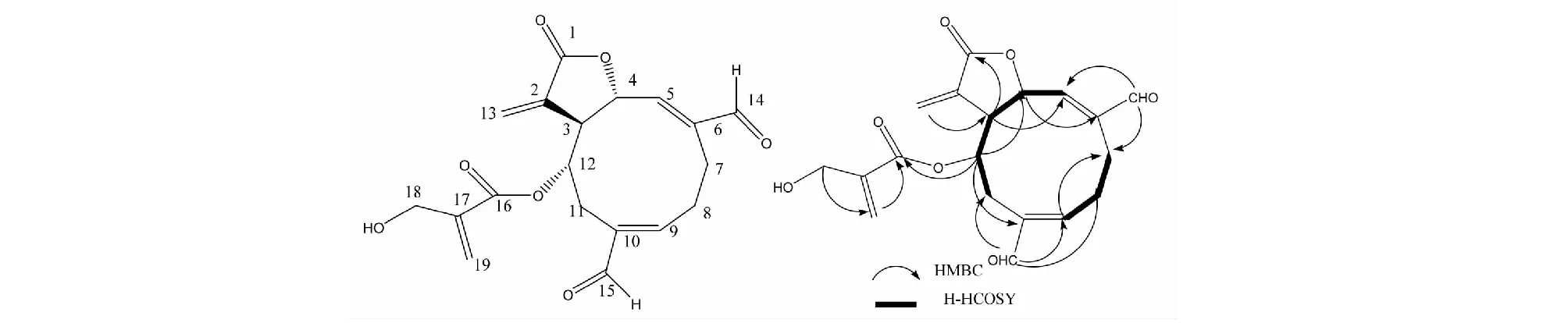
图2 化合物1的关键HMBC和H-H COSY相关图Fig.2 Key HMBC and H-H COSY correlation diagram of compound 1

表1 化合物1的1H和13C谱数据Table 1 1H and 13C NMR data of 1(500 and 125 MHz in DMSO)
2.2 化合物2~7结构鉴定
化合物2白色片状结晶;mp.136 ℃;分子式C29H48O;1H NMR(500 MHz,CDCl3)δ:5.05(1H,m,H-7),5.16(1H,dd,J= 14.8,8.4 Hz,H-22),5.24(1H,dd,J= 15.2,8.4 Hz,H-23),3.62(1H,m,H-3),0.56(3H,s,CH3-18),0.79(3H,s,CH3-19),0.83(3H,d,J= 7.2 Hz,CH3-27),0.83(3H,t,J= 7.2 Hz,CH3-29),0.85(3H,d,J= 6.4 Hz,CH3-26),1.05(3H,d,J= 6.4 Hz,CH3-21);13C NMR(125 MHz,CDCl3)δ:37.2(C-1),31.6(C-2),71.3(C-3),38.2(C-4),40.1(C-5),29.6(C-6),117.6(C-7),139.6(C-8),49.4(C-9),34.3(C-10),21.5(C-11),39.6(C-12),43.3(C-13),55.2(C-14),23.0(C-15),28.5(C-16),55.9(C-17),12.3(C-18),13.0(C-19),40.8(C-20),21.2(C-21),138.2(C-22),129.5(C-23),51.2(C-24),31.9(C-25),21.5(C-26),19.2(C-27),25.4(C-28),12.1(C-29)。以上数据与文献[11]报道的数据一致,故鉴定化合物2为α-菠甾醇。
化合物3白色针状结晶(氯仿);mp.140~142 ℃;Libermann-Burchard 反应呈阳性;1H NMR(500 MHz,CDC13)δ:5.35(1H,s,H-6),3.55(1H,m,H-3),2.28(2H,m,H-4),2.00(2H,s,H-7),1.65(1H,m,3-OH);13C NMR(500 MHz,CDCl3)δ:37.3(C-1),31.5(C-2),72.3(C-3),42.2(C-4),140.9(C-5),120.9(C-6),31.6(C-7),32.0(C-8),49.9(C-9),36.2(C-10),20.9(C-11),39.1(C-12),41.8(C-13),56.8(C-14),24.2(C-15),27.7(C-16),55.9(C-17),11.9(C-18),19.6(C-19),39.5(C-20),21.2(C-21),31.1(C-22),23.2(C-23),29.5(C-24),29.9(C-25),20.3(C-26),19.2(C-27),23.6(C-28),12.2(C-29)。以上波谱数据与文献数据[12]报道基本一致,故鉴定化合物3为β-谷甾醇。
化合物4淡黄色结晶;mp.228 ℃;ESI-MS:m/z269 [M-H]-;1H NMR(500 MHz,DMSO)δ:12.96(1H,s,5-OH),10.77(1H,s,7-OH),10.46(1H,s,4′-OH),7.90(2H,d,J= 9.0 Hz,H-2′,6′),6.97(2H,d,J= 8.5 Hz,H-3′,5′),6.78(1H,s,H-3),6.47(1H,d,J= 2.0 Hz,H-8),6.20(1H,d,J= 1.5 Hz,H-6);13C NMR(500 MHz,DMSO)δ:183.1(C-4),165.2(C-2),165.2(C-7),163.4(C-5),162.1(C-4′),158.7(C-9),129.2(C-2′,6′),123.2(C-1′),117.0(C-3′,5′),105.3(C-10),104.2(C-3),99.7(C-6),94.8(C-8)。以上数据与文献[13]报道的芹菜素数据吻合,故鉴定化合物4为芹菜素。
化合物5黄色粉末;mp.262 ℃;分子式C16H12O7;ESI-MS:m/z315 [M-H]-:1H NMR(500MHz,DMSO-d6)δ:12.80(1H,s,5-OH),7.71(1H,d,J= 2.0 Hz,H-2′),7.58(1H,dd,J= 8.0,2.0 Hz,H-6′),7.01(1H,d,J= 8.0 Hz,H-5′),6.49(1H,d,J= 2.0 Hz,H-8),6.25(1H,d,J= 2.0 Hz,H-6),3.86(1H,s,4′-OCH3);13C NMR(500 MHz,DMSO-d6)δ:178.7(C-4),164.1(C-7),162.4(C-9),156.9(C-5),155.9(C-4′),148.3(C-2),144.9(C-3′),138.5(C-3),122.2(C-1′),121.2(C-6′),115.5(C-2′),115.4(C-5′),104.0(C-10),98.5(C-6),93.6(C-8),59.3(4′-OCH3)。上述数据与文献[14]所报道的柽柳素数据吻合,因此确定该化合物为柽柳素。
化合物6白色晶体;mp.194 ℃;分子式为C30H50O;EI-MS:m/z426 [M]+;1H NMR(500 MHz,CDCl3)δ:3.22(1H,dd,J= 10.5,5.0 Hz,H-3),5.31(1H,d,J= 6.3 Hz,H-11),0.97(3H,s,H-23),0.87(3H,s,H-24),1.07(3H,s,H-25),0.74(3H,s,H-26),0.82(3H,s,H-27),0.76(3H,s,H-28),0.90(3H,d,J= 6.5 Hz,H-29),0.85(3H,d,J= 6.5 Hz,H-30);13C NMR(500 MHz,CDCl3)δ:39.2(C-1),28.1(C-2),79.1(C-3),39.2(C-4),44.2(C-5),17.9(C-6),19.1(C-7),39.9(C-8),150.9(C-9),37.6(C-10),116.1(C-11),36.7(C-12,13),37.7(C-14),29.2(C-15),36.1(C-16),42.9(C-17),51.9(C-18),20.1(C-19),28.1(C-20),59.6(C-21),30.7(C-22),27.4(C-23),14.9(C-24),25.2(C-25),15.3(C-26),15.8(C-27),13.9(C-28),22.1(C-29),22.9(C-30)。以上数据与文献[15]报道基本一致,故鉴定该化合物6为羊齿烯醇。
化合物7浅褐色油状物;ESI-MS:m/z177 [M-H]-;1H NMR(500 MHz,CDCl3)δ:9.65(1H,d,J= 8.0 Hz,-CHO),7.41(1H,d,J= 16.0 Hz,H-3),7.14(1H,dd,J= 8.0,2.0 Hz,H-5′),7.08(1H,d,J= 2.0 Hz,H-3′),6.97(1H,d,J= 8.5 Hz,H-6′),6.59(1H,dd,J= 16.0,7.5 Hz,H-2),3.96(3H,s,2′-OCH3)。1H NMR数据与文献[16]报道的4-羟基-2-甲氧基肉桂醛数据一致,在薄层板上以不同的展开体系与标准品对照其Rf值相同,浓硫酸显色相同,样品与标准品混合测熔点不下降,因而鉴定为4-羟基-2-甲氧基肉桂醛。
3 讨论与结论
从毒根斑鸠菊叶茎乙醇提取物的乙酸乙酯萃取部分经硅胶和Sephadex LH-20层析柱分离得到了7个化合物,它们分别是vernone A(1)、α-波甾醇(2)、β-谷甾醇(3)、芹菜素(4)、柽柳素(5)、羊齿烯醇(6)、4-羟基-2-甲氧基肉桂醛(7)。其中化合物4~7是首次从该植物中提取得到,化合物1为一个新的倍半萜内酯化合物。抑菌结果显示vernone A在实验浓度范围内对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌及伤寒杆菌未表现出明显抑菌作用。该倍半萜对所筛查的菌落抑菌作用不明显,对该化合物的活性作用需进行进一步筛查。本文报道了其分离方法、结构鉴定、活性测定,为毒根斑鸠菊的综合开发和利用提供了一定理论基础和依据。
Vernone A为一个新的吉马烷型倍半萜内酯,结构上首次发现含有两个醛基的吉马烷型倍半萜内酯,而吉马烷型倍半萜是几类倍半萜骨架的生物合成前体。由于结构特性,部分倍半萜具有较好的抗肿瘤、抗炎、抗疟、杀虫、抗病毒等生物活性。因此,基于倍半萜成分对斑鸠菊属植物资源进行研究与开发利用将具有广阔的前景。虽然目前对斑鸠菊属植物中倍半萜类成分的研究取得了一定的进展,但是也存在一些不足。从得到的化学成分来看,研究目标主要在倍半萜,但多数倍半萜结构复杂,存在构象异构体和构型异构体,采用传统色谱方法分离较为困难。在药理活性方面,近年来研究[3,7,8]表明部分倍半萜化合物有较好的抗炎、抗疟活性,并从信号通路、作用靶点上解释了其抗炎机制,但是药理活性的研究主要集中在单体化合物的体外活性筛选,而体内药效评价、作用机制及构效关系的研究甚少,可能与化合物产量不够无法深入研究有关。
鉴于此,今后对斑鸠菊属药用植物的深入研究与开发中,建议从以下几点着手:①采用更先进的方法和手段从斑鸠菊属植物中分离、鉴定更多的倍半萜类化合物,如LC-MS,UPLC-MS等;②对筛选得到的强活性倍半萜类化合物进行大量制备或合成,以便深入进行体内药效评价及机制靶点的研究;③研究显示不少倍半萜有极好的抗肿瘤效果,迄今为止,自斑鸠菊属分离得到的倍半萜内酯类化学成分具有极好的抗疟、抗肿瘤活性,可利用构效关系研究,对倍半萜类成分进行结构修饰,开发更适于临床的抗肿瘤药物。此外,斑鸠菊属植物在我国资源丰富,目前该属植物的化学成分和药理活性研究还不够深入,存在广阔的开发空间。因此有必要对该属植物进行更深入系统的研究,为其建立完善的质量标准。
