基于网络药理学探讨“黄芪-白术-熟地黄”组方防治肾病综合征的作用机制
2021-03-08席雨蒙张玉笛陶春鹤章蓝月曹文富
轩 晨,席雨蒙,张玉笛,陶春鹤,章蓝月,曹文富,*
1重庆医科大学附属第一医院中西医结合科;2重庆医科大学中医药学院,重庆 400016
肾病综合征是一类以大量蛋白尿,低蛋白血症,水肿和高脂血症为主要表现的临床病理综合征,是导致终末期肾衰竭的主要原因之一[1]。肾病综合征发病机制复杂,尚不完全清楚。临床以免疫调节,降低尿蛋白,改善肾功能和对症治疗为主,难以取得理想的治疗效果。中药具有多靶点多层次的优势,在肾病综合征的治疗中具有良好的前景。
肾病综合征属于中医“水肿”的范畴,与肺脾肾三脏功能异常有关[2]。HBS分别作用于肺(黄芪)、脾(白术)和肾(熟地黄),是中医治疗肾病综合征的常用药物组合。研究表明,黄芪具有改善肾纤维化,保护肾功能的作用[3];白术水煎剂可以有效减少肾病综合征大鼠尿蛋白含量[4];熟地黄可改善阿霉素肾病大鼠的肾功能,减轻肾纤维化[5]。本研究使用网络药理学的方法,从分子水平对HBS治疗肾病综合征的作用机制进行系统分析,为临床应用和进一步研究提供理论支持。
1 材料与方法
1.1 肾病综合征基因收集和分析
在DisGeNET数据库(https://www.disgenet.org)和GeneCards数据库(https://www.genecards.org)中,以“Nephrotic syndrome”为关键词查找肾病综合征基因,根据相关性得分(Relevance score)对基因进行排序,将DisGeNET和GeneCards数据库中相关性得分最大的100个基因整理汇总,以此构建肾病综合征基因库。然后将肾病综合征基因输入STRING(https://string-db.org)数据库,选择“Homo sapiens”作为目标物种,获取基因相互关联网络。将该网络导入Cytoscape3.6.0[6]软件中,使用clusterMaker进行功能模块分解,构建肾病综合征基因模块网络。将每个模块逐一输入STRING数据库进行Gene Ontology(GO)富集分析,提取相关生物学过程。
1.2 HBS化合物和靶点收集
在TCMSP数据库(https://tcmspw.com)中输入关键词“黄芪”、“白术”和“熟地黄”,分别查找其所含化合物。根据口服生物利用度(OB)≥30%、类药性(DL)≥0.18同时半衰期(HL)≥4作为标准对化合物进行筛选,满足这些条件的化合物被定义为有效化合物[7]。此外,从PubMed(https://pubmed.ncbi.nlm.nih.gov)中查找黄芪、白术和熟地黄治疗肾病综合征的文献,提取其中发挥治疗作用的有效成分,作为有效化合物的补充。分别在TCMSP数据库和SymMap数据库(https://www.symmap.org)中查找各有效化合物所对应的基因靶点,构建药物-化合物-靶点网络。
1.3 筛选有效靶点
在Cytoscape3.6.0软件中,以肾病综合征基因相互关联网络为背景,筛选出HBS靶点和肾病综合征基因的交集,作为HBS治疗肾病综合征的有效靶点。将有效靶点映射在肾病综合征基因模块网络中,初步分析HBS治疗肾病综合征的作用机制。随后,将有效靶点输入STRING数据库,选择“Homo sapiens”作为物种背景,获取有效靶点蛋白质相互作用网络。
1.4 有效靶点富集分析
将有效靶点导入STRING数据库中,分别进行GO和KEGG pathways富集分析,提取HBS治疗肾病综合征的主要生物学过程和信号通路,并以此构建靶点-生物学功能(TF)网络和靶点-信号通路(TP)网络,分析HBS治疗肾病综合征的可能生物学作用和信号通路。
1.5 构建HBS-肾病综合征作用机制网络
将药物、化合物、有效靶点、生物学过程和信号通路信息进行综合整理,导入Cytoscape3.6.0软件中,构建HBS-肾病综合征作用机制网络。
1.6 分子对接
从RCSB PDB数据库(http://www.rcsb.org)中下载TGFβ1、PTGS2、IL1B、IL2、IL4、IL10、TNF和CD40LG的3D结构pdb格式文件,并通过PyMOL[8]软件进行加氢、去水等处理。在ZINC数据库(http://zinc.docking.org)中下载sitosterol、quercetin、formononetin、hederagenin、isorhamnetin、calycosin和kaempferol的mol2格式文件并使其能量最小化。在AutoDockTools[9]软件中分别将蛋白和化合物转换为pdbqt格式文件,最后运行分子对接。化合物与靶蛋白的结合能小于0说明结合性良好[10]。
2 结果
2.1 肾病综合征基因
在DisGeNET数据库和GeneCards数据库中共筛选出166个肾病综合征基因,通过分解得到6个功能模块。对每个模块逐一进行GO富集分析,富集结果表明,肾病综合征基因参与的主要生物学过程包括细胞增殖和凋亡、肾脏发育、血脂调节、视觉感知、基因表达过程的调节以及线粒体基因的维持(见图1)。
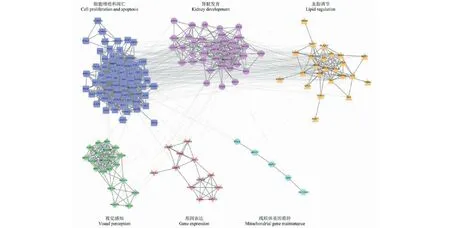
图1 肾病综合征基因功能模块分解Fig.1 Module decomposition of nephrotic syndrome gene network
2.2 HBS化合物和靶点
通过文献和数据库共筛选出23个有效化合物(表1)。其中黄芪(HQ)17个,白术(BZ)4个,熟地黄(SDH)3个(Molecule 4在黄芪和白术中均含有)。有效化合物中,已被证实具有肾脏保护作用的包括astragalosideⅣ、atractylenolide I、acteoside和betaine。将这些有效化合物逐一输入TCMSP数据库和SymMap数据库中,共得到221个不同的靶点。根据中药、化合物和靶点的对应关系构建药物-化合物-靶点网络(见图2)。

表1 HBS有效化合物表Table 1 Effective compounds of HBS
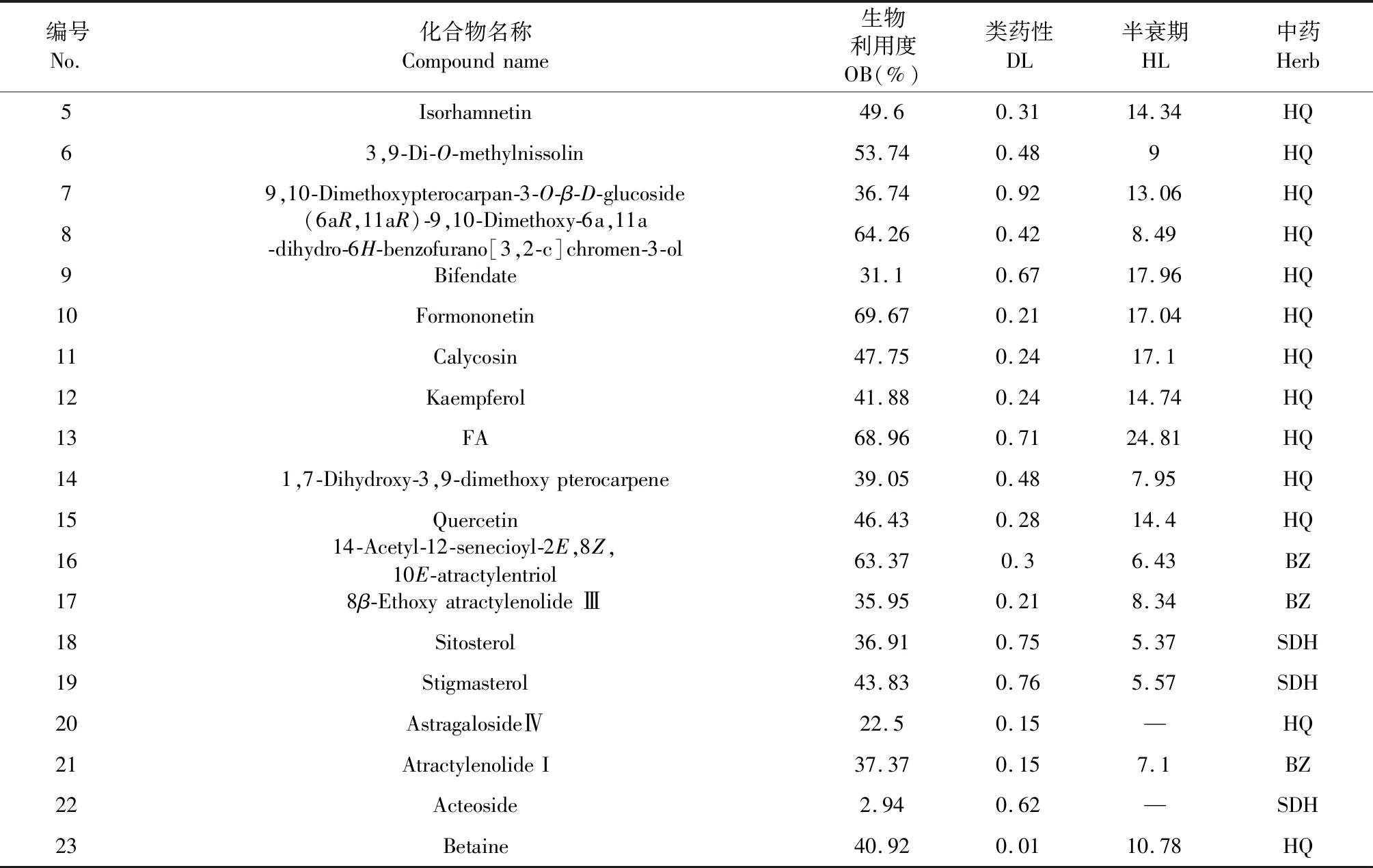
续表1(Continued Tab.1)
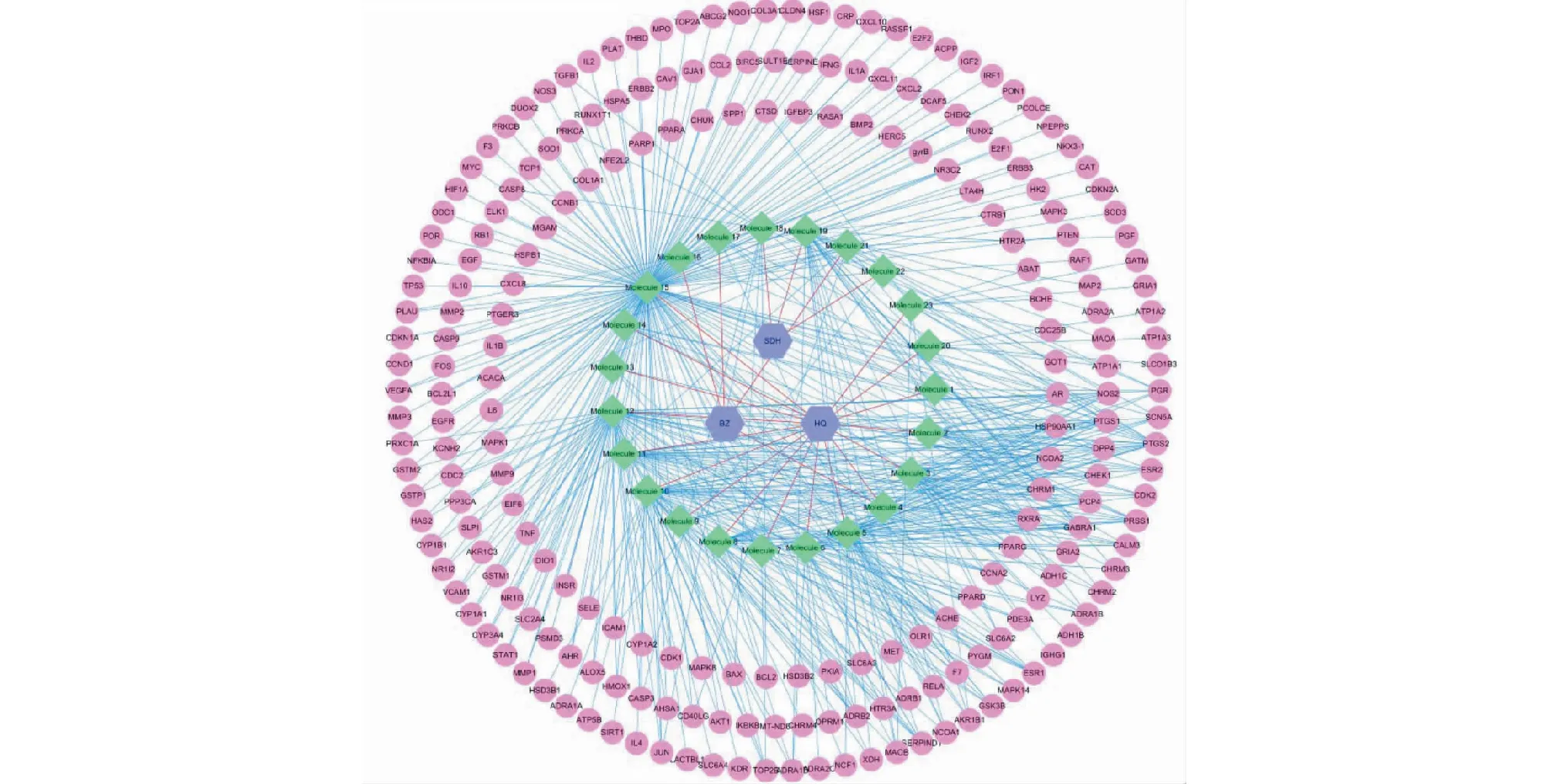
图2 药物-化合物-靶点网络Fig.2 Drug-compound-target network
2.3 有效靶点
以肾病综合征基因相互作用网络为背景,共筛选出18个有效靶点。将有效靶点映射在肾病综合征基因功能模块中,映射结果显示,有效靶点主要富集在调控细胞增殖和凋亡的基因模块中(见图3)。在STRING数据库中构建有效靶点的蛋白质相互作用网络(见图4)。
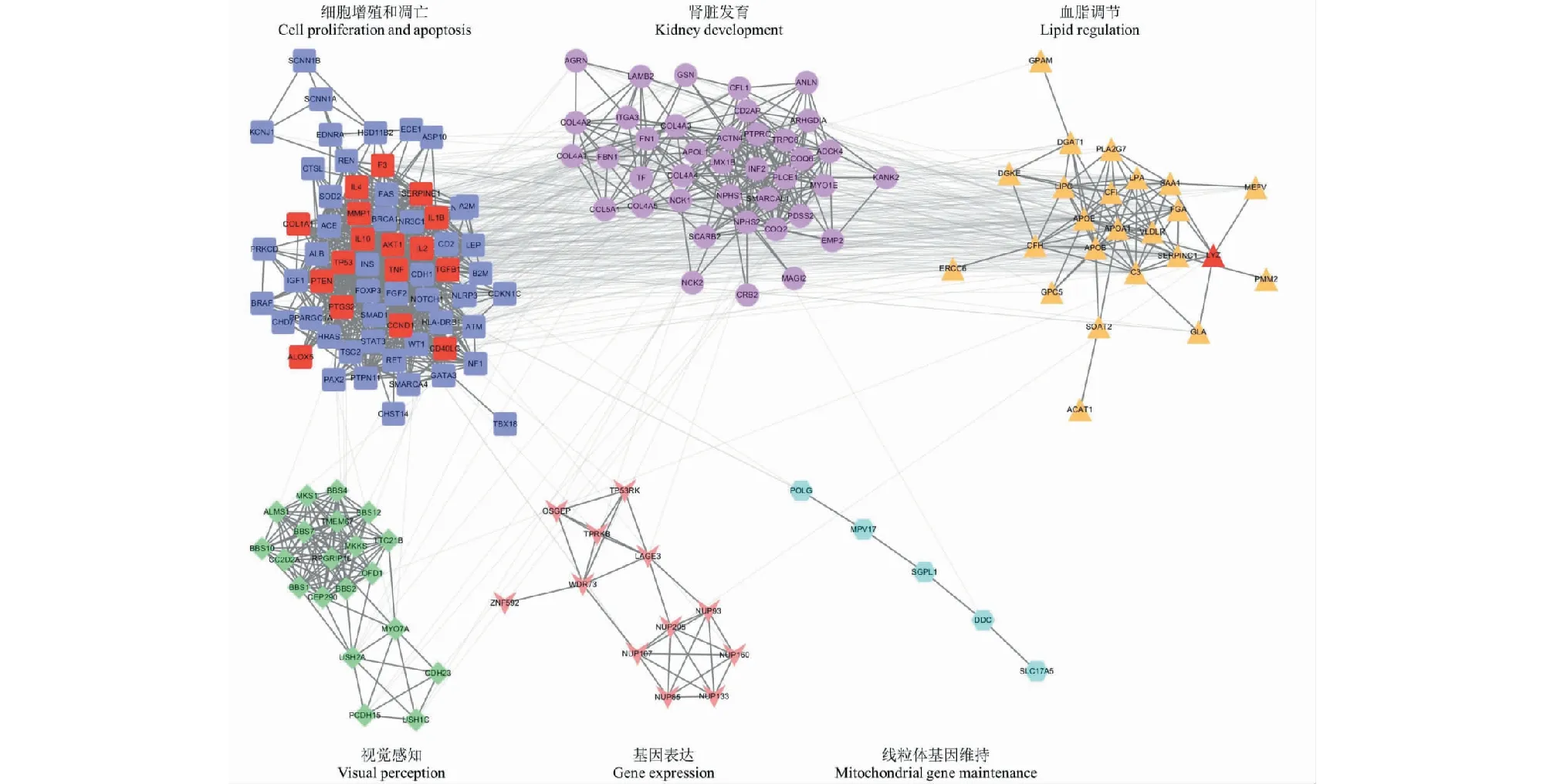
图3 有效靶点在肾病综合征基因模块网络中的映射 Fig.3 Mapping of effective targets in gene clusters network of nephrotic syndrome.注:图中红色表示有效靶点。Note:Red color in the figure indicate the effective targets

图4 有效靶点的蛋白质相互作用网络Fig.4 PPI network of effective targets
2.4 TF网络和TP网络
对有效靶点进行GO富集分析(图5A),并根据富集结果构建TF网络(见图6)。GO富集结果表明除调控细胞增殖和凋亡外,有效靶点还参与了对炎症反应和免疫反应过程的调节。此外,对有效靶点进行KEGG通路富集分析(见图5B),并构建TP网络(见图7)。KEGG富集结果显示HBS靶点主要富集在PI3K/Akt、IL-17、FoxO、Jak/STAT、p53和NF-κB信号通路上。

图5 GO富集分析(A)和KEGG通路富集分析(B)Fig.5 GO enrichment analysis (A) and KEGG pathways enrichment analysis (B)

图6 HBS治疗肾病综合征的TF网络Fig.6 TF network of HBS in the treatment of nephrotic syndrome

图7 HBS治疗肾病综合征的TP网络Fig.7 TP network of HBS in the treatment of nephrotic syndrome
2.5 HBS-肾病综合征作用机制网络
综合整理药物、化合物、有效靶点、生物学过程和信号通路信息,构建HBS-肾病综合征作用机制网络(见图8)。网络结构表明,HBS的16种化合物靶向18个有效靶点,这些靶点主要富集在6条信号通路上,通过调节细胞增殖、细胞凋亡、炎症反应和免疫反应来发挥治疗肾病综合征的作用。
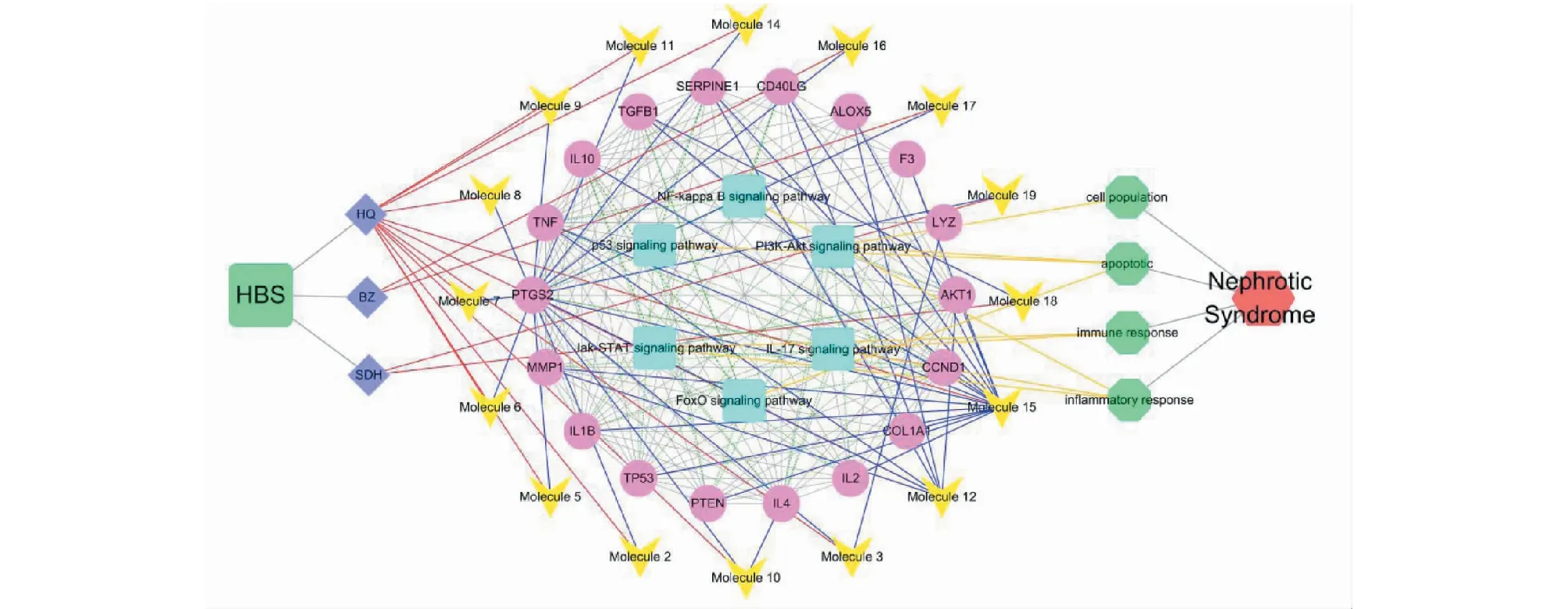
图8 HBS-肾病综合征作用机制网络Fig.8 Mechanism network of HBS-Nephrotic syndrome
2.6 分子对接
使用分子对接技术将关键蛋白与HBS化合物进行对接验证。有效靶点中有8个是介导免疫反应和炎症反应的细胞因子,包括TGFβ1、PTGS2、IL1B、IL2、IL4、IL10、TNF和CD40LG[13]。这些炎性细胞因子参与了肾脏的慢性炎症反应和病理损伤过程,是治疗肾病综合征的关键靶点。提取这些细胞因子和靶向他们的化合物进行分子对接验证,对接结果见表2和图9。结果表明HBS化合物与TGFβ1、PTGS2、IL1B、IL2、IL4、IL10、TNF和CD40LG等炎性细胞因子具有较好的结合活性。
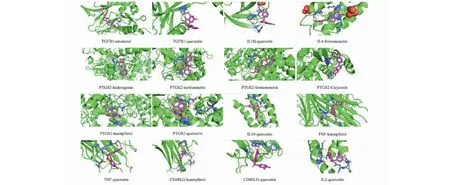
图9 分子对接模式图Fig.9 Molecular docking pattern diagram

表2 分子对接表Table 2 Molecular docking table
3 讨论
肾病综合征发病因素复杂,包括免疫功能异常、炎症反应、高血压、糖代谢紊乱和病毒感染等。其中免疫功能异常和炎症反应在原发性肾病综合征的发生发展中起到重要作用[11]。肾病综合征的病理机制尚不完全清楚,目前研究表明,由于长期慢性炎症反应引起的肾小球足细胞过度凋亡、系膜细胞增生、细胞外基质堆积是导致包括蛋白尿、肾小球硬化和肾功能持续降低的关键因素[12]。本研究通过对肾病综合征基因进行功能模块分解和富集分析,证实了肾病综合征病理进程与细胞增殖和凋亡过程的关联。通过将HBS有效靶点映射在肾病综合征基因模块网络中,发现有效靶点与调控细胞增殖和凋亡的基因模块密切相关。此外,有效靶点的富集分析结果表明,除调控细胞增殖和凋亡外,有效靶点还参与了炎症反应和免疫反应过程。由此,我们猜测HBS可能通过调节免疫反应和炎症反应,改善系膜细胞和足细胞的增殖、凋亡水平,来发挥治疗肾病综合征的作用。
HBS通过16种化合物靶向18个有效靶点。其中TGFβ1、PTGS2、IL1B、IL2、IL4、IL10、TNF和CD40LG均为介导免疫反应和炎症反应的关键细胞因子[13],分子对接结果显示,HBS化合物与这些炎性细胞因子具有较好的结合活性。此外,有效靶点中PTEN、Akt、TGF-β和TP53还与系膜细胞增殖、足细胞损伤和细胞外基质堆积过程有关[14,15]。有效靶点主要富集在IL-17、NF-κB、PI3K/Akt、FoxO、p53和Jak/STAT信号通路上。IL-17信号通路在急性和慢性炎症中均发挥着重要作用,有效靶点中TNF、PTGS2、IL1B和IL4富集在IL-17信号通路上。研究表明在自身免疫性疾病中IL-17信号通路的激活与慢性炎症反应的发生密切相关[16],这表明对IL-17信号通路的调节可能是HBS改善免疫炎症反应治疗肾病综合征的关键。NF-κB通路是炎症反应的经典信号通路,TNF和IL1可以激活NF-κB信号通路,活化的NF-κB以p50/p65二聚体的形式进入细胞核并激活基因转录,进而诱导和推动炎症反应进程[17]。PI3K/Akt信号通路可以被多种细胞因子激活,对细胞生长、增殖和凋亡等基本功能发挥调节作用[18]。包括INS和Akt在内的11个有效靶点富集在PI3K/Akt信号通路上,表明HBS可能通过调控PI3K/Akt信号通路,从而改善肾病综合征状态下肾脏细胞的异常增殖和凋亡。FoxO是PI3K/Akt信号通路的下游蛋白,FoxO信号通路被激活后,对细胞凋亡和葡萄糖代谢发挥调节作用[19]。在DNA损伤和氧化应激时p53信号通路被激活,激活后的p53信号通路可以引起包括细胞周期停滞、衰老和凋亡在内的一系列损伤过程[20]。这些信号通路在肾病综合征的发生发展过程中均发挥着重要作用。表明HBS可能通过调节免疫反应和炎症反应,改善改善系膜细胞和足细胞的增殖、凋亡水平,进而对肾病综合征状态下的蛋白尿和肾小球硬化发挥治疗作用。
综上所述,本研究通过网络药理学方法对HBS治疗肾病综合征的作用机制进行系统分析。结果表明,HBS靶向IL-17、NF-κB、PI3K/Akt、FoxO、p53和Jak/STAT等信号通路上的关键靶点,可能通过调节免疫反应和炎症反应,改善系膜细胞和足细胞的异常增殖和凋亡,进而减轻肾病综合征状态下的蛋白尿和肾小球硬化。然而本研究仅依托于数据库信息,未考虑中药剂量和煎服方法等问题。因此,所得结论需要通过实验进一步验证。
