2-羟基-3-甲基蒽醌抑制结直肠癌的作用及机制研究
2021-03-08谭佳妮刘文豪沈卫星孙东东程海波
谭佳妮,刘文豪,沈卫星,孙东东*,程海波*
1南京中医药大学转化医学研究中心 国家中医药管理局名医验方评价与转化重点实验室 江苏省抗肿瘤验方与产业化工程实验室;2江苏省中医药防治肿瘤协同创新中心,南京 210023
结直肠癌是常见的恶性消化道肿瘤之一,在我国其发病率呈明显上升趋势,死亡率居第2位[1,2]。结直肠癌早期病发隐匿,大部分确诊时已处于中晚期。手术化疗为目前结直肠癌的主要治疗手段,但术后2年内复发率高达50%,此外严重的副作用使患者生活质量明显下降[3]。越来越多的研究发现中医药具有抑制结直肠癌复发转移、减轻放化疗毒副作用的优势,已成为结直肠癌治疗的重要手段之一。白花蛇舌草具有清热解毒、利尿消肿的功能,药理学研究表明其具有明显的抗肿瘤活性,临床上多与其他药物配伍用于抗肿瘤治疗,效果显著且毒副作用小[4,5]。蒽醌类化合物在白花蛇舌草中含量较高,属于其特征性成分。2-羟基-3-甲基蒽醌(HMA)是白花蛇舌草中具有抗肿瘤效应的蒽醌类化合物之一,具有抑制白血病、肝癌、肺癌等多种肿瘤细胞增殖的作用[6-8],但其对结直肠癌的影响及作用机制尚未见报道。本研究以人结直肠癌细胞为研究对象,观察了HMA对结直肠癌细胞增殖活性的影响,并对其作用机制进行了探讨。
1 材料与仪器
1.1 试验药物
2-羟基-3-甲基蒽醌购自上海源叶生物科技有限公司(批号:B50429)化合物溶于DMSO中,配制成母液,置于-40 °C低温储存。
1.2 试剂与仪器
RPMI-1640高糖培养基、胰蛋白酶溶液、青霉素-链霉素溶液(上海源培生物技术有限公司,批号:F40411,K40410,E40401);胎牛血清(Capricorn scientific公司,批号:1705124);MTT、DMSO(Sigma公司,批号:SP1080、SHBH2446V);细胞裂解液(Bio-sharp公司,批号:6503595);Hoechst33342-PI染色液、GSH和GSSG检测试剂盒(碧云天,货号:S0053、C1028);AnnexinV-FITC/PI细胞凋亡检测试剂盒(BD公司,批号:556547);Bax、Bcl-2、PARP-1、Cleaved PARP、Keap-1、Nrf-2、HO-1、GAPDH及Lamin B1抗体(CST公司,货号:5023、51071、9532、6987、8047、12721、86806、5174、13435):Pall超纯水系统(美国Pall公司);CPA225D万分之一电子天平(赛多利斯科学仪器北京有限公司);FC型酶标仪、HERAcell150i型二氧化碳培箱(美国Thermo公司);ECLIPSETi-5型荧光倒置显微镜(日本Nikon公司);BD FACS Calibur流式细胞仪(美国BD公司);Tanon-5500型化学发光凝胶成像仪器(中国天能科技有限公司):Power PacTMBasic型电泳仪(美国Bio-Rad公司)。
2 实验方法
2.1 细胞培养
人结直肠癌HT-116细胞购自中国科学院上海生科院细胞资源中心。细胞置于37 °C,5% CO2培养箱内。使用含10%FBS及100 U/mL青链霉素的PRMI-1640高糖完全培养基。取对数生长期的细胞用于实验,细胞融合度约90%时用胰蛋白酶消化传代或种板。
2.2 细胞增殖活性检测
取对数生长期结直肠癌细胞,调整细胞密度104个/ mL加入96孔板中,100 μL/孔,置于5%CO2孵箱中,24 h弃掉培养上清后分别加入25、50、100 μM的HMA,平行设6个复孔,继续培养24、48、72 h。干预结束后每孔加入10 μL CCK-8继续培养4 h,酶标仪检测450 nm处的吸光度A值,根据A值计算各浓度HMA对细胞增殖的抑制作用。实验重复3次。
2.3 细胞凋亡检测
取对数生长期结直肠癌细胞,调整细胞密度106个/ mL加入6孔板中,1 mL/孔,置于37 ℃ 5% CO2孵箱中过夜。次日,弃掉培养上清后加入各浓度HMA,设3个复孔,继续培养24 h。给药结束后,弃去培养上清,PBS清洗,1 mL空白培养基中,加入Hoechst染液,终浓度为5 μg/mL,37 ℃避光孵育10 min。继续加入PI染液,终浓度为5 μg/mL,37 ℃避光孵育10 min。染色结束后,直接在荧光显微镜下观察,Heochst-33342用氪激光激发的紫外光,激发波长为352 nm,发射波长为400~500 nm,产生蓝色荧光;PI用氩离子激光激发荧光,激发波长为488 nm,发射波波长大于630 nm,产生红色荧光。
2.4 细胞内ROS检测
六孔板中,HMA作用于HCT-116细胞24 h后,用PBS洗涤,加入终浓度为10 μM的DCFH-DA中,37 ℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞三次,以充分去除未进入细胞内的DCFH-DA。荧光显微镜下观察细胞内ROS含量变化情况。实验重复3次。
2.5 细胞内GSH含量检测
用HMA处理HCT-116细胞24 h后,用PBS洗涤细胞一次,按GSH和GSSG试剂盒说明(碧云天)对样本进行处理:除去蛋白后,利用液氮和37 ℃水浴对样品进行两次快速的冻融。冰浴放置5分钟。于4 ℃,10 000 rpm离心10 min。取上清用于总谷胱甘肽的测定。实验重复3次。
2.6 Western blot检测细胞蛋白变化
对数生长期结直肠癌细胞,贴壁后培养至细胞溶合80%~90%时,分别加入HMA孵育48 h后,收集空白组细胞及处理后的细胞,RIPA裂解液(碧云天)裂解细胞提取蛋白。用BCA法定量蛋白,调整蛋白浓度统一后,95 ℃金属浴中变性10 min。10%~12%分离胶和5%浓缩胶SDS-PAGE凝胶电泳分离蛋白。湿转法转膜将蛋白转至PVDF膜上后应用10%脱脂牛奶37 ℃封闭2 h。一抗4 ℃孵育过夜。次日,PBST洗膜3次后,室温孵育二抗1 h,应用增强型化学发光试剂(ECL)发光试剂盒进行显色,Gel Analysis软件进行条带分析。实验重复3次。
2.7 氧化还原水平改变,对细胞凋亡影响的验证
为进一步验证细胞内氧化还原平衡状态破坏诱导了结直肠癌细胞的凋亡,我们对HCT-116细胞预先用1 mM NAC处理1 h后,再加入50 μM HMA共孵育24 h后对细胞凋亡的影响。实验重复3次,并对结果进行分析。
2.8 统计学分析
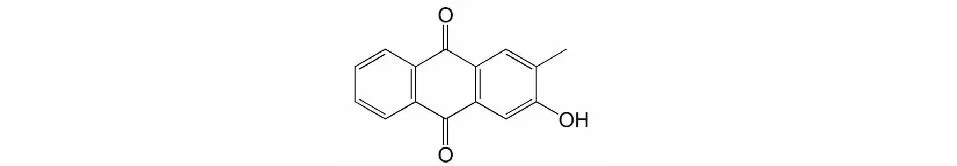
图1 HMA(2-羟基-3-甲基蒽醌)结构式Fig.1 The chemical structure of HMA
3 结果
3.1 HMA对结直肠癌细胞增殖的影响
检测HMA对肝癌细胞株HCT-116细胞生长的抑制作用结果如图2所示,随着HMA浓度的增加,其对HCT-116细胞生长的抑制作用增强。HMA作用HCT-116细胞24、48和72 h后,细胞的生长明显受到抑制,且抑制作用随作用时间的延长而增强,呈时间相关性。在作用细胞24、48和72 h时,其IC50分别为85.27±7.931、52.38±7.719、47.29±5.675 μM。考虑到作用效果更明显,在后续实验中我们将HMA给药时间定为48 h,给药剂量设为25、50、100 μM。
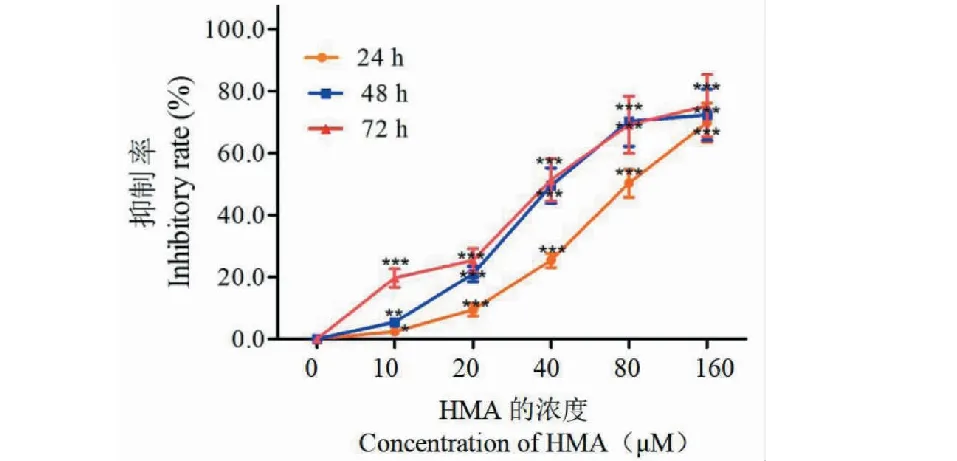
图2 HMA对HCT-116细胞增殖的抑制作用Fig.2 Inhibitory rate of HMA on human 注:与对应时间点空白对照组比较,*P<0.05,** P<0.01,***P<0.001.Note:Compared with control,*P<0.05,** P<0.01,***P<0.001.
3.2 HMA对细胞形态及凋亡的影响
荧光染料Hoechst 33342可以少许的进入正常细胞膜的,使其染上低蓝色,而凋亡细胞中的Hoechst 33342染料比进入正常细胞的多,蓝色荧光增强。同时,活细胞对PI染料拒染,坏死的细胞可以被PI染料着色(红色)。根据以上这些特性,用Hoechst 33342染料结合PI染料对细胞进行双染色,可以通过荧光显微镜将正常细胞、凋亡细胞和坏死细胞区别开来。染色结果如图3所示,正常细胞形态呈多边形、淡蓝色;而低中剂量HMA给药组的细胞,由于细胞核内Hoechst浓集而呈亮蓝色,或核呈碎片状。100 μM HMA给24 h后,细胞会被PI着色呈红色。
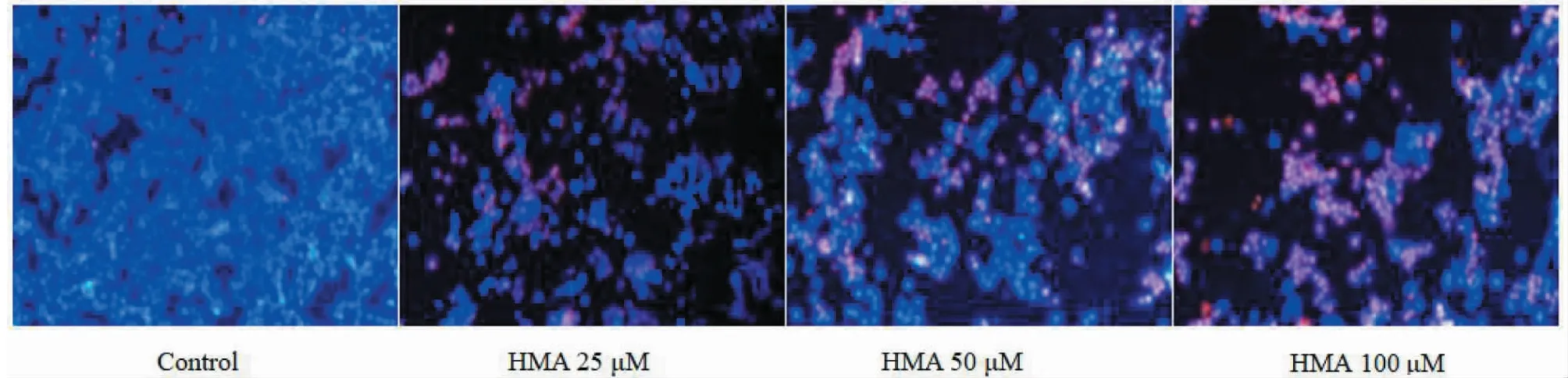
图3 HMA对HCT-116细胞凋亡的影响(20×)Fig.2 The effect of HMA on apoptosis in HCT-116 cells
3.3 HMA对细胞内ROS含量的影响
采用DCFH-DA荧光探针,通过检测DCF的荧光强度检测HMA给药后细胞内的ROS水平变化,检测结果如图4所示:随着HMA给药浓度的增加,HCT-116细胞中DCF的绿色荧光逐渐增强。提示,化合物HMA会显著升高细胞内的ROS水平,破坏了细胞内的氧化还原平衡。

图4 HMA对HCT-116细胞内ROS含量的影响(20×)Fig.4 The effect of HMA on the level of ROS in HCT-116 cells
3.4 HMA对GSH的影响
GSH是细胞内的主要抗氧化剂之一,它可以直接清除ROS,或者可以做为谷胱甘肽过氧化物酶以及脂质过氧化物酶的主要辅助因子间接的清除细胞内的活性氧。实验检测了HMA给药后,HCT-116细胞内GSH含量的变化情况,结果如图5所示:正常组细胞内的GSH含量为75.56±5.91 μmol/g prot;给予化合物HMA(25、50和100 μM)48 h后细胞内GSH含量显著下降,变为59.81±4.79、34.51±2.98、10.79±1.29 μmol/g prot。
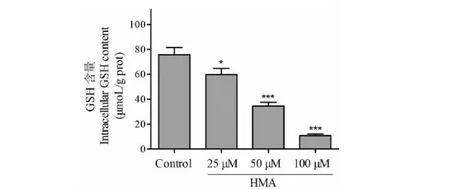
图5 HMA对HCT-116细胞内GSH含量的影响 Fig.5 The effect of HMA on intracellular GSH content in HCT-116 cells n =3) 注:与空白对照组比较,*P<0.05,** P<0.01,***P<0.001,下同。Note:Compared with corresponding control,*P<0.05,** P<0.01,***P<0.001,the same below.
3.5 HMA对细胞凋亡相关蛋白及通路的影响
利用Western blot方法检测HMA对凋亡蛋白Bax,Bcl-2表达以及PARP-1蛋白活化水平的影响。结果如图6所示,与对照组相比,HMA可引起Bax蛋白表达上调,而Bcl-2蛋白表达下调,Bax/Bcl-2比值升高。同时,随HMA给药浓度的增加,Cleaved PARP蛋白活化水平也逐渐升高,提示HMA对凋亡蛋白具有明显的诱导作用。
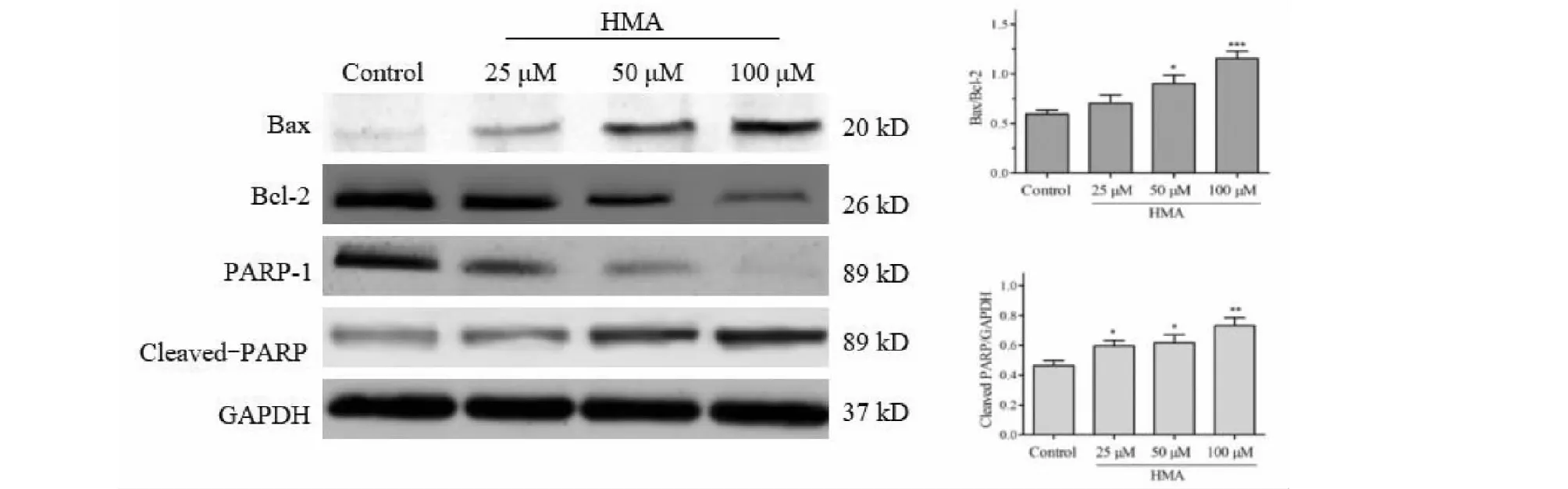
图6 HMA对HCT-116细胞凋亡蛋白表达的影响Fig.6 The effect of HMA on the expression of apoptosis-related proteins in HCT-116 cells
3.6 对Keap-1/Nrf-2/HO-1信号通路蛋白的影响
HMA对Nrf-2 /ARE信号通路影响如图7所示,HCT-116细胞经HMA处理后细胞内Keap-1(Kelch-like epichlorohydrin-associated protein 1)、Nrf-2和HO-1的表达明显下降,蛋白的表达量且与HMA浓度呈负相关。此外,随着HMA浓度升高,HCT-116细胞胞核中Nrf-2蛋白表达明显下降,细胞质中Nrf-2蛋白表达明显上升,并且与浓度有关。图8显示HMA可显著抑制Nrf-2从细胞质中迁移至细胞核,进而抑制 Nrf-2入核与下游的多效应靶基因 ARE结合,使转录产物包括HO-1等多种抗氧化酶的表达降低。综合以上,HMA诱导人结直肠癌HCT-116细胞凋亡的机制与Nrf-2的核移位及Keap-1/Nrf2/HO-1信号通路有关。
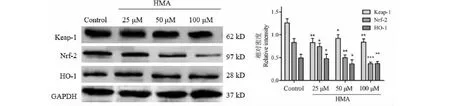
图7 HMA对HCT-116细胞内Keap-1/Nrf-2/HO-1信号通路转导的影响Fig.7 The effect of HMA on the expression of Keap-1/Nrf-2/HO-1 signal pathway in HCT-116 n =3)
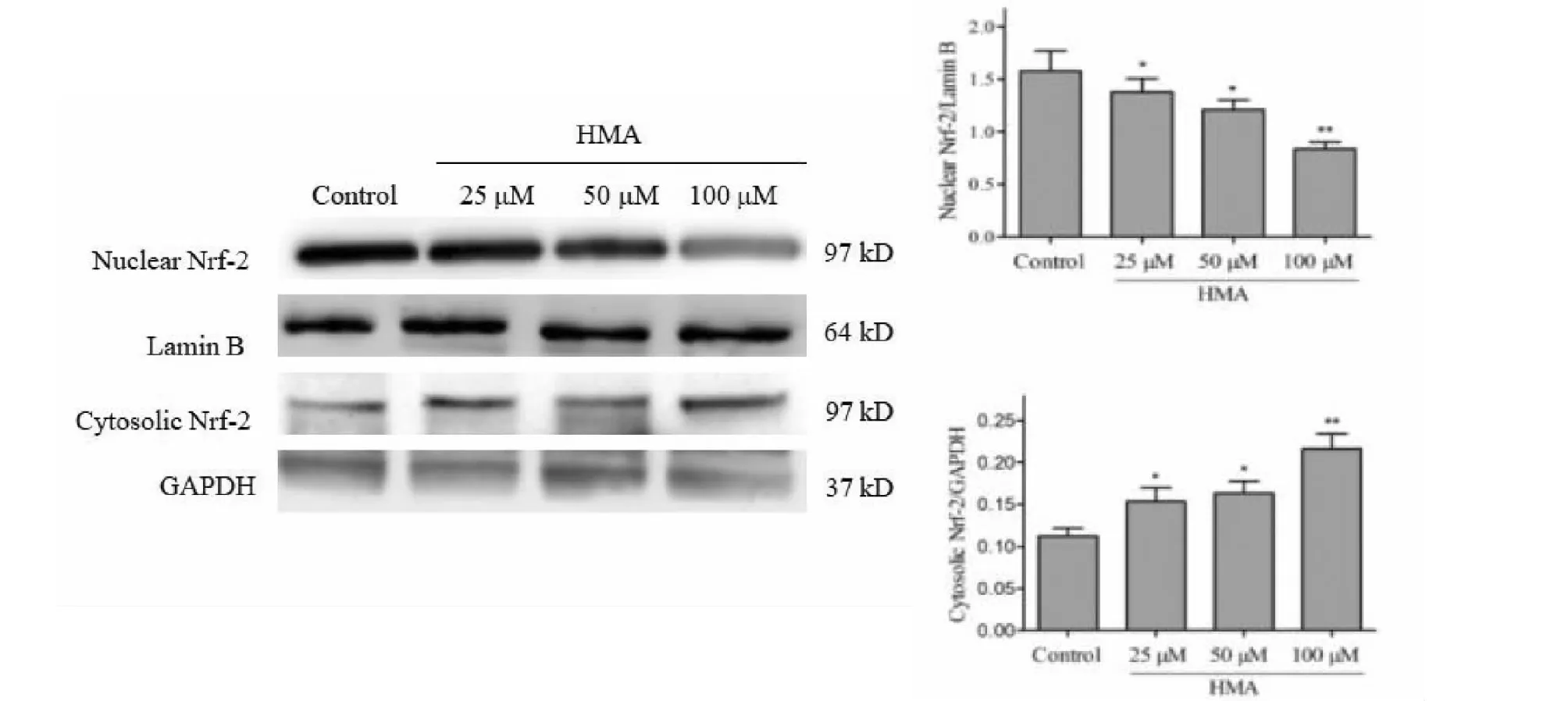
图8 HMA对HCT-116细胞Nrf-2核移位的影响Fig.8 The effect of HMA on the expression of Nrf-2 in HCT-116 n =3)
3.7 氧化还原水平改变,对细胞凋亡影响的验证
为探讨HMA诱导HCT-116细胞凋亡是否与其促氧化作用有关,HCT-116细胞预先加入1 mM NAC 1 h后与50 μΜ HMA共同作用24 h,再采用FITC-Annexin V/PI双染对细胞凋亡率进行检测,结果如图9所示,NAC可显著抑制HCT-116细胞凋亡,细胞凋亡率由51.32%±3.45%(对照组)变为23.6%±3.91% (50 μΜ HMA+1 mM NAC)。

图9 NAC对HMA诱导细胞凋亡的逆转Fig.9 The reversal effect of NAC on apoptosis induced by n =3)
4 讨论
细胞内氧化还原的平衡状态是细胞存活的关键。当细胞内ROS产生过量或抗氧化系统受抑制时,会出现氧化还原失衡,进而诱导细胞发生氧化应激。细胞内氧化应激水平过高时则会进一步诱导细胞发生坏死或凋亡[9,10]。在本项研究中,我们首先检测了化合物HMA作用HCT-116细胞48 h后细胞内ROS/GSH含量的变化及给药后细胞增殖情况。发现,在给予HMA后,结直肠癌细胞内的ROS水平升高、GSH水平显著下降。为验证HMA引起的细胞内ROS累积与其诱导细胞凋亡的关系,我们用还原剂N-乙酰半胱氨酸(NAC)预处理细胞后,再给予化合物HMA观察细胞的凋亡率。结果显示,NAC可降低HMA诱导的细胞凋亡。因此,HMA诱导HCT-116细胞凋亡与细胞内ROS聚集,GSH含量下降,细胞内氧化还原水平失衡有关。
Keap1和Nrf-2共同组成的Keap1/Nrf-2信号通路,具有维持氧化和抗氧化的平衡以及抑制细胞凋亡等多种生物学效应[11,12]。正常细胞内的Nrf-2受到胞质中抑制剂Keap1的严格调控。当细胞受到氧化应激刺激时,Keap1发生构像改变,激活Nrf2从泛素结合部位脱落并进入细胞核,并可与下游的ARE(anti oxidantre-sponseelement)结合发生反应,介导一系列抗氧化应激酶如 MnSOD、HO-1的产生,提高机体抗氧化能力[13,14]。本实验发现,HCT-116结直肠癌细胞经HMA处理后细胞内Keap-1、Nrf-2和HO-1的表达下降。此外,随着HMA浓度升高,结直肠癌细胞胞核中Nrf-2 蛋白表达明显下降而细胞质中Nrf-2 蛋白表达明显上升。综上,HMA作用机制如图10所示:HMA通过Keap-1/Nrf-2/HO-1通路破坏了细胞内的氧化还原平衡,进而引起细胞发生凋亡。
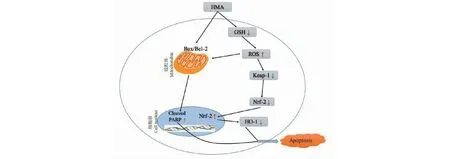
图10 HMA作用机制简图Fig.10 The anti-proliferative mechanism of HMA
白花蛇舌草做为清热解毒药物,可通过诱导肿瘤细胞凋亡、调控细胞能量代谢、增强机体免疫功能等发挥抗肿瘤作用[15,16]。蒽醌做为其有效成分之一,具有抑制多种肿瘤细胞增殖的作用[7],但其作用机制尚未完全阐明。本研究表明,HMA通过调控Nrf-2/ARE抗氧化信号通路,诱导细胞内ROS聚集及GSH的降解,破坏了细胞内的氧化还原平衡,诱导细胞发生凋亡。本研究探索了HMA诱导结直肠癌细胞凋亡的作用及可能的分子机制,以期为白花蛇舌草及其活性化合物的临床应用提供可靠的理论基础和实验依据。
