山楝枝叶中两个新的倍半萜
2021-03-08秦天丽陈彦伍吴石丽李明明何红平
秦天丽,陈彦伍,吴石丽,张 凡,李明明,何红平,
1云南中医药大学中药学院;2云南中医药大学民族医药学院,昆明 650500
山楝Aphanamixispolystachya是楝科(Meliaceae)山楝属(Aphanamixis)植物,在我国主要分布于广东、广西、云南等地区[1,2]。山楝属植物始载于《新华本草纲要》,其味辛,性温。归肝、肾经,主治风寒痹症、屈伸不利、拘挛、四肢麻木等症状[3]。山楝之所以备受关注,是源于其种子、树皮、叶子、果实等作为植物药在民间的广泛使用[4]。目前已有文献报道山楝中化学成分主要包括柠檬苦素类衍生物、三萜、二萜、倍半萜和甾体等化合物[5-9]。活性研究表明,该种分离得到的化合物具有杀虫、抗肿瘤、抗炎等生物活性[9-12]。前期我们课题组对楝科山楝属植物的化学成分进行了系列研究和报道[13-16],近期本课题组对山楝枝叶展开了化学成分研究工作,从其95%乙醇提取物的乙酸乙酯萃取部分分离得到了9个化学成分。本文详细介绍了9个化合物的分离纯化、结构鉴定和生物活性。
1 材料与方法
1.1 仪器与材料
Bruker Avance NEO 400 MHz型超导核磁共振仪(德国Bruker公司);Agilent 1260 infinity 液相色谱仪(美国安捷伦科技有限公司);半制备柱Zorbax SB-C18柱(5 μm,9.6 mm×250 mm);美国Agilent UPLC/Q-Tof液质联用仪;JASCO P-1020旋光仪;Bio-Rad FTS-135红外光谱仪;岛津紫外-2401PC分光光度计(日本东京岛津);Sephadex LH-20(40~70 μm,Amersham Pharmacia Biotech AB);硅胶(80-100目和100~200目);试验中所用试剂均为分析纯或色谱纯。
山楝枝叶于2017年11月采自云南省西双版纳,由昆明植物所陈瑜老师鉴定为山楝属植物山楝Aphanamixispolystachya的干燥枝叶。标本现存于云南中医药大学民族中药质量标准重点实验室,保存编号为H20171105。
1.2 提取与分离
将21 kg干燥的山楝枝叶粉碎,用5倍体积的95%乙醇加热回流提取3次,每次1 h,所得提取液减压浓缩至无醇味,得总浸膏2.6 kg。浸膏用蒸馏水溶解后依次用石油醚和乙酸乙酯萃取3次,分别得到石油醚部分0.7 kg和乙酸乙酯部分1.3 kg。
乙酸乙酯部分经硅胶柱色谱,以石油醚-丙酮(50∶1→6∶4)及氯仿-甲醇(10∶1→0∶1)体系进行梯度洗脱,TLC检测合并后得到8个组分Fr.1~8。其中Fr.1经MCI柱色谱,甲醇/水(9∶1)脱除色素,再经硅胶柱色谱,石油醚-丙酮梯度(梯度情况)洗脱,得到四个组分Fr.1-1~Fr.1-4。 Fr.2经RP-18色谱柱分段(甲醇-水,20%→100%),以及Sephadex LH-20柱(甲醇)和HPLC半制备分离,以乙腈/水(48∶52)为流动相(tR= 34 min),得到化合物3(12 mg),以乙腈/水(69∶31)为流动相(tR= 32 min),得到化合物4(27 mg)。Fr.3经RP-18色谱柱分段(甲醇-水,20%→100%),得四个组分(Fr.3-1~Fr.3-4),Fr.3-2经RP-18色谱柱和Sephadex LH-20(氯仿-甲醇)柱分离得到化合物5(236 mg)。Fr.3-3经Sephadex LH-20(甲醇)柱纯化得到化合物9(135 mg)。Fr.4 经硅胶柱层析和重结晶纯化,得到化合物6(136 mg),剩余部分再经Sephadex LH-20柱(甲醇)和HPLC半制备得到2(10 mg,乙腈/水,58∶42,tR= 34 min)、1(8 mg,乙腈-水,58∶42,tR= 36 min)。 Fr.5经MCI柱色谱,甲醇/水(9∶1)脱除色素,再经RP-18色谱柱分段(甲醇-水,10%→100%),得到得5个组分(Fr.5-1~Fr.5-5)。Fr.5-2经硅胶,Sephadex LH-20(氯仿-甲醇)柱色谱后得到化合物7(150 mg)和化合物8(86 mg)。
1.3 活性测试
采用脂多糖(LPS)诱导的小鼠巨噬细胞RAW 264.7模型评价化合物抑制NO产生的活性[17,18]。实验以NG-单甲基-L-精氨酸乙酸盐(L-NMMA)作阳性对照,设置空白组、模型组(LPS组)、溶剂组(DMSO组)、溶剂模型(DMSO+LPS)、阳性药物组(LPS+L-NMMA)和化合物实验组。RAW264.7细胞在37 ℃,CO2浓度为5%的培养条件下接种于96孔细胞培养板(1.5×105细胞/孔),培养24 h。在实验组化合物以梯度变化,分别加入100、50、25、12.5和6.25 μg/mL的待测样品,孵育1 h后加入20 μL LPS作用18 h。收集上清,用Griess法检测细胞上清液中NO水平。同时用MTS法评价RAW264.7细胞的存活率,以消除受试化合物细胞毒性的干扰。
2 结果与讨论
2.1 结构鉴定

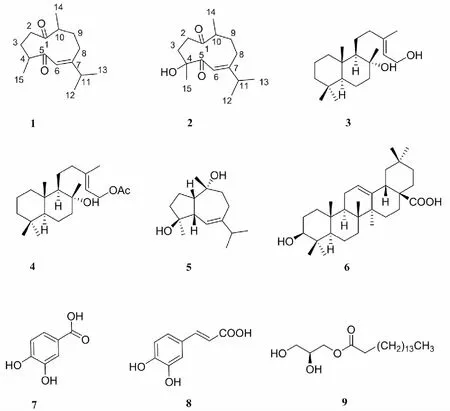
图1 化合物1~9的化学结构Fig.1 Structures of compounds 1-9


表1 化合物1和2的1H NMR和13C NMR数据(CDCl3)Table 1 NMR spectral data of compounds 1 and 2 in CDCl3
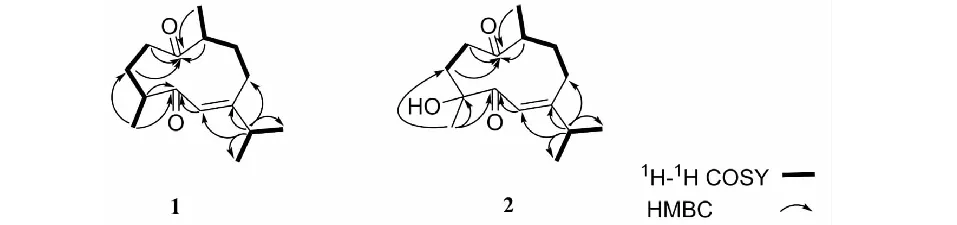
图2 化合物1和2的主要1H-1H COSY和 HMBC相关Fig.2 1H-1H COSY and HMBC correlations of 1 and 2


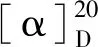
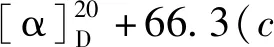
化合物7白色粉末;C7H6O4,ESI-MS:m/z155 [M+H]+;1H NMR(400 MHz,CD3OD)δ:7.34(1H,br s,H-2),6.69(1H,d,J= 8.0 Hz,H-5),7.32(1H,dd,J= 8.0,2.0 Hz,H-6);13C NMR(100 MHz,CD3OD)δ:123.4(C-1),115.9(C-2),145.2(C-3),151.7(C-4),124.0(C-5),117.9(C-6),170.4(COOH)。其波谱数据与文献报道一致[23],故鉴定其为3,4-二羟基苯甲酸。
化合物8白色粉末;C9H8O5,ESI-MS:m/z181 [M+H]+;1H NMR(400 MHz,CD3OD)δ:6.24(1H,d,J= 16.0 Hz,H-2),7.55(1H,d,J= 16.0 Hz,H-3),7.06(1H,d,J= 2.0 Hz,H-5),6.94(1H,dd,J= 8.0,2.0 Hz,H-6),6.81(1H,d,J= 8.0 Hz H-7);13C NMR(100 MHz,CD3OD)δ:170.0(C-1),116.4(C-2),146.9(C-3),127.7(C-4),115.0(C-5),146.6(C-6),149.3(C-7)115.4(C-8),122.7(C-9)。其波谱数据与文献报道一致[24],故鉴定其为反式咖啡酸。
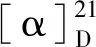
2.2 活性测试结果
对新化合物活性测定结果显示,化合物1和2抑制NO生成的IC50值分别为1 162.0和259.3 μg/mL(阳性对照L-NMMA的IC50为14.7 μg/mL),对脂多糖诱导的RAW 264.7细胞NO生成没有表现出明显的抑制活性。
3 结论
本实验通过对山楝枝叶的化学成分进行研究,从中分离得到了9个化合物,包含倍半萜、二萜和酚酸类成分。化合物1和2为两个新的含有十元环结构的倍半萜,其生源上可能是由愈创木型倍半萜1,5-开环得来。化合物4、7、8和9为从该植物中首次分离。迄今为止,从山楝中分离的化学成分主要为柠檬苦素类化合物和一些链状二萜类成分[5-8,14,15],倍半萜、半日花烷型二萜类和酚酸成分报道较少,本研究丰富了山楝中化学成分的结构类型,为山楝的资源化利用提供理论基础。
