恰米烷型倍半萜
——结构和生物活性
2021-09-30刘吉开
冯 涛,刘吉开
(中南民族大学 药学院,湖北 武汉 430074)
在天然产物中,倍半萜是数量庞大而及其重要的一类.倍半萜类化合物是由3个异戊二烯单位构成,含有15个碳原子.其广泛存在于植物、微生物、海洋生物以及某些昆虫之中,具有重要的生物功能.例如从坎洛树中分离出来的drimane类倍半萜成分,发现其对α4β2烟碱乙酰胆碱受体的非竞争性抑制作用高于人α3β4和α7亚型,可用于开发新的抗成瘾抗抑郁配体[1];从柳珊瑚Isishippuris中分离得到的倍半萜suberosenol A、suberosanone和suberosenol B acetate对P-388、A549和HT-29癌细胞系具有良好的细胞毒活性[2];在食用菌金针菇Flammulinavelutipes中发现抑制HMG-CoA还原酶的倍半萜成分[3];以及获诺贝尔奖的青蒿素,都是倍半萜类成分.在诸多倍半萜结构类型中,有一类结构特殊,具有螺[5,5]十一烷双环结构体系,被称为恰米烷型倍半萜(图1).近年来,越来越多的恰米烷型倍半萜被发现,其表现出结构和生物活性的多样性.本文将不同来源的恰米烷型倍半萜进行综述,总结其结构和生物活性,以期推动对该类成分的深入研究.
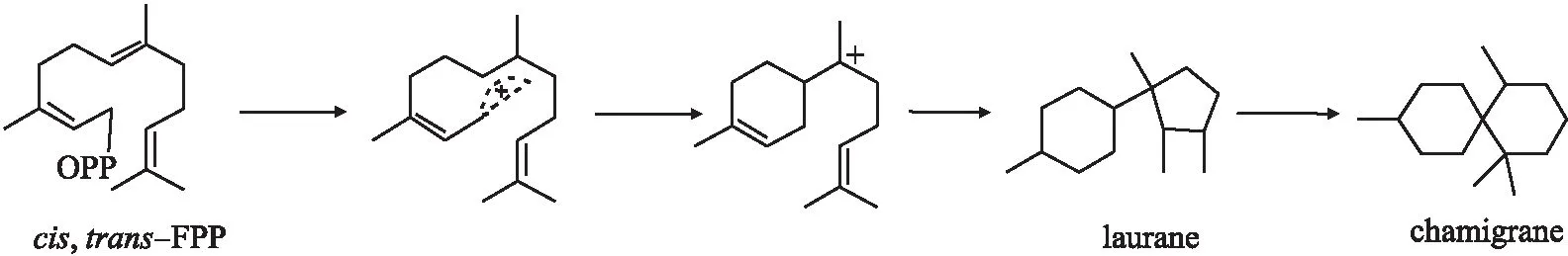
图1 Chanigrane 倍半萜生物合成途径
1 海洋生物中的恰米烷型倍半萜
迄今为止被报道的恰米烷型倍半萜绝大多数来源于红藻Laurencia属[4-8].1970年,海洋生物中首个含有螺原子的倍半萜结构1是从LaurenciaglanduliferaKutzing中分离出来[4].1976年,Minoeu Suzukid等从L.glandulifera分离得到10-bromo-or-α-chamigrene(2),glanduliferol(3),10-bromo-or-α-chamigren-4-one(4),4,10-dibromo-7,8-epoxy-α-chamigrene(5),和10-bromo-3,4-epoxy-α-chamigrene(6)并确定了化合物的绝对构型[9].1977年,Warazkiewicz等从L.Nidifica中分离得到nidifocene(7)[10].1982年,Furusaki 等从L.Nipponica[11]中成功获得3-chloro-4,10-dibromo-7,8-epoxy-α-chamigrene(9)单晶并详细进行了晶体学研究,证实了前面绝对构型的判断[9,12].1983年,Kazuya Kurata 等依据从L.nipponica中分离得到的diepoxy-monoacetate(11)的晶体衍射数据推出了化合物10的结构[13].由10-debromo衍生物13和化合物16的晶体衍射数据对iso-obtusol(15)和obtusol(12)进行了修正,obtusane(17)也通过X线晶体衍射被确定了绝对构型[14].1989年,Elsworth 在L.Glomerata中分离得到1个新的恰米烷型倍半萜(18)[15].
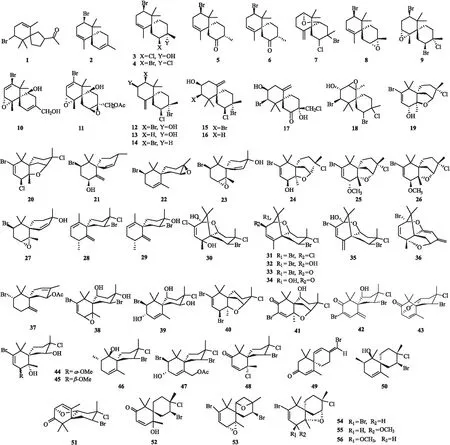
图2 海洋生物中的恰米烷型倍半萜
在2008至2012年间发现的新恰米烷型倍半萜较多.例如从L.Saitoi中发现了化合物(8β)-10-bromo-3chloro-2,7-epoxy chamigr-9-en-8α-ol(19)[16],在L.Okamurai中发现了4个新化合物laurokamin B(20)、10-bromo-β-chamigren-8-ol(21)、laurokamin C(22)和10-bromo-7α,8α-epoxychamigren-1-en-3-ol(23),其中化合物23对盐水虾有细胞毒活性[17].从L.composite中发现了1个新的恰米烷型倍半萜(8β)-10-bromo-3chloro-2,7-epoxy chamigr-9-en-8-ol(24)[18],从澳大利亚的L.elata中发现了化合物cycloelatanenes A(25)和B(26)[19].从巴西的L.microcladiaKutz中第一次发现了化合物 elatol(27),并发现黑海胆Echinometralucunter体内含有大量的化合物27,证实了黑海胆对该海藻具有嗜食性[20].Adriana 等还发现化合物27具有抗鞭毛虫作用[21].从L.okamurai中发现2个重排的恰米烷型倍半萜laorokamins A (28)和B(29),原有的偕二甲基从C-10位发生重排迁移至C-10和C-7位[22].
2013年余小青报道了19个新的恰米烷型倍半萜30~48,均从复生凹顶藻L.composite中分离获得[23].2016年从L.tristicha中分离得到化合物49,经活性测试发现具有良好的抗菌活性[24].2018年,从L.compositeYamada 分离得到多个恰米烷倍半萜[25],包括1个重排的倍半萜compositacin A(50)以及2个在C-5/C-9 和C-3/C-5形成醚键的恰米烷倍半萜51和53,且在C-10位首次发现羰基.发现了化合物54对真菌Microsporumgypseum具有良好的抑制活性,MIC80为 4 μg/mL,而化合物53~56对人肺腺癌细胞A-549具有微弱的毒性,IC50在48.6~85.2 μmol/L 之间[25],化合物结构见图2.
2 真菌中的恰米烷型倍半萜
迄今为止从真菌中报道恰米烷型倍半萜数量不多[26].在高等真菌中只有4个恰米烷型倍半萜被报道.2010年从担子菌Steccherinumochraceum分离得到2个含有过氧桥环的恰米烷型倍半萜steperoxides A(57)和B(58)[27],同年又从中分离得到化合物steperoxides C(59)和D(60),经活性测试发现化合物60具有良好的抑制金黄色酿脓葡萄球菌的作用,在10和 5 μg/disk 的抑制范围是22和 19 mm[28].
在植物内生菌中少量恰米烷型倍半萜被报道.2010年Supichar Chokpaiboon等从泰国红树林Xylocarpusgranatum内生真菌中分离得到3个新恰米烷型倍半萜merulines A-C(61~63),经活性测试发现化合物61和63对BT474(人乳腺癌细胞)和SW620(结肠癌细胞)表现出强烈的细胞毒性,对BT474的IC50值分别为4.98和 1.57 μg/mL,对SW620的IC50值为4.84和 4.11 μg/mL,化合物62没有明显的抗肿瘤活性[29].2011年该课题组对该菌种进行扩大发酵,继续对其次生代谢产物进行分离,得到1个新的恰米烷型倍半萜化合物meruline D(64).对分离到的meruline A~D和steperoxide A进行活性探究,发现meruline C主要通过抑制内皮细胞的增殖和迁移以剂量依赖性的方式表现出较强的抗血管生成活性,其作用是通过降低Erk1/2的磷酸化来介导的,同时在大鼠主动脉环发芽(体外)和小鼠Matrigel(体内)试验中,merulinC也表现出良好的活性.他们还发现steperoxide A和merulinC是C-4/C-7位的过氧桥环,steperoxide A的活性稍微弱于merulinC,但是其余C-2/C-7过氧桥环的化合物没有表现出相应活性,因此他们认为C-4/C-7位的过氧桥环在构效中起着至关重要的作用[30].
从来自红树林Sonneratiaapetala的植物内生真菌Talaromycesflavus中分离得到4个新化合物talaperoxides A-D(65~68),经活性测试发现化合物talaperoxides B和D对5种癌细胞(MCF-7, MDA-MB-435, HepG2, HeLa和PC-3)具有细胞毒性,IC50值在0.70~2.78 μg/mL 之间.但是对金黄色酿脓葡萄球菌、大肠杆菌、胃八迭球菌、绿脓假单胞菌、白色念珠菌和黑曲霉菌都没有表现出良好的抑制活性.构效关系分析显示,C-7位碳的绝对构型对化合物活性起关键作用[31].
2016年,从红树林植物Bruguieragymnorrhiza的内生真菌Pseudolagarobasidiumacaciicol中分离得到一系列恰米烷型倍半萜acaciicolinolides A~C和acaciicolinols A~L,活性测试结果发现具有过氧桥环的化合物有较好的生物活性,提出倍半萜内过氧化物的细胞毒性活性可能来自由内过氧化物同解裂解产生的反应自由基.如此的辐射钙物种反过来又可以与细胞存活所需的生物分子(酶或蛋白质)反应,从而抑制细胞生长[32].同年在泰国红树林Xylocarpusgranatum叶片中分离出来的植物内生菌XG8D中分离得到6个新的恰米烷型倍半萜merulinols A~G(69~74).经活性测试后发现化合物71和72对KATO-3细胞具有细胞毒活性,IC50值分别为33.80~36.20和24.48~25.82 μmol/L[33].
3 植物中的恰米烷型倍半萜
在植物中分离得到的恰米烷型倍半萜凤毛麟角.2000年在五味子果实中首次被发现75[34],2013年在药用植物Leonurusjaponicus再次被分离得到,经活性测试发现该化合物对3种革兰氏阳性菌(Macrococcuscaseolyticus、Staphylococcusauricularis、Staphylococcusaureus)有抑制作用,MIC分别为25、50、200 μg/mL[36],真菌中的恰米烷型倍半萜(57~74)和植物中的恰米烷型倍半萜(75)化合物结构见图3.
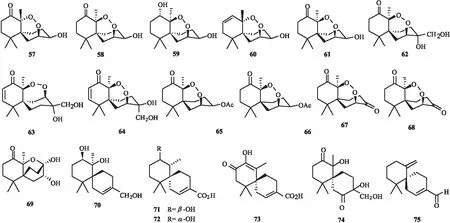
图3 真菌和植物中的恰米烷型倍半萜
4 总结与展望
恰米烷型倍半萜具有复杂多样的化学结构和生物活性多样性.可从化学结构入手探究其构效关系,从已有数据发现:
1) 恰米烷型倍半萜目前主要来源于海洋生物,多被卤素原子取代,红藻Laurencia属含量较多,结构变化主要来自碳原子的重排、取代基的变化以及醚键环系的生成.
2) 恰米烷型倍半萜的结构中多在C-4/C-7或C-2/C-7位上有过氧桥环相连接,并且研究表明C-4/C-7有过氧桥环的化合物具有较强的生物活性;且另一项研究表明C-7位碳原子的绝对构型与是否具有更好的生物活性相关,对今后探究不同结构的构效关系具有很大的研究意义.
3) 从植物及其它资源中发现的恰米烷型倍半萜很少,预示着真菌中含有该类型成分的特定生物合成基因.
