秋水仙碱片溶出度一致性评价*
2021-03-08李霞闫富龙柯寄明方晓琳陈卫东彭灿
李霞,闫富龙,柯寄明,方晓琳,陈卫东,2,3,4,5,彭灿,2,3,4
(1.安徽中医药大学药学院,合肥 230012;2.安徽省教育厅现代药物制剂工程技术研究中心,合肥 230012;3.中药复方安徽省重点实验室,合肥 230012;4.安徽省中医药科学院药物制剂研究所,合肥 230012;5.安徽中医药大学药物代谢研究所,合肥 230012)
秋水仙碱是一种典型的细胞有丝分裂毒素,结构中的C环与微管蛋白结合可阻止其聚合成纺锤丝,使细胞有丝分裂停止于中期。该药属于生物药剂学分类系统(biopharmaceutics classification system,BCS)中的Ⅲ类药物[1-3],即高溶解、低渗透药物,临床主要用于治疗痛风,治疗家族性地中海热和心包炎等也有效[4-7]。目前国内市场上生产秋水仙碱片仿制药的厂家较多,不同厂家生产的同一制剂或同一生产厂家不同批号产品质量和疗效可能存在一定差异。但文献有关秋水仙碱片溶出度的研究笔者较少见到,且多局限于单一溶出介质,如水[8]。在多种溶出介质下溶出曲线测定已成为国内外评价固体制剂内在品质的重要手段,是提高仿制药生物等效性实验成功率的必经之路。笔者在本实验以秋水仙碱为模型药物,根据2015年版《中华人民共和国药典》及文献[8],采用小杯法建立秋水仙碱片在水、pH值4.5醋酸盐缓冲液和pH值6.8磷酸盐缓冲液3种不同溶出介质中溶出方法,并采用f2相似性因子评价5个不同厂家秋水仙碱片溶出曲线相似性,以期为国内企业秋水仙碱片仿制药质量一致性评价研究工作和处方工艺开发提供参考。
1 仪器与试药
1.1仪器 Waters ACQUITY Arc高效液相色谱仪系统(美国Waters公司,2489紫外检测器,2424蒸发光散射检测器);YL-060数控超声波清洗器(济南巴克超声波科技有限公司,360 W,40 Hz);电子天平(赛多利斯科学仪器有限公司,感量:0.01 mg);ZRS-8L智能溶出实验仪(天津天大天发科技有限公司)。
1.2试药 秋水仙碱片样品信息见表1。盐酸、冰醋酸、醋酸钠、磷酸二氢钾、氢氧化钠均为分析纯,实验用水为超纯水,甲醇为色谱纯。
2 方法与结果
2.1方法学考察
2.1.1色谱条件 参考2015年版《中华人民共和国药典》及文献[9-10],色谱柱:Unitaryl C18柱(250 mm×4.6 mm,5 μm) ;流动相:甲醇-水(52:48);检测波长:254 nm;柱温:30 ℃;流速:1.0 mL·min-1;进样量:20 μL。
2.1.2溶液的配制 ①对照品溶液的制备:精密称取秋水仙碱对照品3 mg,置50 mL棕色量瓶,分别用相应溶出介质溶解并稀释至刻度,摇匀,作为对照品储备液。②供试品溶液的制备:取秋水仙碱片,分别在水、pH值4.5醋酸盐缓冲液以及pH值6.8磷酸盐缓冲液3种溶出介质条件下实验,取溶出液用孔径0.22 μm微孔滤膜滤过,取续滤液即得。
2.1.3专属性考察 分别取对照品溶液、供试品溶液以及空白对照溶液,照“2.1.1”项色谱条件进样测定,记录色谱图。结果表明空白对照对测定无干扰,对照品溶液中的秋水仙碱峰与供试品溶液中的秋水仙碱峰保留时间相同,表明该方法专属性良好。结果见图1。
2.1.4线性关系实验 精密量取对照品储备液适量,分别用3种溶出介质稀释,得到浓度约0.05,0.1,0.2,0.5,2.5和5.0 μg·mL-1秋水仙碱系列对照品溶液。精密量取秋水仙碱系列对照品溶液20 μL,照“2.1.1”项色谱条件进样测定,以秋水仙碱浓度(X) 为横坐标,峰面积(Y) 为纵坐标,绘制标准曲线,回归方程见表2。结果表明,秋水仙碱在0.05~5.0 μg·mL-1范围内线性关系良好。
2.1.5精密度实验 取“2.1.3”项对照品溶液,照“2.1.1”项色谱条件重复测定6次,结果3种介质中秋水仙碱峰面积的RSD分别为0.26%,0.77% 和0.62%,表明仪器精密度良好。
2.1.6稳定性实验 取“2.1.3”项3种介质供试品溶液适量,分别于室温下放置0,2,4,6,8,12,24 h后,照“2.1.1”项色谱条件进样测定,结果3种介质中秋水仙碱峰面积的RSD分别为为2.9%,1.6%和3.7%,表明供试品溶液在24 h内稳定性良好。
2.1.7加样回收率实验 取秋水仙碱片20片,研细,精密称取适量(相当于秋水仙碱0.5 mg)置100 mL量瓶,加溶出介质适量,超声使药物溶解,定容。在已知浓度不同溶出介质的秋水仙碱溶出液中,分别加入相当于秋水仙碱含量80%,100%和120%的对照品,用相应溶出介质超声溶解并稀释至刻度,摇匀,过滤,即得3种不同浓度溶液,每个浓度平行制备3份,取续滤液按“2.1.1”项条件测定,结果见表3,表明方法回收率良好。
2.2溶出度测定
2.2.1溶出度测定方法 参照《中华人民共和国药典》2015年版四部溶出度测定方法小杯法(通则0931第三法)[11],取本品12片,依次以水、pH值4.5醋酸盐缓冲液、pH值6.8磷酸盐缓冲液200 mL为溶出介质,转速为50 r·min-1,分别于 5,10,15,20,30,40,50,60,90,120,180 min 取样1 mL,同时补加等量同温溶出介质,以孔径0.22 μm微孔滤膜过滤,取续滤液进样,记录色谱图,采用高效液相色谱(HPLC)法测定峰面积,计算溶出量,以时间为横坐标,累积溶出百分率为纵坐标,绘制溶出曲线。
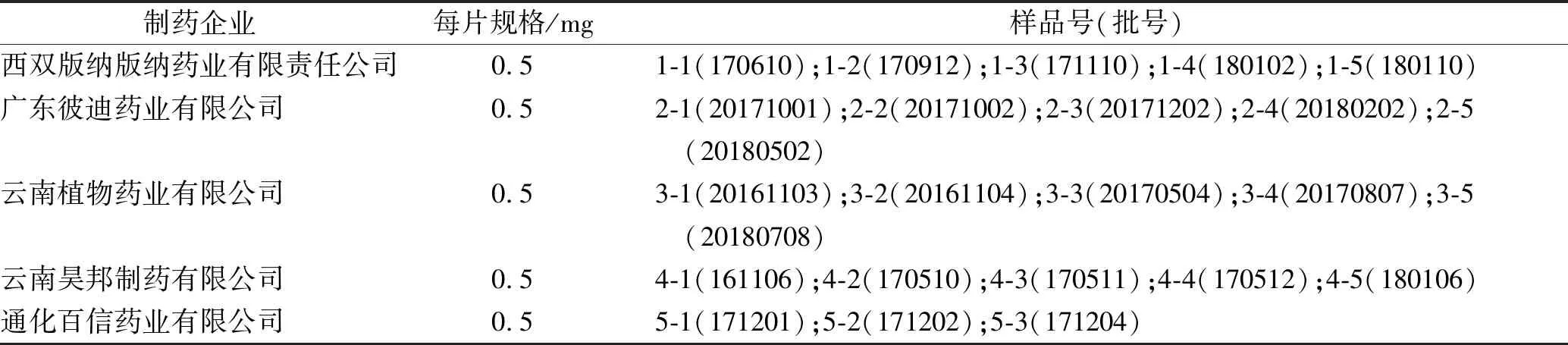
表1 秋水仙碱片样品信息
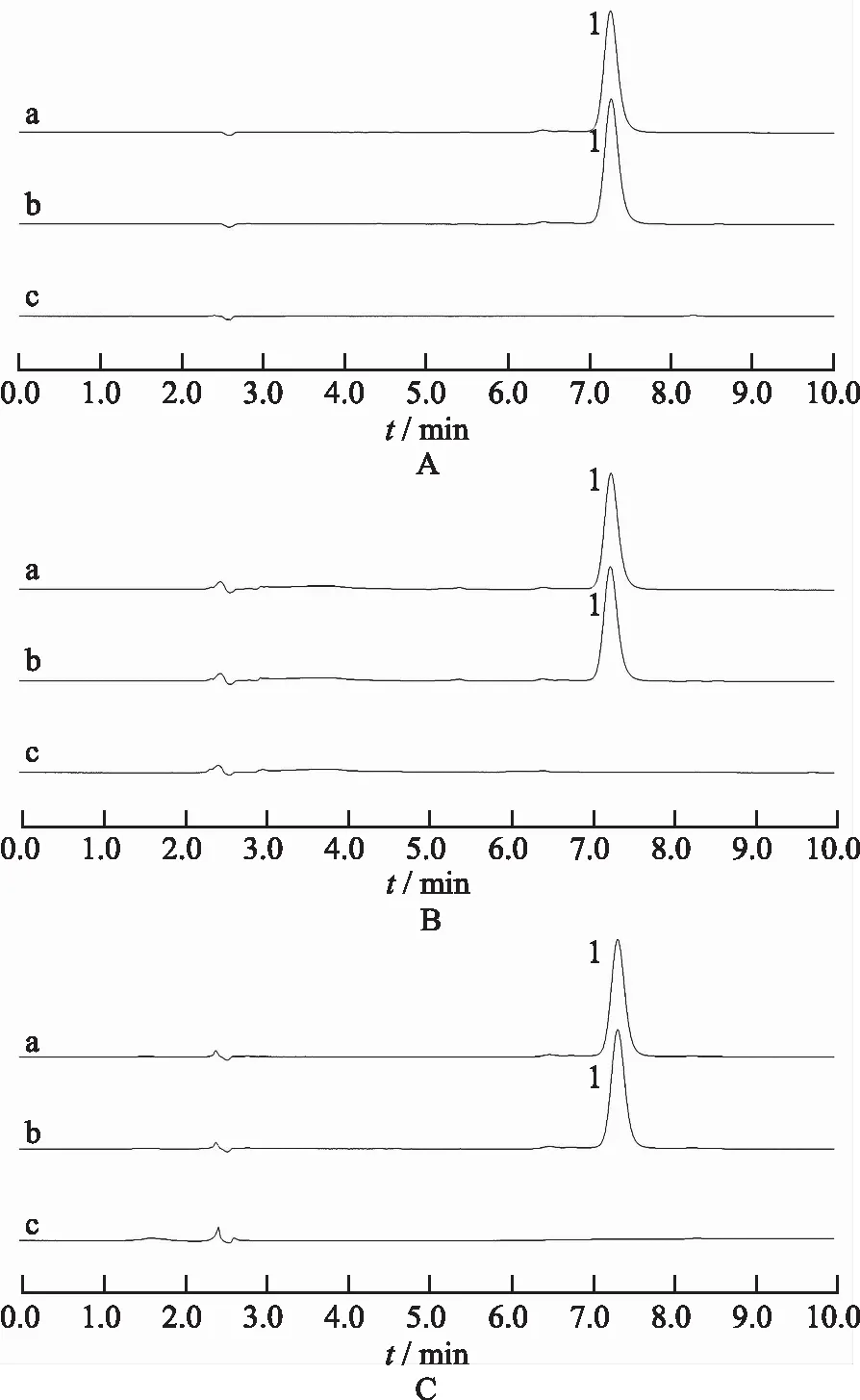
a.对照品;b.供试品;c.空白对照品;1.秋水仙碱;A.水;B.pH值4.5醋酸盐缓冲液;C.pH值6.8磷酸盐缓冲液。

表2 回归方程与线性范围
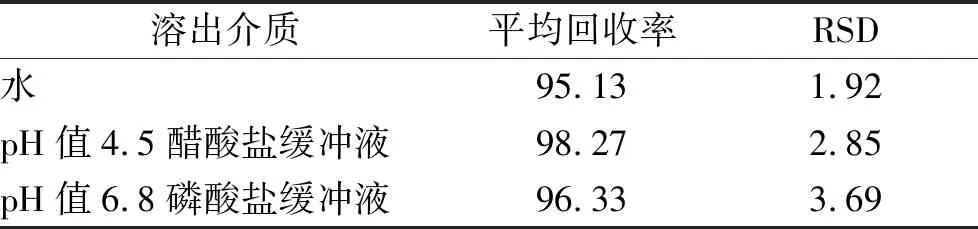
表3 回收率实验结果
累积溶出百分率:(RN%)=Mn/M标
Mn为累积溶出量(mg),RN%为累积溶出百分率,V1为溶出介质体积,V2为每次取样体积,Cn为第n个时间的溶出浓度,Ci为第i个点的溶出浓度,M标为秋水仙碱片标示量(mg)。
5个厂家不同批次秋水仙碱片在水、pH值4.5醋酸盐缓冲液、pH值6.8磷酸盐缓冲液3种溶出介质中的累积溶出曲线图如图2所示。

A、B.介质水;C、D.介质pH值4.5醋酸盐缓冲液;E、F.介质pH值6.8磷酸盐缓冲液。

式中Rt与Tt分别代表受试制剂与参比制剂在时间点t时的累积溶出百分率,n为取样点的个数。本实验采用样品2-1作为参比制剂。
当50≤f2≤100 时,表明两种制剂的溶出曲线相似。相似因子f2计算结果见表4。
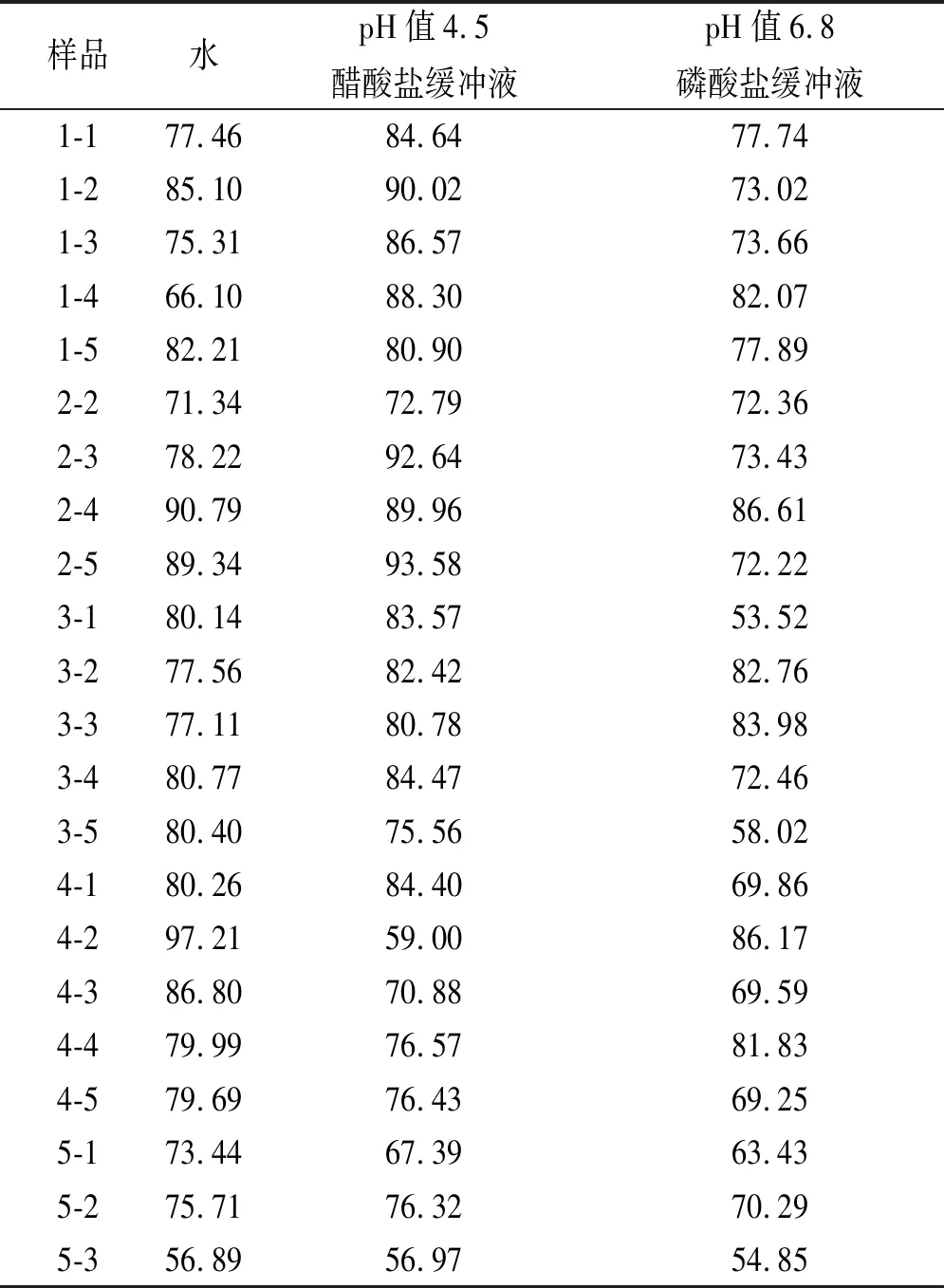
表4 f2因子结果统计
由表4可知,秋水仙碱片在水、pH值4.5醋酸盐缓冲液以及pH值6.8磷酸盐缓冲液中f2相似因子均在50~100内,说明不同厂家秋水仙碱片体外溶出行为一致。
3 讨论
3.1溶出度与相似因子 在我国药品市场上仿制药占比很大,但仿制药质量参差不齐,严重影响了药品安全和有效性评价。我国于2012年开始进行仿制药质量一致性评价工程。考察制剂在多种溶出介质下的溶出状况,可以全面反映制剂的内在质量[13]。近年来研究认为,基于生物药剂学分类系统(biopharmaceutics classification system,BCS)理论的溶出实验是最能替代药物生物等效性研究的体外实验方法。溶出曲线相似性比较的方法有很多,常见的有两条溶出曲线相似性参数法、模型依赖法,以及非模型依赖法等。模型依赖法参数物理意义不能解释清楚。而两条溶出曲线相似性参数法借鉴了相似等效限法中的逐点比较的做法,在计算中考虑到溶出值的差与溶出的离散度,并在结果判断中引入基本相似与整体相似的概念,计算简便。但是两条溶出曲线相似性参数法为点与点的比较,未考虑溶出值与时间的交互作用。笔者在本实验中采用非模型依赖法中f2相似因子法评价溶出曲线的相似性,该方法为国家食品药品监督管理总局(CFDA)推荐使用的方法,也是目前CFDA 推行的口服固体制剂质量一致性评价中使用最广泛的方法[14-16],该法简单迅速,可准确评价受试制剂和参比制剂的溶出行为差异。
笔者在本实验中选择了溶出行为较为稳定、溶出均一性良好的样品2-1作为参比制剂,且采用f2相似因子法评价5个不同厂家不同批次秋水仙碱片的溶出曲线相似性,这在一定程度上可以反映5个厂家片剂内在质量差异。若f2值≥50,则认为两条溶出曲线溶出行为相似。该方法简单,可用于快速评价受试制剂与参比制剂溶出行为的相似性。
3.2溶出介质的选择 固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。此外,溶出度实验应尽可能在生理条件下进行。根据《普通口服固体制剂溶出曲线测定与比较指导原则》及相关文献[13],需要考察参比制剂和仿制制剂在多种介质中溶出曲线的一致性。由于秋水仙碱是一种生物碱,在前期多次预实验中发现,秋水仙碱片在pH值1.2盐酸溶液的溶出实验中不稳定,所以笔者在本实验中主要考察了秋水仙碱片在水、pH值4.5醋酸盐缓冲液以及pH值6.8磷酸盐缓冲液中的溶出状况。
